宁夏吴忠市2022-2023学年高一下学期期末调研化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、选择题(本题共18小题,1~12题,每小题2分;13~18题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
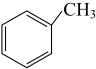
1. 我国科学家的科技创新成果斐然,下列成果中获得诺贝尔奖的是( )A、侯德榜联合制碱法 B、钮经义等在1965年合成结晶牛胰岛素 C、屠呦呦发现抗疟新药青蒿素 D、徐光宪建立稀土串级萃取理论2. 下列有关化学品使用的说法中,错误的是( )A、非处方药的包装上印有“OTC”标志 B、制作豆腐时可添加适量石膏作凝固剂 C、水果罐头中常加入维生素C作抗氧化剂 D、面包、饼干加工时常加入作蓬松剂3. 下列实验过程中,发生吸热反应的是( )A、Ba(OH)2·10H2O与NH4Cl混合,搅拌 B、镁条投入到稀盐酸中 C、稀硝酸与NaOH溶液混合 D、氢气在氯气中燃烧4. 下列转化属于氮的固定的是( )A、工业以氮气为原料合成氨 B、工业以氨气为原料合成硝酸 C、NO与反应生成和水 D、植物从土壤中吸收转化为氨基酸5. 下列说法正确的是( )A、石油的分馏、煤的气化和液化都是物理变化 B、天然气的主要成分甲烷是高效、较洁净的燃料 C、饱和硫酸铵溶液能使蛋白质发生变性 D、淀粉在一定条件下水解的最终产物是氨基酸6. 下列溶液不能鉴别和气体的是( )A、 B、品红 C、 D、溴水7. 下列反应不属于取代反应的是( )A、 B、 C、 D、8. 下列物质互为同分异构体的是( )A、和 B、和 C、碳纳米管和石墨烯 D、
 和
和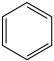 9. 下列反应对应的离子方程式正确的是( )A、亚硫酸氢钠溶液与氢氧化钾溶液反应: B、磁性氧化铁溶于盐酸: C、氯化亚铁溶液和稀硝酸混合: D、氨水与氯化铝溶液反应制取:10. 下列氧化物中,属于酸性氧化物的是( )A、 B、 C、 D、11. 下列说法中正确的是( )A、氨气能使湿润的蓝色石蕊试纸变红 B、使溴水褪色是因为具有漂白性 C、具有碱性,能跟盐酸反应 D、葡萄糖能与银氨溶液发生银镜反应12. 下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
9. 下列反应对应的离子方程式正确的是( )A、亚硫酸氢钠溶液与氢氧化钾溶液反应: B、磁性氧化铁溶于盐酸: C、氯化亚铁溶液和稀硝酸混合: D、氨水与氯化铝溶液反应制取:10. 下列氧化物中,属于酸性氧化物的是( )A、 B、 C、 D、11. 下列说法中正确的是( )A、氨气能使湿润的蓝色石蕊试纸变红 B、使溴水褪色是因为具有漂白性 C、具有碱性,能跟盐酸反应 D、葡萄糖能与银氨溶液发生银镜反应12. 下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )选项
待提纯的物质
选用的试剂
操作方法
A
乙醇()
生石灰
蒸馏
B
加热
C
酒精
萃取
D
酸性溶液
洗气
A、A B、B C、C D、D13. 如图为铜锌原电池示意图,下列说法正确的是( )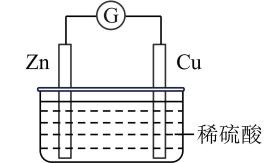 A、电池工作时,电能转化为化学能 B、锌片作负极,发生还原反应 C、铜电极的电极反应式为 D、电子从铜电极经导线流向锌电极14. 为阿伏加德罗常数的值,下列说法正确的是( )A、6.4 g铜粉与过量硫粉反应,铜失去的电子数目为 B、1 mol Fe溶于过量稀硝酸,转移电子数为 C、标准状况下,2.24 L乙炔中含有的共用电子对数目为 D、标准状况下,4.48 L 中含有的分子数目为15. 结构简式如下的有机物具有玫瑰香气,下列说法错误的是( )
A、电池工作时,电能转化为化学能 B、锌片作负极,发生还原反应 C、铜电极的电极反应式为 D、电子从铜电极经导线流向锌电极14. 为阿伏加德罗常数的值,下列说法正确的是( )A、6.4 g铜粉与过量硫粉反应,铜失去的电子数目为 B、1 mol Fe溶于过量稀硝酸,转移电子数为 C、标准状况下,2.24 L乙炔中含有的共用电子对数目为 D、标准状况下,4.48 L 中含有的分子数目为15. 结构简式如下的有机物具有玫瑰香气,下列说法错误的是( )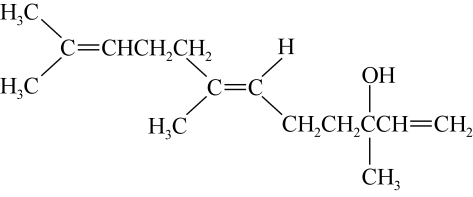 A、该有机物的分子式为 B、1mol该有机物在氧气中充分燃烧需消耗481.6 L(标准状况)氧气 C、该有机物既能发生取代反应,又能发生加成反应 D、该有机物既能跟溴的四氯化碳溶液反应,又能跟金属钠反应16. 下列实验装置能达到实验目的的是( )A、制备并收集
A、该有机物的分子式为 B、1mol该有机物在氧气中充分燃烧需消耗481.6 L(标准状况)氧气 C、该有机物既能发生取代反应,又能发生加成反应 D、该有机物既能跟溴的四氯化碳溶液反应,又能跟金属钠反应16. 下列实验装置能达到实验目的的是( )A、制备并收集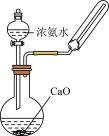 B、制备
B、制备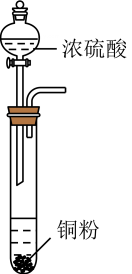 C、除去中的HCl
C、除去中的HCl D、制备并收集
D、制备并收集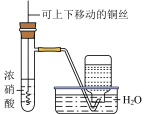 17. 由和制备(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示(加热和夹持装置省略),下列说法错误的是( )
17. 由和制备(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示(加热和夹持装置省略),下列说法错误的是( )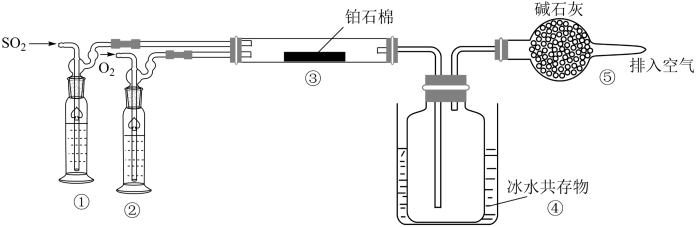 A、装置③中铂石棉用作反应的催化剂 B、装置①②的作用是干燥气体,并通过观察气泡监测气体流速 C、从装置⑤逸出的气体有和 D、装置④的作用是冷凝收集18. 铝土矿的主要成分是 , 还有部分、以及少量不溶于酸碱溶液的其他杂质。工业上从铝土矿中提取铝可采取如下工艺:
A、装置③中铂石棉用作反应的催化剂 B、装置①②的作用是干燥气体,并通过观察气泡监测气体流速 C、从装置⑤逸出的气体有和 D、装置④的作用是冷凝收集18. 铝土矿的主要成分是 , 还有部分、以及少量不溶于酸碱溶液的其他杂质。工业上从铝土矿中提取铝可采取如下工艺: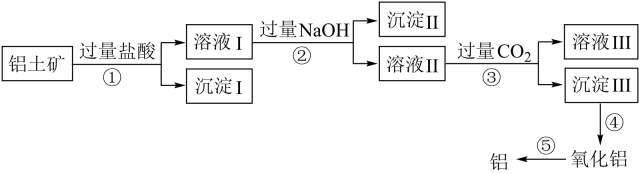
下列说法正确的是( )
A、沉淀Ⅰ只有 B、步骤②发生的反应为、 C、溶液Ⅲ中溶质主要为 D、步骤④操作用到的仪器主要有:坩埚、坩埚钳、泥三角、三脚架、酒精灯、玻璃棒二、非选择题(本题共5小题,共58分。)
-
19. 人类从自然界中获取各种化学物质。(1)、Ⅰ.从化石燃料可以获得多种有机物。
苯的分子式为。(2)、聚丙烯的结构简式为。(3)、下列物质中,与正丁烷互为同系物的是(填标号)。A.甲烷 B.乙烯 C.环己烷 D.异丁烷
(4)、Ⅱ.从矿石中可以获取多种材料。
常用的金属冶炼方法有:热分解法、高温还原法和电解法。铝的冶炼属于法。(5)、碳素钢是一种铁碳合金,碳素钢的硬度(填“大于”、“小于”)纯铁。(6)、下列材料中,属于有机高分子材料的是(填标号)A.玻璃 B.陶瓷 C.塑料 D.橡胶
(7)、Ⅲ.硫元素的化合价与其形成的物质类别关系如图所示。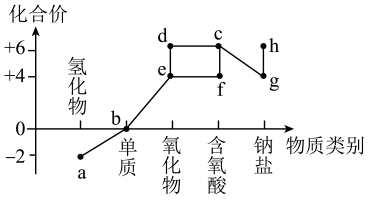
e的浓溶液使蔗糖炭化时,e的浓溶液主要表现性质。(8)、c气体使鲜花褪色时,c气体表现性质。(9)、g的固体与70%的e的浓溶液反应制备c气体时,发生(填“氧化还原反应”或“非氧化还原反应”)。(10)、工业上用过量氨水吸收c气体,反应的离子方程式为。20. 研究化学反应的原理,对掌握物质的应用有重要的意义。(1)、Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
工业上用为原料制备粗硅。①反应的化学方程式为。
②的用途是(任写一种)。
(2)、反应Ⅲ生成2 mol Si(s)时,(填“吸收”或“放出”)热量。(3)、在2L密闭容器中投入过量Si(s)和3 mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 mol·L。①反应开始到t min,用HCl浓度变化表示的平均反应速率为mol⋅L⋅min。
②为加快反应速率,可采取的措施为(任写一种)。
③下列叙述不能说明反应Ⅰ一定达到平衡状态的是(填标号)。
a. b.硅的质量保持不变
c.HCl的质量分数保持不变 d.保持不变
(4)、Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
电极X为(填“正极”、“负极”)。(5)、电池工作时,质子通过交换膜(填“从左到右”、“从右到左”)迁移(6)、正极的电极反应式为。21. 丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料。一种合成方法如下: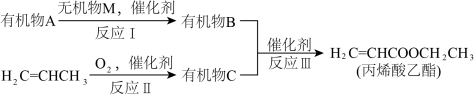
已知:有机物A是一种植物生长调节剂。
(1)、有机物A的电子式为。(2)、丙烯酸乙酯中含有的官能团名称为。(3)、有机物C的结构简式为。(4)、反应Ⅰ的化学方程式为。(5)、反应Ⅰ、Ⅱ、Ⅲ中,原子利用率为100%的是。(6)、46 g有机物B与36 g有机物C在一定条件下发生反应Ⅲ,如果实际产率是72%,则可得到丙烯酸乙酯的质量为g。(7)、某实验小组用以下装置制备丙烯酸乙酯:
①球形干燥管c除起冷凝作用外,它的另一重要作用是。
②待收集到一定量产物后停止加热,取下试管b并振荡、静置,可观察到(填实验现象)。
③分离试管b中的液体混合物,采用的方法为。
22. 已知氨气可与灼热的氧化铜反应得到氮气和金属铜,小组同学称取a g氧化铜,用下图装置(省略夹持装置)进行实验。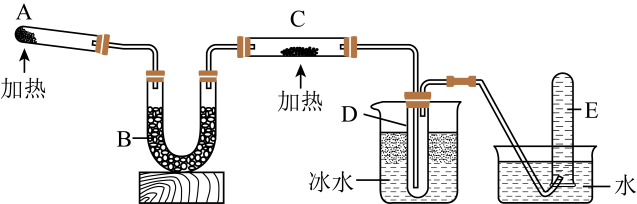 (1)、装置A中发生反应的化学方程式为。(2)、装置B中的试剂为(填标号)。
(1)、装置A中发生反应的化学方程式为。(2)、装置B中的试剂为(填标号)。①浓硫酸 ②无水氯化钙 ③碱石灰 ④五氧化二磷
(3)、装置D中收集到的物质是。(4)、装置C中观察到的现象为 , 发生反应的氧化剂和还原剂的物质的量之比为。(5)、同学查阅资料,发现氧化亚铜()也是红色固体,并提出猜想:装置C中的固体产物可能是Cu和的混合物。①氨气还原氧化铜生成氧化亚铜的化学方程式为。
②装置C中充分反应后,冷却,称量C中固体的质量为b g。当<b<(用含a的式子表示),证明C中固体是Cu和的混合物。
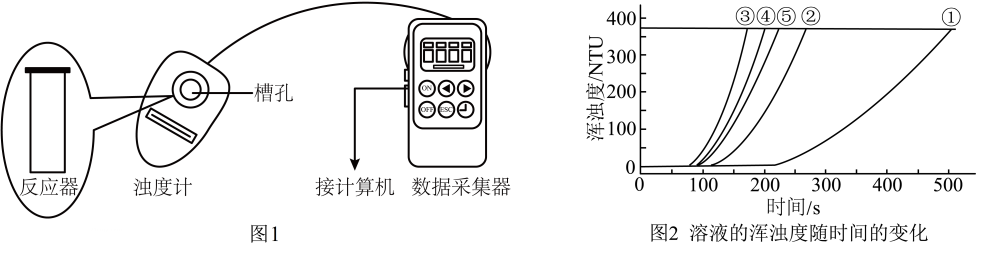
23. 利用浊度计探究一定条件下反应物浓度对硫代硫酸钠()溶液与硫酸溶液反应速率的影响。浊度计用于测量浑浊度的变化,产生的沉淀越多,浑浊度(单位为NTU)值越大。反应原理:
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到浑浊度为375NTU的过程中,浑浊度随时间变化情况。实验①~⑤所得数据如图2曲线①~⑤所示。
实验编号
溶液
溶液
蒸馏水
V/mL
V/mL
V/mL
①
0.1
1.5
0.1
V1
10
②
0.1
2.5
0.1
V2
9
③
0.1
3.5
0.1
3.5
8
④
0.1
V3
0.1
2.5
9
⑤
0.1
V4
0.1
1.5
10
(1)、。(2)、实验①③的目的是。(3)、分析数据可得以下三个结论:结论1:其它条件相同时,浓度越大,反应速率越大;
①结论2:;
②结论3:其它条件相同时,浓度改变对反应速率的影响程度大于浓度改变对反应速率的影响程度。证据是。
(4)、已知浑浊度为375NTU时,产生S的质量为g,则实验①反应开始到500s,用浓度变化表示的平均反应速率为。