宁夏青铜峡市宁朔县中2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、选择题(本大题共25个小题,每小题2分,共50分)
-
1. 化学与材料、生活和环境密切相关。下列有关说法中正确的是( )A、煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料 B、医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 C、“海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 D、新型材料聚酯纤维、光导纤维都属于有机高分子化合物2. 下列有机物的命名正确的是( )A、
 苯甲酸
B、CH2=CH-CH=CH2 1,3-二丁烯
C、
苯甲酸
B、CH2=CH-CH=CH2 1,3-二丁烯
C、 1,3-苯二酚
D、
1,3-苯二酚
D、 2-羟基丙烷
3. 下列各组混合物能用分液漏斗分离的是( )A、苯和甲苯 B、己烯和己烷 C、乙酸乙酯和水 D、丙酮和乙醇4. 关于正丁烷(CH3﹣CH2﹣CH2﹣CH3)、异丁烷(
2-羟基丙烷
3. 下列各组混合物能用分液漏斗分离的是( )A、苯和甲苯 B、己烯和己烷 C、乙酸乙酯和水 D、丙酮和乙醇4. 关于正丁烷(CH3﹣CH2﹣CH2﹣CH3)、异丁烷( )的下列说法错误的是( ) A、它们互称同分异构体 B、它们的一氯代物都各有2种 C、它们互称同系物 D、正丁烷和异丁烷化学性质相似5. 下列有关芳香烃的叙述中,不正确的是( )A、苯与浓硝酸、浓硫酸共热可反应生成硝基苯
)的下列说法错误的是( ) A、它们互称同分异构体 B、它们的一氯代物都各有2种 C、它们互称同系物 D、正丁烷和异丁烷化学性质相似5. 下列有关芳香烃的叙述中,不正确的是( )A、苯与浓硝酸、浓硫酸共热可反应生成硝基苯 B、甲苯与氯气在光照下发生一元取代反应,主要生成
B、甲苯与氯气在光照下发生一元取代反应,主要生成 C、乙苯可被酸性高锰酸钾溶液氧化为
C、乙苯可被酸性高锰酸钾溶液氧化为 (苯甲酸)
D、苯乙烯在合适条件下催化加氢可生成
(苯甲酸)
D、苯乙烯在合适条件下催化加氢可生成 6. 下列实验中,能达到相应实验目的的是( )
6. 下列实验中,能达到相应实验目的的是( )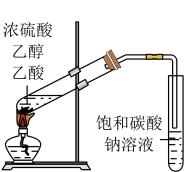



A.制备并收集乙酸乙酯
B.除去甲烷中的乙烯
C.验证溴乙烷的消去产物是乙烯
D.分离乙醇和乙酸
A、A B、B C、C D、D7. 下列分子的所有原子肯定不在同一平面内的是( )A、ClCH=CHCl B、CO2 C、CH≡CH D、CH3C≡CCH38. 某有机物的结构简式如图所示,关于该有机物,下列叙述不正确的是( ) A、一定条件下,能发生加聚反应 B、1mol该有机物与溴水发生反应,消耗Br2的物质的量为1mol C、该有机物有三种官能团 D、该有机物苯环上的一个H被Cl取代,有3种产物9. 下列物质中,核磁共振氢谱中出现三组峰的是( )
A、一定条件下,能发生加聚反应 B、1mol该有机物与溴水发生反应,消耗Br2的物质的量为1mol C、该有机物有三种官能团 D、该有机物苯环上的一个H被Cl取代,有3种产物9. 下列物质中,核磁共振氢谱中出现三组峰的是( )①
 ②
② ③
③ ④
④ A、①② B、③④ C、②③ D、①④10. 下列物质能产生银镜反应的是( )
A、①② B、③④ C、②③ D、①④10. 下列物质能产生银镜反应的是( )①蚁酸 ②乙醛 ③福尔马林 ④乙酸乙酯
A、只有①③ B、只有②③④ C、只有①②③ D、全部11. 下列化学方程式书写不正确的是( )A、苯与液溴反应: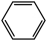 +Br2
+Br2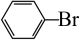 +HBr
B、实验室制备乙烯:CH3CH2OH CH2=CH2↑+H2O
C、溴乙烷与NaOH的乙醇溶液共热:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
D、向苯酚钠溶液中通入CO2:2
+HBr
B、实验室制备乙烯:CH3CH2OH CH2=CH2↑+H2O
C、溴乙烷与NaOH的乙醇溶液共热:CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
D、向苯酚钠溶液中通入CO2:2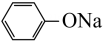 +CO2+H2O→2
+CO2+H2O→2 +Na2CO3
12. 2018年俄罗斯世界杯比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂一氯乙烷(沸点为12.27℃,进行局部冷冻麻醉应急处理。那么制取一氯乙烷的最好方法是( )A、乙烷与氯气发生取代反应 B、乙烯与氯气发生加成反应 C、乙烷与氯化氢反应 D、乙烯与氯化氢发生加成反应13. 在卤代烃RCH2CH2X中化学键如图所示,则下列说法正确的是( )
+Na2CO3
12. 2018年俄罗斯世界杯比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂一氯乙烷(沸点为12.27℃,进行局部冷冻麻醉应急处理。那么制取一氯乙烷的最好方法是( )A、乙烷与氯气发生取代反应 B、乙烯与氯气发生加成反应 C、乙烷与氯化氢反应 D、乙烯与氯化氢发生加成反应13. 在卤代烃RCH2CH2X中化学键如图所示,则下列说法正确的是( )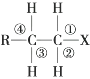 A、发生水解反应时,被破坏的键是①和③ B、发生消去反应时,被破坏的键是①和④ C、发生水解反应时,被破坏的键是① D、发生消去反应时,被破坏的键是②和③14. 如图是一些常见有机物的转化关系,以下有关反应的说法不正确的是( )
A、发生水解反应时,被破坏的键是①和③ B、发生消去反应时,被破坏的键是①和④ C、发生水解反应时,被破坏的键是① D、发生消去反应时,被破坏的键是②和③14. 如图是一些常见有机物的转化关系,以下有关反应的说法不正确的是( ) A、反应①是加成反应 B、以反应②是加聚反应 C、反应③是消去反应 D、反应⑧是氧化反应15. 关于生活中的有机物,下列说法不正确的是( )A、皮肤接触浓硝酸变黄是蛋白质的颜色反应 B、工业上利用油脂在碱性条件下的水解反应制取肥皂和甘油 C、食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质 D、纤维素、油脂、蛋白质均是天然高分子化合物16. 用分子式C7H8O所表示的某化合物含有苯环,并且和FeCl3溶液不发生显色反应,这种化合物的同分异构体有 ( )A、2种 B、3种 C、4种 D、5种17. 核糖是合成核酸的重要原料,结构简式为:CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述正确的是( )A、可以与新制氢氧化铜悬浊液反应 B、与葡萄糖互为同系物 C、可以跟氯化铁溶液显色 D、可以使紫色石蕊试液变红18. 2020年以来新冠病毒疫情在全国出现,一次性医用口罩对于全国人民至关重要,口罩的主要原料为聚丙烯树脂。下列说法错误的是( )A、聚丙烯结构简式为
A、反应①是加成反应 B、以反应②是加聚反应 C、反应③是消去反应 D、反应⑧是氧化反应15. 关于生活中的有机物,下列说法不正确的是( )A、皮肤接触浓硝酸变黄是蛋白质的颜色反应 B、工业上利用油脂在碱性条件下的水解反应制取肥皂和甘油 C、食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质 D、纤维素、油脂、蛋白质均是天然高分子化合物16. 用分子式C7H8O所表示的某化合物含有苯环,并且和FeCl3溶液不发生显色反应,这种化合物的同分异构体有 ( )A、2种 B、3种 C、4种 D、5种17. 核糖是合成核酸的重要原料,结构简式为:CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述正确的是( )A、可以与新制氢氧化铜悬浊液反应 B、与葡萄糖互为同系物 C、可以跟氯化铁溶液显色 D、可以使紫色石蕊试液变红18. 2020年以来新冠病毒疫情在全国出现,一次性医用口罩对于全国人民至关重要,口罩的主要原料为聚丙烯树脂。下列说法错误的是( )A、聚丙烯结构简式为 B、由丙烯合成聚丙烯的反应类型为加聚反应
C、聚丙烯不能使酸性高锰酸钾溶液褪色
D、聚丙烯在自然环境中容易降解
19. 下列醇中既能发生消去反应,又能被氧化为酮的是( )
B、由丙烯合成聚丙烯的反应类型为加聚反应
C、聚丙烯不能使酸性高锰酸钾溶液褪色
D、聚丙烯在自然环境中容易降解
19. 下列醇中既能发生消去反应,又能被氧化为酮的是( )①
 ②
② ③CH3OH④
③CH3OH④ ⑤
⑤ ⑥
⑥ A、①⑤ B、②③ C、②④ D、②⑥20. 下列转化中的“X溶液”可以是( )
A、①⑤ B、②③ C、②④ D、②⑥20. 下列转化中的“X溶液”可以是( ) A、NaOH B、Na2CO3 C、NaHCO3 D、Na21. 分子式为C5H12O的饱和一元醇有机物有( )A、4种 B、6种 C、8种 D、9种22. 苹果酸分子的结构简式为
A、NaOH B、Na2CO3 C、NaHCO3 D、Na21. 分子式为C5H12O的饱和一元醇有机物有( )A、4种 B、6种 C、8种 D、9种22. 苹果酸分子的结构简式为 。下列说法正确的是( ) A、1mol苹果酸与足量金属Na反应生成1mol H2 B、1mol苹果酸可与3mol NaOH发生反应 C、苹果酸分子中的官能团有羟基和羧基 D、
。下列说法正确的是( ) A、1mol苹果酸与足量金属Na反应生成1mol H2 B、1mol苹果酸可与3mol NaOH发生反应 C、苹果酸分子中的官能团有羟基和羧基 D、 与苹果酸互为同分异构体
23. 以2-溴丙烷为原料制取1,2-丙二醇,需要经过的反应是( )A、加成-消去-取代 B、消去-加成-取代 C、消去-取代-加成 D、取代-消去-加成24. 在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )A、乙烯→乙二醇:CH2=CH2
与苹果酸互为同分异构体
23. 以2-溴丙烷为原料制取1,2-丙二醇,需要经过的反应是( )A、加成-消去-取代 B、消去-加成-取代 C、消去-取代-加成 D、取代-消去-加成24. 在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )A、乙烯→乙二醇:CH2=CH2
 B、溴乙烷→乙醇:CH3CH2BrCH2=CH2CH3CH2OH
C、1-溴丁烷→1-丁炔:CH3CH2CH2CH2BrCH3CH2CH=CH2
B、溴乙烷→乙醇:CH3CH2BrCH2=CH2CH3CH2OH
C、1-溴丁烷→1-丁炔:CH3CH2CH2CH2BrCH3CH2CH=CH2 CH3CH2C≡CH
D、乙烯→乙炔:CH2=CH2
CH3CH2C≡CH
D、乙烯→乙炔:CH2=CH2 CH≡CH
25. 布洛芬具有抗炎、镇痛、解热作用,其结构简式如图所示,下列关于布洛芬的说法错误的是( )
CH≡CH
25. 布洛芬具有抗炎、镇痛、解热作用,其结构简式如图所示,下列关于布洛芬的说法错误的是( ) A、苯环上的一氯代物有2种 B、1mol布洛芬最多能消耗1molNaOH C、布洛芬可以与乙醇发生酯化反应 D、布洛芬中的所有原子可能共平面
A、苯环上的一氯代物有2种 B、1mol布洛芬最多能消耗1molNaOH C、布洛芬可以与乙醇发生酯化反应 D、布洛芬中的所有原子可能共平面二、实验题(共14分)
-
26. 某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃、回答下列问题:
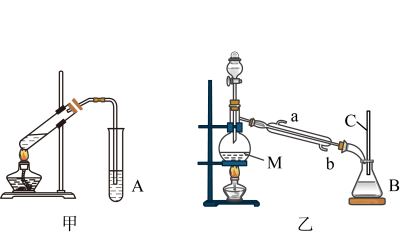 (1)、仪器M的名称为 , 仪器A、B中的溶液均为。(2)、甲、乙两套装置中效果比较好的装置是 , 原因是。(3)、乙装置中冷凝水应该从(填“a”或“b”)口进入。(4)、按甲图安装好仪器后,在反应管中加入配制的体积比为3∶2的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是。(5)、乙醇需要过量一些的原因是。(6)、某同学选用了CH3CH218OH、CH2=CH-COOH两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式:。(7)、下列有关有机知识表述正确的是____(填字母)。A、乙烯可以通过加成反应制得CH3CHCl2 B、等物质的量的甲烷和乙酸完全燃烧时所需O2的质量相同 C、乙酸乙酯中含有乙酸杂质,可加入一定量的乙醇和浓硫酸通过酯化反应除去 D、葡萄糖、麦芽糖均能与银氨溶液发生银镜反应
(1)、仪器M的名称为 , 仪器A、B中的溶液均为。(2)、甲、乙两套装置中效果比较好的装置是 , 原因是。(3)、乙装置中冷凝水应该从(填“a”或“b”)口进入。(4)、按甲图安装好仪器后,在反应管中加入配制的体积比为3∶2的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是。(5)、乙醇需要过量一些的原因是。(6)、某同学选用了CH3CH218OH、CH2=CH-COOH两个反应物,对酯化反应的原理进行探究。请写出该反应的化学方程式:。(7)、下列有关有机知识表述正确的是____(填字母)。A、乙烯可以通过加成反应制得CH3CHCl2 B、等物质的量的甲烷和乙酸完全燃烧时所需O2的质量相同 C、乙酸乙酯中含有乙酸杂质,可加入一定量的乙醇和浓硫酸通过酯化反应除去 D、葡萄糖、麦芽糖均能与银氨溶液发生银镜反应三、有机推断题(共10分)
-
27. 某化合物Ⅰ可通过如图合成路线合成:

已知:
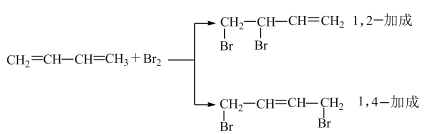
回答下列问题:
(1)、中,属于烃的是(填标号)。(2)、的反应类型属于(填“加成”或“加成”)。(3)、F在氢氧化钠的水溶液中加热,发生反应的化学方程式为。(4)、完全燃烧消耗。(5)、最多可与反应,所得产物为。(6)、中浓硫酸的作用是。四、结构与性质
-
28. 中国早在周朝已能冶炼铸铁了。目前,铁及其化合物广泛地应用到各个领域。请回答下列问题:(1)、基态铁原子的电子排布式为。(2)、我国菱铁矿FeCO3储量较为丰富,其中CO的空间结构为 , 与CO互为等电子体的一种分子的化学式为。(3)、草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如图,碳原子的杂化方式是。
 (4)、Fe(CO)5溶于汽油、苯、丙酮等有机溶剂,熔点、沸点分别在-20℃、103.6℃左右。因此可知Fe(CO)5属于晶体;从电子对给予情况来看,CO与Fe之间形成键。(5)、铁与氨气反应生成一种如图所示晶胞结构的产物,N周围最近的Fe数目是。若该晶体的密度是dg•cm-3 , 则两个最近的Fe间的距离为pm(设NA为阿伏加德罗常数的值)。
(4)、Fe(CO)5溶于汽油、苯、丙酮等有机溶剂,熔点、沸点分别在-20℃、103.6℃左右。因此可知Fe(CO)5属于晶体;从电子对给予情况来看,CO与Fe之间形成键。(5)、铁与氨气反应生成一种如图所示晶胞结构的产物,N周围最近的Fe数目是。若该晶体的密度是dg•cm-3 , 则两个最近的Fe间的距离为pm(设NA为阿伏加德罗常数的值)。 29. 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。(1)、基态碳原子的电子排布图为。(2)、铬和镍元素都易形成配位化合物:
29. 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。(1)、基态碳原子的电子排布图为。(2)、铬和镍元素都易形成配位化合物:①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是 , 在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为。
③氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 , 氨的沸点高于PH3 , 原因是。
(3)、镍元素基态原子的价电子排布式为 , 3d能级上的未成对电子数为。(4)、单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是。(5)、某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3 , 晶胞参数a=cm。
-
-