甘肃省兰州市等5地2022-2023学年高二下学期期末化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 下列化合物属于强电解质的是( )A、CH3COOH B、NH3 C、H2O D、NaOH2. 设NA为阿伏加德罗常数的数值,下列说法中正确的是( )A、46g乙醇分子中所含C-H键的数目为6NA B、将标准状况下NA个H2O的体积约为22.4L C、23gNa与足量的Cl2反应转移的电子数目为NA D、60g二氧化硅晶体中含有的Si-O键数目为2NA3. 如图所示为双液锌铜原电池。下列有关叙述正确的是( )
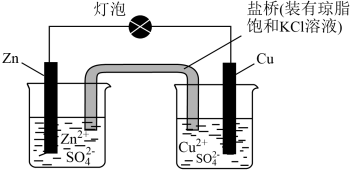 A、盐桥的作用是传导电子 B、在该电池的外电路中,电流由铜片流向锌片 C、锌片上发生还原反应:Zn-2e-=Zn2+ D、铜片做正极,电极反应是:Cu=Cu2++2e-4. 下列化学用语表示正确的是( )A、N2分子内σ键和π键个数之比为1:3 B、中子数为9的氮原子: C、邻羟基苯甲醛分子内氢键
A、盐桥的作用是传导电子 B、在该电池的外电路中,电流由铜片流向锌片 C、锌片上发生还原反应:Zn-2e-=Zn2+ D、铜片做正极,电极反应是:Cu=Cu2++2e-4. 下列化学用语表示正确的是( )A、N2分子内σ键和π键个数之比为1:3 B、中子数为9的氮原子: C、邻羟基苯甲醛分子内氢键 D、氨基苯甲酸的结构简式
D、氨基苯甲酸的结构简式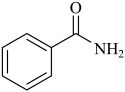 5. 下列事实与相应的物质的化学键键能大小无关的是( )A、熔点:H2O>HF B、活泼性:N2<P4 C、热稳定性:CH4>SiH4 D、硬度:金刚石>晶体硅6. 下列有关离子方程式的书写正确的是( )A、用纯铜电板电解CuCl2溶液:Cu2++2Cl-Cu+Cl2↑ B、用FeCl3溶液腐蚀铜板:2Fe3++3Cu=2Fe2++3Cu2+ C、向草酸钠溶液中加入酸性高锰酸钾溶液:2+5+16H+=2Mn2++10CO2↑+8H2O D、向H2O中投入Na2O2固体:H2O+Na2O2=2Na++2OH-+O2↑7. 短周期主族元素a、b、c、d的原子序数依次增大,a为第二周期且原子核外p能级上的电子总数与s能级上的电子总数相等,b为第三周期且原子核外没有未成对电子,c的单质晶体是芯片的主要材料,d与a位于同一主族。下列说法正确的是( )A、简单离子半径a的比b的小 B、b的第一电离能大于同周期相邻的两种元素 C、c的常见氧化物是一种离子晶体 D、d的简单氢化物的空间结构为直线形8. 青霉胺可以用于医学上误食铜盐的解毒,解毒原理:Cu2+形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是( )
5. 下列事实与相应的物质的化学键键能大小无关的是( )A、熔点:H2O>HF B、活泼性:N2<P4 C、热稳定性:CH4>SiH4 D、硬度:金刚石>晶体硅6. 下列有关离子方程式的书写正确的是( )A、用纯铜电板电解CuCl2溶液:Cu2++2Cl-Cu+Cl2↑ B、用FeCl3溶液腐蚀铜板:2Fe3++3Cu=2Fe2++3Cu2+ C、向草酸钠溶液中加入酸性高锰酸钾溶液:2+5+16H+=2Mn2++10CO2↑+8H2O D、向H2O中投入Na2O2固体:H2O+Na2O2=2Na++2OH-+O2↑7. 短周期主族元素a、b、c、d的原子序数依次增大,a为第二周期且原子核外p能级上的电子总数与s能级上的电子总数相等,b为第三周期且原子核外没有未成对电子,c的单质晶体是芯片的主要材料,d与a位于同一主族。下列说法正确的是( )A、简单离子半径a的比b的小 B、b的第一电离能大于同周期相邻的两种元素 C、c的常见氧化物是一种离子晶体 D、d的简单氢化物的空间结构为直线形8. 青霉胺可以用于医学上误食铜盐的解毒,解毒原理:Cu2+形成环状配合物,其结构如图所示。该配合物无毒、易溶于水,可经尿液排出。下列说法错误的是( )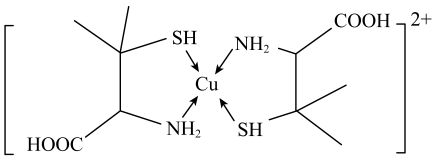 A、共价键键角的大小关系为H2O<NH3 B、电负性大小关系为O>N>H>Cu C、该配合物易溶于水的主要原因是其与水可形成分子间氢键 D、与铜离子形成配位键强弱的大小关系为H2S>NH39. 病毒核酸采样管中的红色液体是一种样本保护液,其中含有胍盐,作用于病毒核酸保存。已知胍是有机一元碱,碱性与氢氧化钠相近;胍盐易水解为氨和尿素。以下说法错误的是( )A、核酸和蛋白质都是生物大分子 B、核酸水解最终产物中含有磷酸、六碳糖和碱基 C、胍保存不当时易吸收空气中的CO2而变质 D、合理使用尿素可以促进农作物的生长,提高粮食产量10. 下列反应属于氧化还原反应且能量变化符合图像的是( )
A、共价键键角的大小关系为H2O<NH3 B、电负性大小关系为O>N>H>Cu C、该配合物易溶于水的主要原因是其与水可形成分子间氢键 D、与铜离子形成配位键强弱的大小关系为H2S>NH39. 病毒核酸采样管中的红色液体是一种样本保护液,其中含有胍盐,作用于病毒核酸保存。已知胍是有机一元碱,碱性与氢氧化钠相近;胍盐易水解为氨和尿素。以下说法错误的是( )A、核酸和蛋白质都是生物大分子 B、核酸水解最终产物中含有磷酸、六碳糖和碱基 C、胍保存不当时易吸收空气中的CO2而变质 D、合理使用尿素可以促进农作物的生长,提高粮食产量10. 下列反应属于氧化还原反应且能量变化符合图像的是( )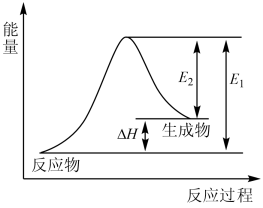 A、C(s)+CO2(g) = 2CO(g) B、CH4(g)+2O2(g) = CO2(g)+2H2O(l) C、NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) D、Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)11. 常压下利用可逆反应Ni(s)+4CO(g)⇌Ni(CO)4(g)精炼镍。已知230℃时,该反应的平衡常数K=2×10-5(L/mol)3 , Ni(CO)4的沸点为42.2℃,粗镍中固体杂质不参与反应。下列说法错误的是( )A、恒容体系下,增加c[Ni(CO)4],体系压强增大,平衡常数增大 B、50℃时将粗镍与CO反应,可以获得相应的气态产物便于与粗镍杂质分离 C、测量某温度下反应体系中Ni(CO)4体积分数不变时,反应达到平衡 D、230℃,Ni(CO)4平衡分解率较高12. 为实现碳中和,可通过电解法用制备 , 电解装置如图,下列说法不正确的是( )
A、C(s)+CO2(g) = 2CO(g) B、CH4(g)+2O2(g) = CO2(g)+2H2O(l) C、NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) D、Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)11. 常压下利用可逆反应Ni(s)+4CO(g)⇌Ni(CO)4(g)精炼镍。已知230℃时,该反应的平衡常数K=2×10-5(L/mol)3 , Ni(CO)4的沸点为42.2℃,粗镍中固体杂质不参与反应。下列说法错误的是( )A、恒容体系下,增加c[Ni(CO)4],体系压强增大,平衡常数增大 B、50℃时将粗镍与CO反应,可以获得相应的气态产物便于与粗镍杂质分离 C、测量某温度下反应体系中Ni(CO)4体积分数不变时,反应达到平衡 D、230℃,Ni(CO)4平衡分解率较高12. 为实现碳中和,可通过电解法用制备 , 电解装置如图,下列说法不正确的是( )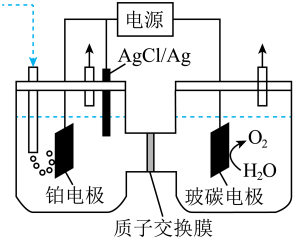 A、玻碳电极为阳极,发生氧化反应 B、铂电极的电极反应: C、制得28g时,产生32g D、电解一段时间后,右池中溶液的pH可能不变13. 某著名运动员使用了可能有兴奋作用违禁药物事件闹得沸沸扬扬。该药物的结构简式如下图所示,有关该物质的说法正确的是( )
A、玻碳电极为阳极,发生氧化反应 B、铂电极的电极反应: C、制得28g时,产生32g D、电解一段时间后,右池中溶液的pH可能不变13. 某著名运动员使用了可能有兴奋作用违禁药物事件闹得沸沸扬扬。该药物的结构简式如下图所示,有关该物质的说法正确的是( )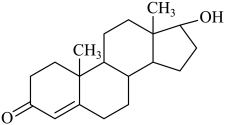 A、该有机物的分子式为C19H26O2 B、该物质所有的碳原子一定在同一个平面上 C、1mol该化合物最多可与2molH2发生反应 D、该化合物有两种官能团14. 食品添加剂柠檬酸三钠,使用时必须符合国家标准。用标准的盐酸和电导率仪测得滴加盐酸体积与待测溶液(10mL)电导率的关系如图所示,溶液的浓度均为0.01mol/L。已知:柠檬酸(
A、该有机物的分子式为C19H26O2 B、该物质所有的碳原子一定在同一个平面上 C、1mol该化合物最多可与2molH2发生反应 D、该化合物有两种官能团14. 食品添加剂柠檬酸三钠,使用时必须符合国家标准。用标准的盐酸和电导率仪测得滴加盐酸体积与待测溶液(10mL)电导率的关系如图所示,溶液的浓度均为0.01mol/L。已知:柠檬酸(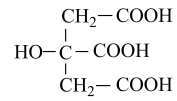 分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )
分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )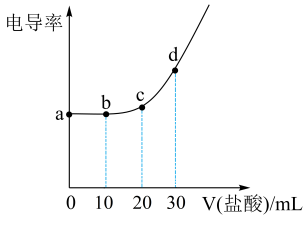 A、a点代表正盐溶液,c(H+)的数量级为10-10 B、b点溶液显酸性 C、c点溶液满足:c(Cl-)>2[c()+c()+c()] D、电导率与离子浓度有关,与离子所带电荷无关
A、a点代表正盐溶液,c(H+)的数量级为10-10 B、b点溶液显酸性 C、c点溶液满足:c(Cl-)>2[c()+c()+c()] D、电导率与离子浓度有关,与离子所带电荷无关二、工业流程题
-
15. 实验室变色硅胶是在硅酸凝胶中添加了CoCl2。一种从水钴矿(主要成分:Co2O3 , 少量的Fe2O3、CaO、MgO、Al2O3、MnO))制取CoCl2·6H2O工艺流程如下:
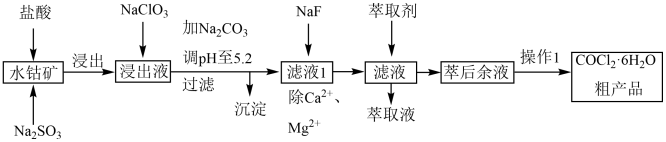
已知:阳离子的氢氧化物沉淀时溶液的pH如下表:
沉淀物
Fe(OH)3
Al(OH)3
Co(OH)2
Fe(OH)2
Mn(OH)2
开始沉淀
2.7
4.0
7.6
7.6
7.7
完全沉淀
3.7
5.2
9.2
9.6
9.8
(1)、水钴矿在浸取前需要粉碎,目的是。(2)、Na2SO3在浸取过程中作剂,写出浸取时Na2SO3与Fe2O3反应的离子方程式。(3)、写出NaClO3加入浸取后溶液的离子方程式。(4)、加入碳酸钠调节pH为5.2步骤获得沉淀的成分为。(5)、“萃取”时发生反应:Co2++n(HA)2⇌CoA2·(n-1)(HA)2+2H+ , 通过调节pH,设计萃取、反萃取。简述该步骤的原理和目的。(6)、CoCl2为蓝色,CoC2·6H2O为粉红色。实验室变色硅胶是在硅酸凝胶中添加CoCl2用于指示吸湿程度。请说明CoCl2用于指示吸湿程度的原理。三、填空题
-
16. 勒夏特列通过深入研究高炉炼铁后发现了该过程的主要反应为可逆反应。某科研小组进行类似的研究,以Fe3O4为原料炼铁,主要发生如下反应:
反应I:Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g) △H1=Q1(Q1>0)
反应II:Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g) △H2=Q2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO的体积分数随温度的变化关系如图所示。
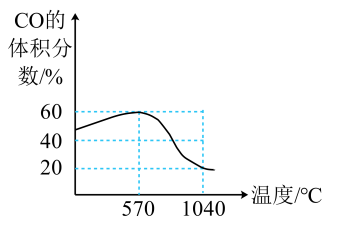
回答下列问题:
(1)、判断Q2的正、负值,并说明理由。(2)、温度升高,反应器中CO体积分数降低,分析可能的原因为。(3)、1040℃时,反应一段时间后,体系内2个反应均达成平衡,试计算各自的平衡常数Kp。(4)、炉温不变,扩大炼铁反应器的容积,通过分析说明等量的还原剂能否提升铁矿石的平衡转化率 , 能否提升平衡前铁矿石的单位时间转化率。(5)、将Fe2O3、铁粉和NaOH溶液置于反应器中,在温度大于100℃下搅拌反应半小时以上,反应产物经过一次过滤、水洗、二次过滤、干燥、研磨,可直接得到黑色的Fe3O4细末。试写出该过程的总反应方程式。四、结构与性质
-
17. 2020年12月17日,我国“嫦娥五号”返回器携月壤成功着陆。根据已经发表的研究成果可知,月壤中存在天然的铁、金、银、铅、锌、铜、锑、铼等矿物颗粒。(1)、写出铜的基态原子的电子排布式。(2)、Fe在周期表中位于第周期第族,属于区。(3)、基态Fe原子有个未成对电子,Fe3+的电子排布式为。(4)、基态Al3+核外共有种不同运动状态的电子。(5)、采取的月壤中未发现钒(V)元素,其价层电子的轨道表示式为。钒(V)的某种氧化物的晶胞结构如图(1)所示。该晶体的化学式为。
 (6)、金晶体的晶胞结构如图(2)所示。设金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量,金的密度为g/cm3(用d、M、NA表示)。
(6)、金晶体的晶胞结构如图(2)所示。设金原子的直径为dcm,用NA表示阿伏加德罗常数,M表示金的摩尔质量,金的密度为g/cm3(用d、M、NA表示)。五、有机推断题
-
18. 某α,β-不饱和烯醛是一种药物中间体,其合成路线如下:
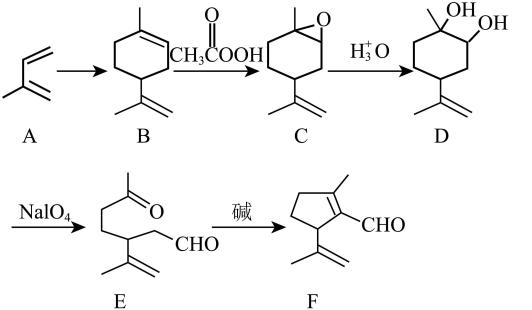 (1)、F中含氧官能团名称为 , 检验该官能团可用的化学试剂为。(2)、B→C的反应类型为。(3)、A化学名称为 , NaIO4中的空间结构为。(4)、每个D分子中手性碳原子的数目为。(5)、F的一种同分异构体同时满足下列条件,写出该同分异构体的一种结构简式。
(1)、F中含氧官能团名称为 , 检验该官能团可用的化学试剂为。(2)、B→C的反应类型为。(3)、A化学名称为 , NaIO4中的空间结构为。(4)、每个D分子中手性碳原子的数目为。(5)、F的一种同分异构体同时满足下列条件,写出该同分异构体的一种结构简式。①分子中含有苯环,能与FeCl3溶液发生显色反应;
②分子中只有5种不同化学环境的氢。
(6)、结合题中信息写出 在NaIO4作用下所得产物的结构简式。
在NaIO4作用下所得产物的结构简式。
-
-
-