贵州省六盘水市2022-2023学年高二下学期期末教学质量监测化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 化学与生活密切相关,下列说法不合理的是( )A、蔗糖分子结构被修饰后得到的三氯蔗糖可供糖尿病患者使用 B、硫酸铵、硫酸铜、氢氧化钠和乙醇均能使蛋白质变性 C、甲醛的水溶液可用于消毒和制作生物标本 D、石墨晶体中存在范德华力,常用作润滑剂2. 下列有关化学用语的表述不正确的是( )A、乙烷的空间填充模型:
 B、的结构式:
C、乙醇的分子式:
D、分子间的氢键:
3. 下列操作能达到实验目的的是( )
B、的结构式:
C、乙醇的分子式:
D、分子间的氢键:
3. 下列操作能达到实验目的的是( )A
B
C
D


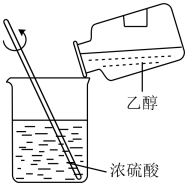

用酒精萃取碘水中的碘
蒸馏实验中将蒸气冷凝为液体
混合浓硫酸和乙醇
证明乙炔可使酸性高锰酸钾溶液褪色
A、A B、B C、C D、D4. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、分子中含有键数目为 B、标准状况下,己烷所含C原子数目为 C、苯乙烯( )中含有碳碳双键数为
D、的配位键数目为
5. 下列叙述正确的是( )A、氧原子电子的电子云轮廓图:
)中含有碳碳双键数为
D、的配位键数目为
5. 下列叙述正确的是( )A、氧原子电子的电子云轮廓图: B、表示3p能级有4个轨道
C、基态N原子电子排布的轨道表示式:
B、表示3p能级有4个轨道
C、基态N原子电子排布的轨道表示式: D、金属产生焰色的原因是金属原子发生电子跃迁
6. 下列反应的离子方程式不正确的是( )A、向苯酚钠溶液中通入少量:2
D、金属产生焰色的原因是金属原子发生电子跃迁
6. 下列反应的离子方程式不正确的是( )A、向苯酚钠溶液中通入少量:2 + CO2+H2O2
+ CO2+H2O2 +CO32-
B、乙醛与新制氢氧化铜悬浊液混合后加热:
C、向盛有硫酸铜溶液的试管里加入过量氨水,得到深蓝色溶液:
D、乙酸乙酯与溶液混合后加热:
7. 下列有机物命名正确的是( )
+CO32-
B、乙醛与新制氢氧化铜悬浊液混合后加热:
C、向盛有硫酸铜溶液的试管里加入过量氨水,得到深蓝色溶液:
D、乙酸乙酯与溶液混合后加热:
7. 下列有机物命名正确的是( )
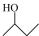
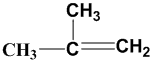
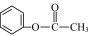
A.2-乙基丙烷
B.3-丁醇
C.2-甲基丙烯
D.苯甲酸甲酯
A、A B、B C、C D、D8. 下列说法正确的是( )A、三氯乙酸的酸性小于二氯乙酸的,是因为的极性小于的极性 B、易溶于溶液,可用“相似相溶”规律解释 C、冰浮在水面,是由于水分子之间形成氢键使冰晶体中水分子间的空隙增大 D、键长 , 因此稳定性9. 乙酰水杨酸(又称阿司匹林)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,其结构如图所示。下列说法错误的是( ) A、该物质含有两种官能团 B、能发生氧化、取代、加成、消去反应 C、分子中最少有7个碳原子共平面 D、该有机化合物最多与氢氧化钠发生反应10. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素组成的无机盐溶于盐酸有无色无味的气体生成,离子与具有相同的核外电子数,下列叙述正确的是( )A、分子的空间结构为三角锥形 B、原子半径: C、X单质只有4种同素异形体 D、W、Y、Z三种元素形成的化合物都是酸11. 下列实验操作及现象、结论表述不合理的是( )
A、该物质含有两种官能团 B、能发生氧化、取代、加成、消去反应 C、分子中最少有7个碳原子共平面 D、该有机化合物最多与氢氧化钠发生反应10. W、X、Y、Z为原子序数依次增大的短周期元素,四种元素组成的无机盐溶于盐酸有无色无味的气体生成,离子与具有相同的核外电子数,下列叙述正确的是( )A、分子的空间结构为三角锥形 B、原子半径: C、X单质只有4种同素异形体 D、W、Y、Z三种元素形成的化合物都是酸11. 下列实验操作及现象、结论表述不合理的是( )选项
实验操作及现象
结论
A
向和无水乙醇的混合溶液中加入1-溴丁烷和几片碎瓷片并微热,将产生的气体通入酸性溶液,溶液褪色
1-溴丁烷发生消去反应生成了烯烃
B
向鸡蛋清溶液中滴入浓硝酸,产生白色沉淀,加热后沉淀变黄色
鸡蛋清蛋白质中含有苯环
C
向酸性溶液中通入乙烯至过量,溶液紫红色褪去
酸性溶液能氧化乙烯
D
向溴水中加入苯,振荡后静置,水层颜色变浅
苯能将溴从水中萃取出来
A、A B、B C、C D、D12. 仅用一种试剂即可将酒精、苯酚溶液、己烯、甲苯4种无色液体区分开来,这种试剂是( )A、FeCl3溶液 B、KMnO4溶液 C、溴水 D、金属钠13. 分子式为C6H12O且能发生银镜反应的有机化合物有(不考虑立体异构)( )A、5种 B、6种 C、7种 D、8种14. 下列有关晶体结构和性质的判断错误的是( )A
B
C
D




金刚石晶体中,每个碳原子被12个六元环共用
晶体中,每个晶胞平均含有4个
干冰熔化或升华时,分子内的共价键被破坏
晶体中,距最近且等距的有6个
A、A B、B C、C D、D15. 材料在国民经济发展中发挥着重要作用,下列有关说法不正确的是( )A
防弹衣的主要材料:

聚合物分子内含有酰胺基
B
隐形飞机的微波吸收材料:
单体能使溴水褪色
C
隐形眼镜的材料:

该物质具有良好的亲水性,可经加聚反应制备
D
尼龙66:

由己胺和己酸经缩聚反应制备
A、A B、B C、C D、D16. 已知:Diels-Alder反应 ,则
,则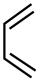 与
与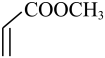 反应得到的产物是( ) A、
反应得到的产物是( ) A、 B、
B、 C、
C、 D、
D、
二、元素或物质推断题
-
17. A、B、C、D、E是原子序数依次增大的前四周期元素,其相关信息如下:
元素
相关信息
A
基态原子轨道上只有1个电子
B
基态原子核外s能级上的电子总数与p能级上的电子总数相等
C
短周期主族元素中原子半径最大
D
单质为良好的半导体材料
E
基态有5个未成对电子
请回答下列问题:
(1)、E的元素符号 , E基态原子的电子排布式。(2)、和半径较大的是(填元素离子符号)。(3)、C的基态原子含有种空间运动状态不同的电子,A与C形成的二元化合物的晶体类型为。(4)、D的氧化物熔点高于干冰的原因是;写出C的最高价氧化物的水化物与D的最高价氧化物反应的离子方程式。三、实验题
-
18. 2-呋喃甲酸乙酯(
 )常用于合成香料,是一种透明液体,不溶于水。实验室可用2-呋喃甲酸(
)常用于合成香料,是一种透明液体,不溶于水。实验室可用2-呋喃甲酸( )和乙醇在浓硫酸催化下反应制得2-呋喃甲酸乙酯,反应原理及部分制备装置如下:
)和乙醇在浓硫酸催化下反应制得2-呋喃甲酸乙酯,反应原理及部分制备装置如下:

Ⅰ.制备
步骤1:按图1装置,在三颈瓶中加入苯、浓硫酸、(约)无水乙醇,用仪器B加入2-呋喃甲酸,控制反应液温度保持在68℃,回流。
Ⅱ.提纯
步骤2:将反应后的混合物倒入水中,加入无水固体(20℃时,水中最多能溶解无水固体),搅拌、静置、过滤,向滤液中加入活性炭(用于吸附反应后混合物中的固体小颗粒),再次搅拌、静置、过滤。
步骤3:将滤液静置,待分层后分离水相和有机相,并用苯对水层少量多次萃取,合并有机相(仍残留少量水),再利用图2装置进行蒸馏,保留少量浓缩液,待浓缩液冷却后,在乙醇中重结晶,得无色针状晶体。
几种物质的沸点和相对分子质量如表:
物质
2-呋喃甲酸乙酯
2-呋喃甲酸
乙醇
苯和水恒沸物
沸点/℃
196
230
78
69
相对分子质量
140
112
46
-
回答下列问题:
(1)、仪器A的名称是。(2)、步骤1装置的加热方式是 , 其优点是。(3)、步骤2中的作用是。(4)、步骤3中用苯多次萃取的目的是;锥形瓶中收集的主要物质是。(5)、本实验中2-呋喃甲酸乙酯的产率为(精确到小数点后一位)。四、有机推断题
-
19. 龙葵醛W是一种珍贵的香料,在自然界中未发现其存在,属于合成香料,可按下列路线合成。

已知:

回答下列问题:
(1)、化合物A的结构简式为;F中含有的官能团名称为。(2)、B→C反应的试剂和条件为。(3)、D→E的反应类型是。(4)、写出G→W反应的化学方程式。(5)、G有多种同分异构体,写出满足下列条件的有机物G的同分异构体的结构简式。①其水溶液遇溶液显紫色。
②核磁共振氢谱为四组峰,峰面积比为1∶2∶3∶6。
(6)、参照上述合成路线和信息,以乙醇为基本原料(无机试剂任选)设计制备正丁醇()的合成路线:。五、结构与性质
-
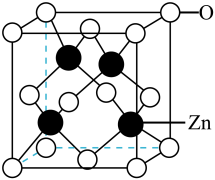
20. 葡萄糖酸锌用于治疗缺锌引起的营养不良、厌食症、儿童生长发育迟缓等,可用葡萄糖酸钙和硫酸锌反应制得。(1)、位于周期表的(填“s”“p”“d”“f”或“ds”)区;元素氮和氧在周期表中相邻,第一电离能NO(填“>”或者“<”)。(2)、葡萄糖酸分子中所含元素的电负性由大到小的顺序为(填元素符号),该分子中碳原子杂化类型为。(3)、中的空间结构为(用文字描述)。(4)、晶体中部分O原子被N原子替代后可以改善半导体性能,键与键相比,键离子键成分的百分数较大,原因是。(5)、的立方晶胞如图所示,原子填充于O原子形成的(填多面体名称)空隙中,若晶胞的密度为阿伏加德罗常数的值用表示,则晶胞的棱长为(用代数式表示)。
-
-
-