北京朝阳区2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 下列对于生产、生活中现象和事实的分析不合理的是( )
 节日燃放的焰火绚丽多彩
节日燃放的焰火绚丽多彩 宇宙飞船返回舱外壳用网状结构的酚醛树脂制造
宇宙飞船返回舱外壳用网状结构的酚醛树脂制造 利用紫外线为图书消毒
利用紫外线为图书消毒 植物油氢化所得硬化油不易被空气氧化
植物油氢化所得硬化油不易被空气氧化A.与原子核外电子跃迁有关
B.与网状结构高分子的热固性有关
C.与紫外线可以使蛋白质变性有关
D.与植物油中含有酯基有关
A、A B、B C、C D、D2. 下列化学用语或图示表达不正确的是( )A、甲酸的结构式: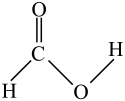 B、乙烯的电子式:
B、乙烯的电子式: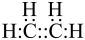 C、乙醇的分子结构模型:
C、乙醇的分子结构模型: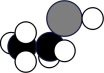 D、基态Cr原子的价层电子排布式:
3. 干冰()的晶胞结构如下图所示。下列说法不正确的是( )
D、基态Cr原子的价层电子排布式:
3. 干冰()的晶胞结构如下图所示。下列说法不正确的是( )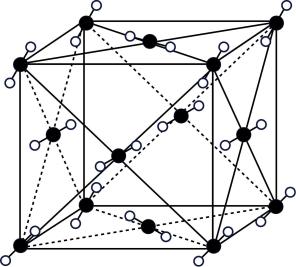 A、干冰晶体属于分子晶体 B、干冰晶胞中,含有4个分子 C、干冰晶体中,每个周围等距且紧邻的有6个 D、干冰晶体中分子间作用力较小,常压下易升华4. 青蒿琥酯是一种高效抗疟药,实验证明其分子中含有能与碘化钠作用生成碘单质的基团。下列关于青蒿琥酯的说法不正确的是( )
A、干冰晶体属于分子晶体 B、干冰晶胞中,含有4个分子 C、干冰晶体中,每个周围等距且紧邻的有6个 D、干冰晶体中分子间作用力较小,常压下易升华4. 青蒿琥酯是一种高效抗疟药,实验证明其分子中含有能与碘化钠作用生成碘单质的基团。下列关于青蒿琥酯的说法不正确的是( )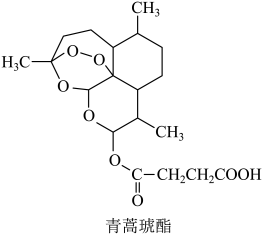 A、青蒿琥酯对热不稳定 B、分子中含有3种含氧官能团 C、难溶于水,易溶于乙酸乙酯 D、酸性条件下水解可得到丁二酸5. 下列对于物质结构和性质的分析不正确的是( )A、碳的原子半径小于硅,使金刚石熔点高于晶体硅 B、邻羟基苯甲醛形成了分子内氢键,其沸点高于对羟基苯甲醛 C、氟的电负性大于氯,导致三氟乙酸的酸性强于三氯乙酸 D、卤代烃中键极性较强,使卤素原子易被取代6. 下列构建碳骨架的反应,不属于加成反应的是( )A、
A、青蒿琥酯对热不稳定 B、分子中含有3种含氧官能团 C、难溶于水,易溶于乙酸乙酯 D、酸性条件下水解可得到丁二酸5. 下列对于物质结构和性质的分析不正确的是( )A、碳的原子半径小于硅,使金刚石熔点高于晶体硅 B、邻羟基苯甲醛形成了分子内氢键,其沸点高于对羟基苯甲醛 C、氟的电负性大于氯,导致三氟乙酸的酸性强于三氯乙酸 D、卤代烃中键极性较强,使卤素原子易被取代6. 下列构建碳骨架的反应,不属于加成反应的是( )A、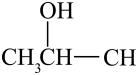 B、
B、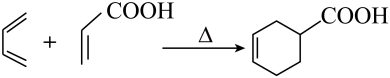 C、
C、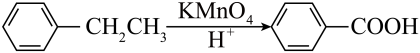 D、
D、 7. 下列对实验事实的解释不正确的是( )
7. 下列对实验事实的解释不正确的是( )实验事实
解释
A
甲苯能使酸性溶液褪色但苯不能
甲基使苯环活化
B
甲苯生成邻硝基甲苯比苯生成硝基苯所需温度低
甲基使苯环上的部分H活化
C
苯酚能和浓溴水反应产生白色沉淀但苯不能
羟基使苯环上的部分H活化
D
常温下与NaOH反应的程度苯酚大于环己醇
苯环使羟基的键极性增强
A、A B、B C、C D、D8. 硫酸盐(含、)气溶胶是的成分之一、科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下: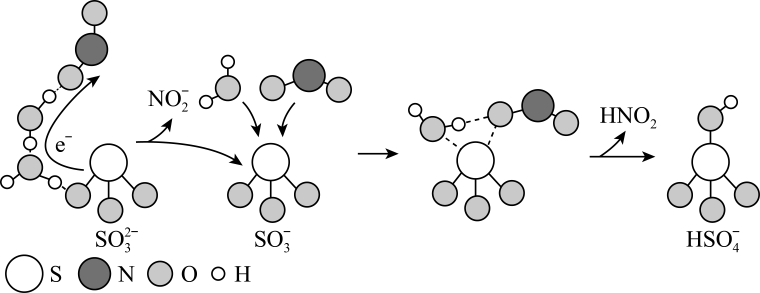
下列说法不正确的是( )
A、中的O为杂化 B、的VSEPR模型为平面三角形 C、是由极性键形成的极性分子 D、反应过程中涉及氧氢键断裂和硫氧键形成9. 下列说法不正确的是( )A、纤维素分子中含有羟基、可与乙酸发生酯化反应生成醋酸纤维 B、氨基酸分子中含有氨基和羧基,多个氨基酸分子可通过肽键生成多肽 C、油酸分子中含有碳碳双键,因此含有油酸甘油酯的植物油可使溴水褪色 D、核苷与磷酸通过醚键结合形成核苷酸,如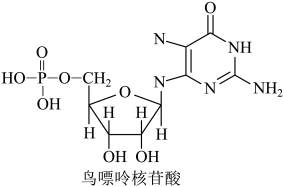 10. 桂皮中的肉桂醛(
10. 桂皮中的肉桂醛(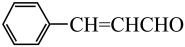 )是一种食用香料,一种合成路线如下:
)是一种食用香料,一种合成路线如下: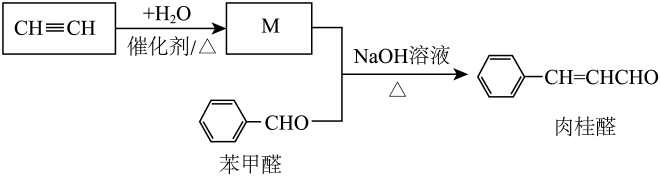
下列说法不正确的是( )
A、实验室制取的反应为: B、M能发生银镜反应: C、苯甲醛与肉桂醛互为同系物 D、肉桂醛分子中含有碳碳双键,存在顺反异构体11. 利用下列实验药品,不能达到实验目的的是( )实验目的
实验药品
A
验证乙醇的消去产物含有乙烯
乙醇、浓硫酸、酸性溶液
B
验证乙酸的酸性强于碳酸的酸性
溶液、固体、饱和溶液、澄清石灰水
C
验证蛋白质的盐析是可逆过程
鸡蛋清溶液、饱和溶液、蒸馏水
D
比较水和四氯化碳分子的极性
碘晶体、、
A、A B、B C、C D、D12. 阿司匹林片的有效成分为乙酰水杨酸(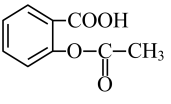 )。为检验其官能团,某小组同学进行如下实验:
)。为检验其官能团,某小组同学进行如下实验:①将阿司匹林片研碎,加水溶解,过滤,弃去滤渣;
②取少量滤液,滴加2滴溶液,无明显现象;
③另取少量滤液,加足量NaOH溶液,加热;
④冷却③溶液后,滴加2滴溶液,产生红褐色沉淀,静置后上层溶液几乎无色;
⑤向④的悬浊液中加入适量稀硫酸,溶液呈紫色。
下列说法正确的是( )
A、③中加热时发生的反应为
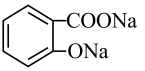 B、对比④⑤中现象说明乙酰水杨酸在碱性溶液中不能水解但在酸性溶液中可以水解
C、若③步骤中只滴加少量NaOH溶液,则④步骤可能观察到溶液呈紫色
D、该实验已检验出乙酰水杨酸分子中的全部官能团
13. 中国自行研制、具有自主知识产权的C919大型客机机舱内部首次使用芳砜纶纤维制作椅罩、门帘。芳砜纶纤维是有机耐高温纤维,由三种单体
B、对比④⑤中现象说明乙酰水杨酸在碱性溶液中不能水解但在酸性溶液中可以水解
C、若③步骤中只滴加少量NaOH溶液,则④步骤可能观察到溶液呈紫色
D、该实验已检验出乙酰水杨酸分子中的全部官能团
13. 中国自行研制、具有自主知识产权的C919大型客机机舱内部首次使用芳砜纶纤维制作椅罩、门帘。芳砜纶纤维是有机耐高温纤维,由三种单体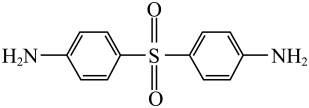 、
、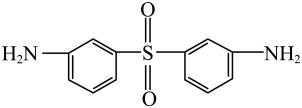 、
、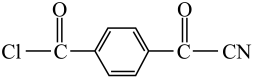 缩合共聚制成。芳砜纶纤维结构简式如图所示:
缩合共聚制成。芳砜纶纤维结构简式如图所示: 。下列说法不正确的是( ) A、芳砜纶纤维中不含手性碳原子 B、
。下列说法不正确的是( ) A、芳砜纶纤维中不含手性碳原子 B、 的名称为4,4'-DDS,推测
的名称为4,4'-DDS,推测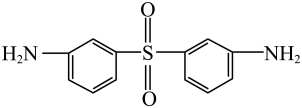 的名称为3,3'-DDS
C、参加反应的三种单体的物质的量之比为3:1:8
D、及时移除HCl,有利于提高产率并得到具有较高聚合度的缩聚物
14. 化学小组研究的性质,完成如下实验:
的名称为3,3'-DDS
C、参加反应的三种单体的物质的量之比为3:1:8
D、及时移除HCl,有利于提高产率并得到具有较高聚合度的缩聚物
14. 化学小组研究的性质,完成如下实验: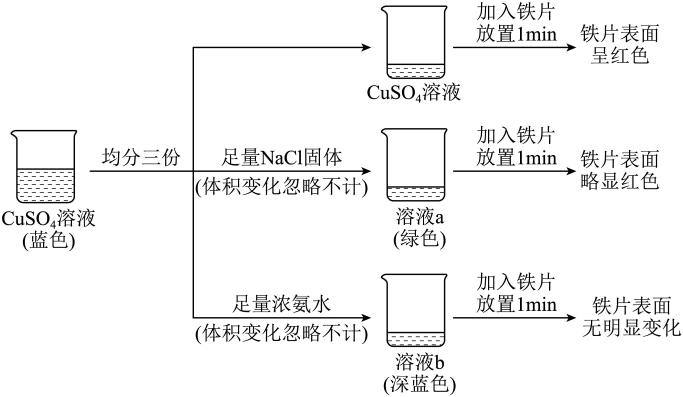
已知:;;
下列说法不正确的是( )
A、溶液中加入NaCl固体: B、溶液a中加入浓氨水时不可能出现蓝色沉淀 C、溶液a、b中铁片的颜色不同证明 D、溶液b中加入足量乙醇时可以析出深蓝色晶体二、原理综合题
-
15. 氨硼烷()是一种具有研究价值的固体储氢材料。
已知:含氢19.5%,白色晶体,熔点为104℃。可溶于水和甲醇等溶剂中。常温常压下能够稳定存在。在催化剂存在的情况下,能够快速与水反应。
元素
H
B
N
电负性
2.1
2.0
3.0
(1)、基态N原子的核外电子排布的轨道表示式为。(2)、B的第一电离能低于Be,可能的原因是。(3)、分子结构示意图如图1,其中为键(填序号,下同),为键。
a.配位键 b.非极性键 c.键 d.键
(4)、在某种催化剂表面与反应的释氢机理如图2。
①若用和做反应物,生成的氢气是(填序号)。
a. b. c.HD
②写出理论上与完全反应的总反应的离子方程式:。
(5)、研究发现,在低温高压条件下为正交晶系结构。的2×2×2超晶胞结构如图3所示(超晶胞内含有16个氨硼烷分子,)。氨硼烷晶体的密度为(已知:;表示阿伏加德罗常数)。
三、填空题
-
16. 有机物中的(键较难断裂,活化键是有机反应研究的热点之一、由
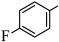 经两步反应合成
经两步反应合成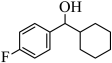 , 均需使键活化,步骤如下
, 均需使键活化,步骤如下 (1)、铬、铁位于元素周期表中的(填序号)。
(1)、铬、铁位于元素周期表中的(填序号)。a.s区 b.d区 c.p区 d.ds区
(2)、 转化为
转化为 的过程中,键中的(填“”或“”)键断裂,发生加成反应,转化为键。 (3)、利用有机金属框架(MOF)构筑双铁催化剂,制备过程的核心结构变化如下。
的过程中,键中的(填“”或“”)键断裂,发生加成反应,转化为键。 (3)、利用有机金属框架(MOF)构筑双铁催化剂,制备过程的核心结构变化如下。注:代表+2价铁,代表+3价铁。

①
 与的相对分子质量相差较大,但二者的沸点却极为接近(相差1℃左右),原因有:
与的相对分子质量相差较大,但二者的沸点却极为接近(相差1℃左右),原因有:ⅰ.的极性强于
 ;
;ⅱ.。
②易被氧化为 , 结合价层电子排布解释原因:。
(4)、铜铬催化剂的主要成分是CuCl、和(甲基硼酸)等,能有效抑制副产物的生成。①中B的杂化轨道类型是。
②已知:和均为一元弱酸。推测 (填“>”或“<”)
四、有机推断题
-
17. 不同空腔尺寸的瓜环可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附。瓜环[7]的一种合成路线如下。
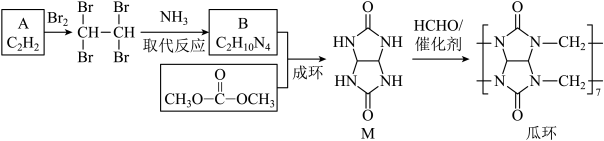 (1)、A的名称是。(2)、1,1,2,2-四溴乙烷与反应生成B的化学方程式是。此反应过程需要加入远远过量的 , 目的有:
(1)、A的名称是。(2)、1,1,2,2-四溴乙烷与反应生成B的化学方程式是。此反应过程需要加入远远过量的 , 目的有:①减少副反应,提高生成物纯度。
②。
(3)、推测“成环”反应中生成M和。(4)、瓜环[7]的分子结构模型如下图所示。
①下列关于瓜环[7]的说法正确的是(填序号)。
a.含有的官能团是酰胺基
b.含有2种不同化学环境的氢原子
c.分子间存在范德华力和氢键
d.空腔尺寸以及具有负电性的氧原子端口使其具有对特定分子的识别能力
②M与HCHO生成瓜环[7]的化学方程式是。
(5)、提出一种测定瓜环[n]中n值的方案:。18. 某治疗胃溃疡的药物中间体N,可通过如下合成路线制得。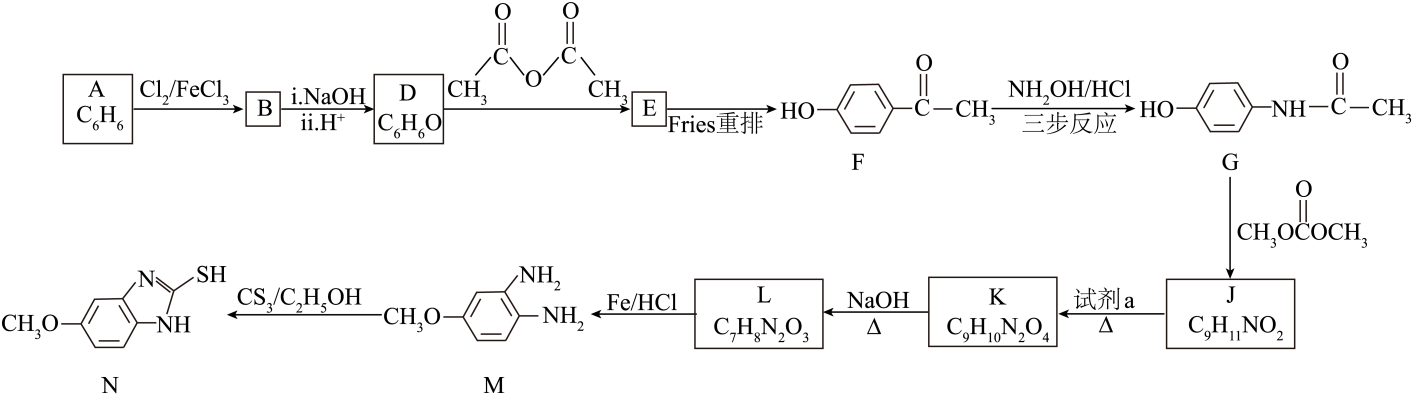
资料:“重排”指有机物分子中的一个基团迁移到另外一个原子上,其分子式不变。
(1)、A→B的反应类型是。(2)、按官能团分类,D的类别是。(3)、E含有酯基。E的结构简式是。(4)、写出符合下列条件的F的同分异构体:(写出2种)。ⅰ.在一定条件下可以发生银镜反应
ⅱ.核磁共振氢谱有4组峰,峰面积比为1:2:2:3
(5)、F与反应生成G的过程如下。
已知:ⅰ.发生加成反应时,断开键。
ⅱ.同一个碳上连着一个羟基和一个氨基(或取代的氨基)时不稳定,易脱水生成亚胺(
 )。
)。写出P、Q的结构简式:、。
(6)、J含有醚键。试剂a是。(7)、K与NaOH反应得到L的化学方程式是。五、实验题
-
19. 实验小组同学探究用新制氢氧化铜检验葡萄糖的适宜条件。
资料:ⅰ.葡萄糖在碱的作用下,可以生成黄色物质;随着温度升高,可聚合为颜色更深(如棕色)的聚合物。
ⅱ.Cu2O、CuO均溶于氨水,生成、;Cu不溶于氨水。
(1)、探究NaOH溶液的用量对该反应的影响。编号
实验Ⅰ
实验Ⅱ
实验方案


实验现象
加热,无明显现象,
静置后未见砖红色沉淀
加热、静置后,
底部有砖红色沉淀
①实验Ⅱ中,葡萄糖转化为。
②分析实验Ⅱ能生成砖红色沉淀但实验Ⅰ不能生成砖红色沉淀的原因:
a.电极反应式:
ⅰ.还原反应:
ⅱ.氧化反应:。
b.依据电极反应式分析实验Ⅱ有砖红色沉淀生成的可能原因:随增大,氧化性减弱,但是。
(2)、探究葡萄糖溶液的用量和水浴温度(加热时间约1min,冷却后过滤)对该反应的影响。实验方案
现象
温度


50℃
得到较多砖红色沉淀;滤液呈极浅黄色
得到大量砖红色沉淀;滤液呈浅橙色
70℃
得到较多砖红色沉淀;滤液呈棕黄色
得到大量砖红色沉淀并伴有少量黑色沉淀;滤液呈棕色
100℃
得到较多砖红色沉淀;滤液呈红棕色
得到大量黑色沉淀;滤液呈深棕色
①经检验,实验Ⅳ中产生的黑色沉淀中含有Cu。检验方法是:取实验Ⅳ中70℃时产生的沉淀,洗涤,(填操作和现象)。
②分析实验Ⅲ未产生黑色Cu的原因,同学提出两种假设:
假设a:葡萄糖物质的量少,无法将Cu(Ⅱ)还原为Cu单质。
假设b:(补充完整)。
经定量分析可知假设a不成立。
(3)、综合以上实验,用新制氢氧化铜检验葡萄糖时,为了能更好地观察到试管内产生砖红色沉淀,将宜采用的条件填入下表。温度/℃
NaOH溶液
葡萄糖溶液
条件
2mL10%NaOH溶液
-
-