福建省三明市2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 下列有关我国科技成果的叙述错误的是( )A、飞船返回舱使用氮化硅耐高温结构材料,氮化硅属于分子晶体 B、无磁镍铬钛合金钢常用于舰体材料,其强度高于纯铁 C、火箭使用偏二甲肼作为燃料,偏二甲肼为烃的衍生物 D、月球探测器带回的月壤样品中含磷酸盐晶体,其结构可用射线衍射仪测定2. 下列化学用语的表述正确的是( )A、聚丙烯的结构简式:
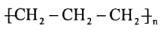 B、醛基中碳氧双键上的电荷分布示意图:
B、醛基中碳氧双键上的电荷分布示意图: C、氨的电子式:
C、氨的电子式: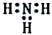 D、基态原子核外电子排布式:
3. 中国科学院天津工业生物技术研究所首次在实验室中实现CO2合成淀粉,合成路径如下图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( )
D、基态原子核外电子排布式:
3. 中国科学院天津工业生物技术研究所首次在实验室中实现CO2合成淀粉,合成路径如下图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( )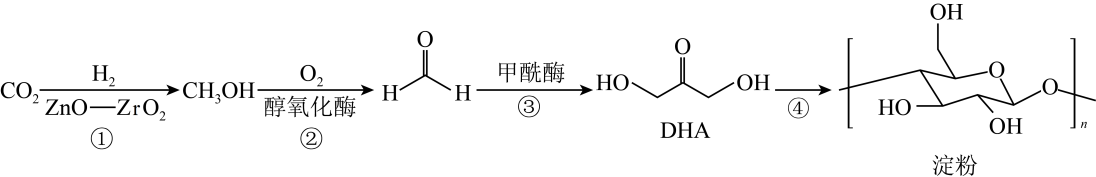 A、淀粉的分子式是(C6H12O6)n B、1 mol DHA与足量乙酸发生酯化反应,消耗乙酸分子数为NA C、标准状况下,22.4 LCH3OH所含碳原子数为NA D、反应②中,3.2 g CH3OH生成HCHO时转移电子数为0.2NA4. 有机化合物中基团之间的相互影响会导致物质性质的改变。下列事实与此无关的是( )A、乙醛能与加成而乙酸不能 B、甲苯能使酸性溶液褪色而乙烷不能 C、2-甲基-1-丙醇能发生消去反应而2,2-二甲基-1-丙醇不能 D、苯酚的羟基在水溶液中能够发生部分电离而乙醇不能5. EDTA(乙二胺四乙酸)是良好的配合剂,Ca2+与EDTA形成的螯合物结构如图所示。下列关于该螯合物的说法错误的是( )
A、淀粉的分子式是(C6H12O6)n B、1 mol DHA与足量乙酸发生酯化反应,消耗乙酸分子数为NA C、标准状况下,22.4 LCH3OH所含碳原子数为NA D、反应②中,3.2 g CH3OH生成HCHO时转移电子数为0.2NA4. 有机化合物中基团之间的相互影响会导致物质性质的改变。下列事实与此无关的是( )A、乙醛能与加成而乙酸不能 B、甲苯能使酸性溶液褪色而乙烷不能 C、2-甲基-1-丙醇能发生消去反应而2,2-二甲基-1-丙醇不能 D、苯酚的羟基在水溶液中能够发生部分电离而乙醇不能5. EDTA(乙二胺四乙酸)是良好的配合剂,Ca2+与EDTA形成的螯合物结构如图所示。下列关于该螯合物的说法错误的是( )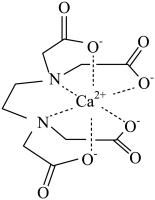 A、碳原子的杂化方式均为sp3 B、配体的配位原子为O、N C、Ca2+的配位数为6 D、组成元素中第一电离能最大的是N6. 元素a、b、c分别位于不同的短周期,a原子的次外层电子数比最外层电子数少1,b是短周期元素中原子半径最小的元素,由a、b、c三种元素形成的一种化合物的结构如图所示,下列说法正确的是( )
A、碳原子的杂化方式均为sp3 B、配体的配位原子为O、N C、Ca2+的配位数为6 D、组成元素中第一电离能最大的是N6. 元素a、b、c分别位于不同的短周期,a原子的次外层电子数比最外层电子数少1,b是短周期元素中原子半径最小的元素,由a、b、c三种元素形成的一种化合物的结构如图所示,下列说法正确的是( )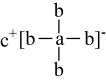 A、该化合物中不存在配位键 B、a的最高价氧化物对应水化物呈碱性 C、原子半径:r(a)>r(c)>r(b) D、与氧元素形成的化合物中可能存在共价键7. 三氟化氯是极强氧化剂,能发生自耦电离: , 其分子结构如图所示,下列推测不合理的是( )
A、该化合物中不存在配位键 B、a的最高价氧化物对应水化物呈碱性 C、原子半径:r(a)>r(c)>r(b) D、与氧元素形成的化合物中可能存在共价键7. 三氟化氯是极强氧化剂,能发生自耦电离: , 其分子结构如图所示,下列推测不合理的是( )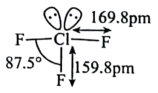 A、分子的中心原子有5对价层电子对 B、离子空间构型为正四面体 C、与反应生成和 D、比更易发生自耦电离8. 下列叙述正确的是( )
A、分子的中心原子有5对价层电子对 B、离子空间构型为正四面体 C、与反应生成和 D、比更易发生自耦电离8. 下列叙述正确的是( )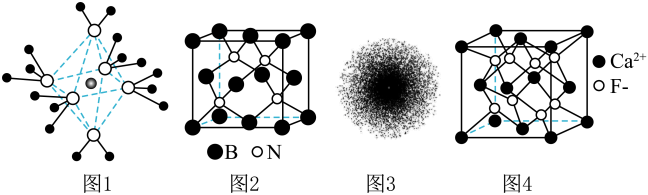 A、图1为结构示意图,该离子内存在极性键、配位键、离子键 B、图2为BN晶体的晶胞示意图,由和原子围成的最小六元环为平面结构 C、图3为原子的电子云图,一个黑点表示一个电子 D、图4为晶体的晶胞示意图,填充在由构成的正四面体空隙中9. 首例有机小分子催化剂催化的不对称Aldol反应如下:
A、图1为结构示意图,该离子内存在极性键、配位键、离子键 B、图2为BN晶体的晶胞示意图,由和原子围成的最小六元环为平面结构 C、图3为原子的电子云图,一个黑点表示一个电子 D、图4为晶体的晶胞示意图,填充在由构成的正四面体空隙中9. 首例有机小分子催化剂催化的不对称Aldol反应如下:
下列说法正确的是( )
A、分子中键和键数之比为 B、的名称为3-硝基苯甲醛 C、是乙醇的同系物 D、 分子中存在手性碳原子
10. 乙烯与溴单质反应的机理如图所示。下列叙述错误的是( )
分子中存在手性碳原子
10. 乙烯与溴单质反应的机理如图所示。下列叙述错误的是( )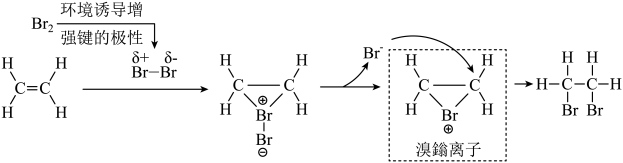 A、乙烯分子是含有极性键的非极性分子 B、乙烯分别与等浓度的的溶液和溴水反应,前者速率更快 C、溴鎓离子中溴原子最外层满足8电子稳定结构 D、乙烯与溴水反应,理论上有生成11. 下列叙述错误的是( )
A、乙烯分子是含有极性键的非极性分子 B、乙烯分别与等浓度的的溶液和溴水反应,前者速率更快 C、溴鎓离子中溴原子最外层满足8电子稳定结构 D、乙烯与溴水反应,理论上有生成11. 下列叙述错误的是( ) A、用溶液可除去溴苯中的溴单质 B、用溶液可鉴别乙酸、乙醇、乙酸乙酯 C、用可实现
A、用溶液可除去溴苯中的溴单质 B、用溶液可鉴别乙酸、乙醇、乙酸乙酯 C、用可实现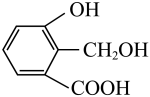 到
到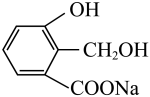 的转化
D、用如图装置可证明酸性强弱:醋酸>碳酸>苯酚
12. calebinA可用于治疗阿尔茨海默症,其结构如图。下列关于calebinA的说法正确的是( )
的转化
D、用如图装置可证明酸性强弱:醋酸>碳酸>苯酚
12. calebinA可用于治疗阿尔茨海默症,其结构如图。下列关于calebinA的说法正确的是( )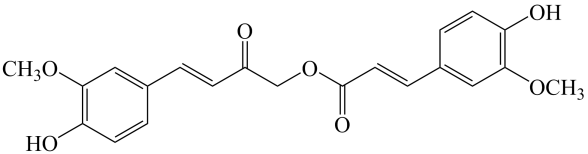 A、该物质与溶液反应,最多消耗 B、该物质与加成,最多消耗 C、该物质与溴水反应,最多消耗 D、该物质苯环上的一氯代物有3种13. 高分子可用于制备聚合物离子导体,合成路线如下:
A、该物质与溶液反应,最多消耗 B、该物质与加成,最多消耗 C、该物质与溴水反应,最多消耗 D、该物质苯环上的一氯代物有3种13. 高分子可用于制备聚合物离子导体,合成路线如下: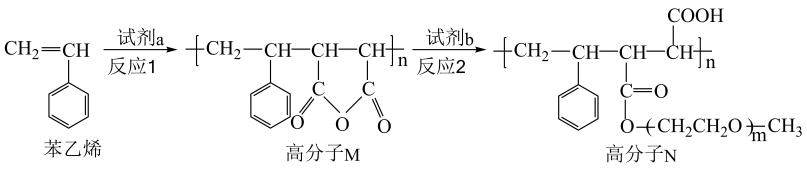
下列说法错误的是( )
A、苯乙烯分子中所有原子可能共平面 B、反应1为加聚反应,反应2为取代反应 C、试剂为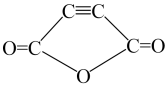 D、试剂为
D、试剂为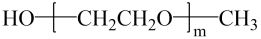 14. 将6.8gX完全燃烧生成和8.96L(标准状况)。X的质谱图、核磁共振氢谱图与红外光谱图如图所示。下列关于的叙述错误的是( )
14. 将6.8gX完全燃烧生成和8.96L(标准状况)。X的质谱图、核磁共振氢谱图与红外光谱图如图所示。下列关于的叙述错误的是( )
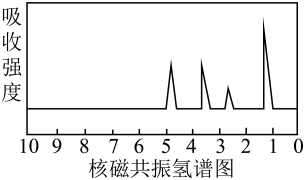
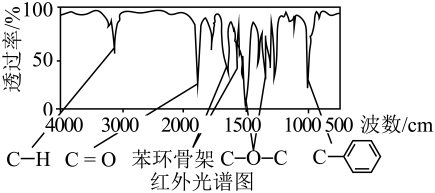 A、的化学式为 B、分子中有四种化学环境不同的氢原子 C、的官能团一定为醚键和羰基 D、可能是
A、的化学式为 B、分子中有四种化学环境不同的氢原子 C、的官能团一定为醚键和羰基 D、可能是 15. 下列实验方案能达到实验目的的是( )
15. 下列实验方案能达到实验目的的是( )选项
实验方案
实验目的
A
在2mL2%氨水中滴加溶液
配制银氨溶液
B
在淀粉溶液中加入适量20%硫酸,加热,冷却后加NaOH溶液至中性,再滴加碘水,溶液变蓝
证明淀粉未完全水解
C
加热溴乙烷与NaOH溶液的混合物一段时间,取少量冷却后的上层溶液,加入足量稀硝酸后滴入溶液,产生沉淀
证明溴乙烷发生的是取代反应
D
在丙烯醛()中加入碱性的新制悬浊液,加热后产生砖红色沉淀;取上层清液,加入溴水,溴水褪色
证明丙烯醛中含有醛基和碳碳双键
A、A B、B C、C D、D16. 某实验小组探究酸对平衡的影响。将溶液(接近无色)和溶液等体积混合,得到红色溶液,取两等份红色溶液,进行如下操作并记录现象。下列结论错误的是( )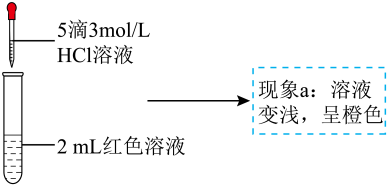
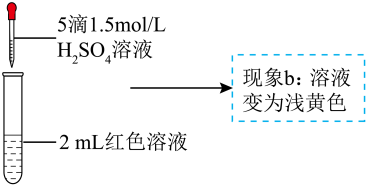
实验a 实验 b
查阅资料:(黄色);(无色)
A、、、都属于难电离的微粒 B、中的配位键由原子提供孤电子对 C、现象中使溶液呈橙色的微粒可能是和 D、改变或 , 平衡会发生移动二、结构与性质
-
17. 硒是人体不可缺少的微量元素,铈是稀土元素中丰度最大的元素,它们的化合物在生产、生活中有着广泛的应用。回答下列问题:
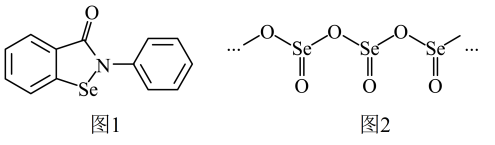 (1)、基态Se原子的核外价电子轨道表示式为。(2)、“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中原子的杂化类型为 , 元素Se、O、N的第一电离能由大到小的顺序为。(3)、硒的某种链状聚合氧化物结构如图2所示,其化学式为。(4)、与具有相似的结构,室温时,是一种气体。沸点高低:(填“>”或“<”或“=”),原因是。(5)、二硫键和二硒键是重要的光响应动态共价键,其光响应原理如图3所示。已知光的波长与其能量成反比,则图中实现光响应的波长:(填“>”或“<”或“=”)。
(1)、基态Se原子的核外价电子轨道表示式为。(2)、“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图1所示。“依布硒”中原子的杂化类型为 , 元素Se、O、N的第一电离能由大到小的顺序为。(3)、硒的某种链状聚合氧化物结构如图2所示,其化学式为。(4)、与具有相似的结构,室温时,是一种气体。沸点高低:(填“>”或“<”或“=”),原因是。(5)、二硫键和二硒键是重要的光响应动态共价键,其光响应原理如图3所示。已知光的波长与其能量成反比,则图中实现光响应的波长:(填“>”或“<”或“=”)。 (6)、二氧化铈()氧载体具有良好的储氧放氧能力,可用于甲烷化学链重整,其原理如下图所示。
(6)、二氧化铈()氧载体具有良好的储氧放氧能力,可用于甲烷化学链重整,其原理如下图所示。
中 , 和个数比为。
18. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型非金属元素到典型金属元素的完整过渡。回管下列问题:(1)、羟胺(NH2OH)的水溶液呈碱性,其碱性原理与氨水相似,同浓度两种溶液的碱性较强的是(填“NH2OH”或“NH3”),原因是。(2)、氢键的形成对物质的密度、熔沸点、粘稠性等产生影响。市售82%磷酸是粘稠状的液体,黏度较大的原因是。(3)、南开大学某课题组成功合成无机二茂铁的类似物[FeP8]2- , 结构如图所示,环状结构与苯相似,中的大键表示为。(分子中的大π键可用表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)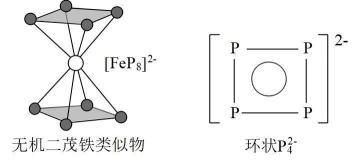 (4)、超盐晶体PH4AlBr4由超碱和超卤素组成。比较与PH3键角大小:PH3(填“”、“<”或“=”),原因是。(5)、钼酸铋(Bi2MoO6)可用于光催化水的分解,其立方晶胞结构(未画出氧原子)如图所示,晶胞参数为a pm、a pm、c pm。
(4)、超盐晶体PH4AlBr4由超碱和超卤素组成。比较与PH3键角大小:PH3(填“”、“<”或“=”),原因是。(5)、钼酸铋(Bi2MoO6)可用于光催化水的分解,其立方晶胞结构(未画出氧原子)如图所示,晶胞参数为a pm、a pm、c pm。
①若原子1的分数坐标为( , , 0),原子2的分数坐标为。
②设NA为阿伏加德罗常数的值,Bi2MoO6的摩尔质量为M。Bi2MoO6晶体的密度为g/cm3 (列计算式)。
三、实验题
-
19. 邻硝基苯甲醛(
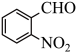 )是一种精细化工产品。实验室以邻硝基苯甲醇(
)是一种精细化工产品。实验室以邻硝基苯甲醇( )为原料,利用物质在水相和有机相两相中溶解性不同制备得到,实验装置(夹持仪器已略去)和反应原理分别如图1和图2所示。
)为原料,利用物质在水相和有机相两相中溶解性不同制备得到,实验装置(夹持仪器已略去)和反应原理分别如图1和图2所示。已知:1.部分物质的性质
物质
溶解性
熔点/℃
沸点/℃
水
邻硝基苯甲醛
微溶
易溶
70
270
邻硝基苯甲醇
难溶
易溶
43
153
TEMPO—COOH
易溶
难溶
—
—
2.
 +NaHSO3
+NaHSO3 (易溶于水)
(易溶于水)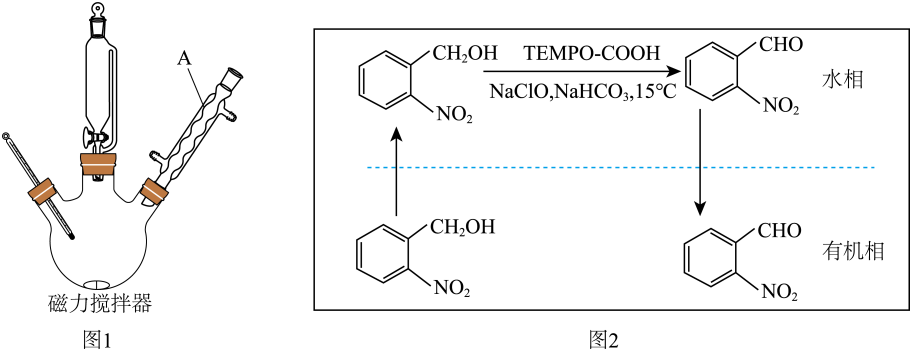 (1)、Ⅰ.制备:向三颈瓶中依次加入15.3g邻硝基苯甲醇、10.0mL二氯甲烷和磁子,搅拌,待固体全部溶解后,再依次加入的水溶液和饱和溶液。保持温度 , 逐滴加入足量水溶液,持续反应。经一系列操作得到粗产品。
(1)、Ⅰ.制备:向三颈瓶中依次加入15.3g邻硝基苯甲醇、10.0mL二氯甲烷和磁子,搅拌,待固体全部溶解后,再依次加入的水溶液和饱和溶液。保持温度 , 逐滴加入足量水溶液,持续反应。经一系列操作得到粗产品。
仪器的名称为 , 作用是。(2)、控制反应温度为的方法是。(3)、滴加水溶液生成产品的化学方程式为。该步反应要逐滴加入的目的是。(4)、Ⅱ.提纯:在粗产品中加入饱和溶液,充分反应后分液,在水层中加入氢氧化钠溶液,待固体完全析出后,进行抽滤、洗涤、干燥至恒重,得13.0g产品。
氢氧化钠溶液的作用是。(5)、本次实验的产率为(计算结果保留3位有效数字)。(6)、该制备采用两相反应体系可以大幅提高邻硝基苯甲醛的产率,原因是。四、有机推断题
-
20. 美乐托宁(G)具有抗氧化、抗炎、抑制肿瘤生长等作用。它的一种合成路线如下:
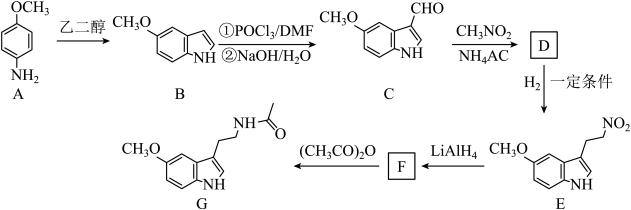
已知:
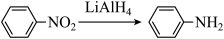
回答下列问题:
(1)、A中不含氧元素的官能团的名称是。的反应类型是。(2)、D的结构简式为。(3)、的反应方程式为。(4)、化合物的相对分子质量比大14,符合下列条件的的同分异构体有种(不考虑立体异构)。①芳香族化合物
②稀溶液遇到溶液显紫色
③苯环上只有两个取代基
其中核磁共振氢谱有4组峰,峰面积之比为的结构简式为。
(5)、4-甲氧基乙酰苯胺(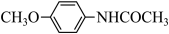 )是重要的精细化工中间体,根据上述路线中的相关知识,写出由苯甲醚(
)是重要的精细化工中间体,根据上述路线中的相关知识,写出由苯甲醚(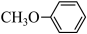 )制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。
-