湖南省郴州市2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 化学与生活、生产、科技、及社会发展密切相关。下列说法正确的是( )A、宇航服材料之一聚酰胺纤维是天然有机高分子材料 B、醴陵釉下五彩瓷烧制温度达1380℃,该过程中发生了复杂的物理、化学变化 C、为增强“84”消毒液的消毒效果,可加入适量稀盐酸 D、侯氏制碱法中为提高气体利用率,向饱和食盐水中先通入后通入氨气2. 我国科学家成功利用人工合成淀粉,使淀粉生产方式从农业种植转为工业制造成为可能,其原理如下所示。下列说法错误的是 ( )
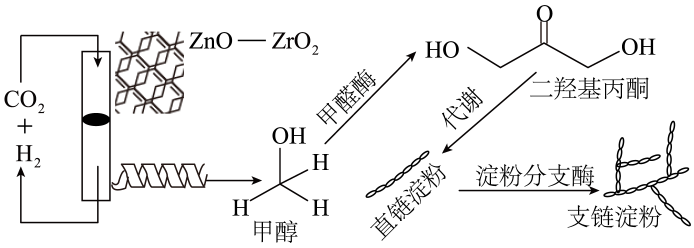 A、甲醇可用于燃料电池的正极反应物 B、淀粉可用于制备葡萄糖 C、该过程有利于实现“碳达峰,碳中和” D、化妆品中添加二羟基丙酮的主要作用为保湿3. 下列化学用语表示正确的是( )A、HClO的电子式:
A、甲醇可用于燃料电池的正极反应物 B、淀粉可用于制备葡萄糖 C、该过程有利于实现“碳达峰,碳中和” D、化妆品中添加二羟基丙酮的主要作用为保湿3. 下列化学用语表示正确的是( )A、HClO的电子式: B、基态In(铟)原子的价层电子排布式为
C、离子结构示意图
B、基态In(铟)原子的价层电子排布式为
C、离子结构示意图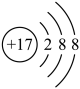 ,既可以表示 , 也可以表示
D、键线式为
,既可以表示 , 也可以表示
D、键线式为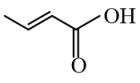 的有机物不存在顺反异构
4. 设表示阿伏加德罗常数的值,下列判断正确的是( )A、中含有共价键的数目为 B、盐酸中含有的数目大于 C、3.2gCu与足量S完全反应,转移的电子数目为 D、将全部转化为胶体,其中氢氧化铁胶粒数目为5. “宏观辨识与微观探析”是学科核心素养之一,下列离子方程式正确且符合题意的是( )A、通入水中制氯水: B、用铜片作电极,电解饱和食盐水: C、向过量的溶液中滴加少量“84”消毒液: D、用双氧水和稀硫酸处理铜印刷电路板6. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被溶液吸收生成配合物 , 减少环境污染。下列说法正确的是( )A、该配合物中所含非金属元素均位于元素周期表的p区 B、提供孤电子对用于形成配位键 C、该配合物中阴离子空间结构为正四面体形 D、配离子为 , 中心离子的配位数为57. 某同学结合所学知识探究与能否反应,设计装置如下,下列说法正确的是( )
的有机物不存在顺反异构
4. 设表示阿伏加德罗常数的值,下列判断正确的是( )A、中含有共价键的数目为 B、盐酸中含有的数目大于 C、3.2gCu与足量S完全反应,转移的电子数目为 D、将全部转化为胶体,其中氢氧化铁胶粒数目为5. “宏观辨识与微观探析”是学科核心素养之一,下列离子方程式正确且符合题意的是( )A、通入水中制氯水: B、用铜片作电极,电解饱和食盐水: C、向过量的溶液中滴加少量“84”消毒液: D、用双氧水和稀硫酸处理铜印刷电路板6. 氮及其化合物在生产生活中具有广泛应用。氮气经过一系列的变化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被溶液吸收生成配合物 , 减少环境污染。下列说法正确的是( )A、该配合物中所含非金属元素均位于元素周期表的p区 B、提供孤电子对用于形成配位键 C、该配合物中阴离子空间结构为正四面体形 D、配离子为 , 中心离子的配位数为57. 某同学结合所学知识探究与能否反应,设计装置如下,下列说法正确的是( )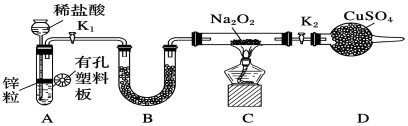 A、装置A也可直接用于与浓盐酸反应制取 B、装置A气密性检查方法:先关闭活塞 , 再向长颈漏斗中加水,当漏斗中液面高于试管液面且高度不变说明气密性良好 C、装置B中盛放的试剂只是用来除去A中挥发出来的少量水蒸气 D、若装置气密性良好,连接好装置,装好试剂,再直接点燃酒精灯,观察现象8. 五倍子是一种常见的中草药,有效成分为X,一定条件下X可分别转化为Y、Z。
A、装置A也可直接用于与浓盐酸反应制取 B、装置A气密性检查方法:先关闭活塞 , 再向长颈漏斗中加水,当漏斗中液面高于试管液面且高度不变说明气密性良好 C、装置B中盛放的试剂只是用来除去A中挥发出来的少量水蒸气 D、若装置气密性良好,连接好装置,装好试剂,再直接点燃酒精灯,观察现象8. 五倍子是一种常见的中草药,有效成分为X,一定条件下X可分别转化为Y、Z。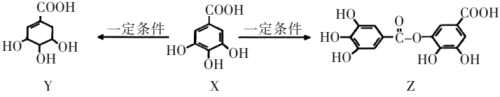
下列说法不正确的是( )
A、Y可以发生加成,取代,消去,氧化反应 B、X和Y不能用溶液鉴别 C、1molZ最多能与8molNaOH发生反应,1molX能与发生取代反应 D、X与足量氢气发生加成反应,所得产物中有2个手性碳原子9. 某化合物结构如图所示,其中X、Y、W、Z是原子序数依次增大的短周期元素,且四种元素分布在三个周期,W的最外层电子数是Y的最外层电子数的2倍,Z和X同主族。下列说法正确的是( )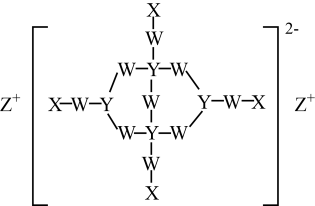 A、W与Z形成的化合物中可能有非极性共价键 B、同一周期中比W原子第一电离能小的还有5种元素 C、电负性:Y>W D、离子半径:Z>W>Y10. 以某冶金工业产生的废渣(含、及少量的)为原料,根据如图流程可制备 , 下列说法错误的是( )
A、W与Z形成的化合物中可能有非极性共价键 B、同一周期中比W原子第一电离能小的还有5种元素 C、电负性:Y>W D、离子半径:Z>W>Y10. 以某冶金工业产生的废渣(含、及少量的)为原料,根据如图流程可制备 , 下列说法错误的是( )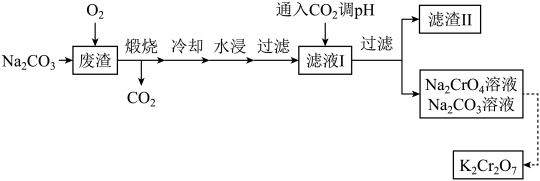 A、煅烧过程发生的反应为 B、通入调pH的目的是为了除去Al元素和Si元素杂质 C、该流程中可循环使用的物质是和 D、由转化为的过程中需要加入KOH11. 下列实验目的对应的方案设计、现象和结论都正确的是( )
A、煅烧过程发生的反应为 B、通入调pH的目的是为了除去Al元素和Si元素杂质 C、该流程中可循环使用的物质是和 D、由转化为的过程中需要加入KOH11. 下列实验目的对应的方案设计、现象和结论都正确的是( )选项
实验目的
方案设计
现象和结论
A
检验溶液中是否含钠元素
将蘸取溶液的玻璃棒放在无色火焰上灼烧
火焰出现黄色,说明溶液中含钠元素
B
在时,比较与结合能力强弱
向溶液中,先加NaOH溶液调节 , 再加入足量的KSCN溶液
红褐色沉淀不溶解,说明在时,结合的能力更强
C
比较T℃时与的大小
T℃时,向等体积的饱和AgCl、AgI溶液中分别滴加足量溶液
所得沉淀 , 则
D
比较亚硫酸与碳酸的酸性强弱
分别测定、饱和溶液的pH
前者小,说明亚硫酸酸性更强
A、A B、B C、C D、D12. 我国科学家合成了Y、Sc( , )单原子催化剂,用于电化学催化氢气还原氮气的反应。反应历程与相对能量模拟计算结果如图所示(*表示稀土单原子催化剂)。下列说法中错误的是( ) A、其它条件相同下,使用催化剂更有利于提高产量 B、两种催化剂,反应的快慢都是由生成*NNH的速率决定 C、实际生产中将催化剂处理成纳米级颗粒可提高氨气的平衡转化率 D、工业合成氨与电化学催化还原氮气均涉及到共价键的断裂与形成13. 某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时 得电子成为Li嵌入该薄膜材料中;电极B为 薄膜;集流体起导电作用。下列说法不正确的是( )
A、其它条件相同下,使用催化剂更有利于提高产量 B、两种催化剂,反应的快慢都是由生成*NNH的速率决定 C、实际生产中将催化剂处理成纳米级颗粒可提高氨气的平衡转化率 D、工业合成氨与电化学催化还原氮气均涉及到共价键的断裂与形成13. 某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时 得电子成为Li嵌入该薄膜材料中;电极B为 薄膜;集流体起导电作用。下列说法不正确的是( ) A、充电时,集流体A与外接电源的负极相连 B、放电时,外电路通过 电子时, 薄膜电解质损失 C、放电时,电极B为正极,反应可表示为 D、电池总反应可表示为14. 在某温度时,将xmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )
A、充电时,集流体A与外接电源的负极相连 B、放电时,外电路通过 电子时, 薄膜电解质损失 C、放电时,电极B为正极,反应可表示为 D、电池总反应可表示为14. 在某温度时,将xmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( ) A、a点: B、氨水的浓度等于1.0mol/L C、bc段在c点之前的过程中离子浓度大小关系有可能为 D、b、c、d三点水的电离程度大小关系是c>b>d
A、a点: B、氨水的浓度等于1.0mol/L C、bc段在c点之前的过程中离子浓度大小关系有可能为 D、b、c、d三点水的电离程度大小关系是c>b>d二、实验题
-
15. 碳酸亚铁()是生产补血剂的重要原料,制取过程中涉及以下实验。(1)、实验一:为探究某固体化合物X(仅含有三种元素)的组成和性质,设计并完成如下实验

已知:气体甲、气体乙均为短周期元素的单质。请回答:
化合物X含有的元素为(写元素符号),化合物A的化学式为。写出A溶于足量稀硝酸的化学反应方程式为。(2)、实验二:如图装置利用实验一所得溶液B制取(白色固体,难溶于水):
装置丙中,先将导管移出液面通入一段时间气体,再向溶液()通入一段时间至其pH为7,滴加一定量B溶液产生白色沉淀和无色气体,过滤、洗涤、干燥,得到固体。请回答:
丙装置的反应仪器名称是。试剂a是。(3)、向溶液通入的目的是。(4)、常温下,向溶液()通入一段时间至时溶液中(已知的 , )。(5)、丙装置中制取的离子方程式为。(6)、检验溶液B中的金属阳离子可选用下列哪些试剂____。A、酸性高锰酸钾溶液 B、NaOH C、 D、KSCN(7)、100mL0.8mol/LB溶液完全反应,最终得到8.2克固体,则产率为(结果保留2位小数)。三、工业流程题
-
16. 工业上用硫化镍矿(主要成分为NiS,含有ZnS、CuS、FeS等杂质)制备的工艺流程如下:
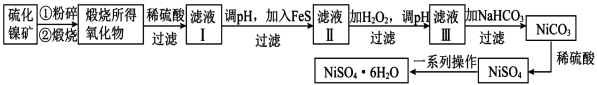 (1)、将硫化镍矿粉碎的目的是 , 煅烧NiS生成NiO和的化学方程式为。(2)、向滤液Ⅰ中加入FeS是为了生成难溶于水的硫化物沉淀而除去、等杂质,则除去的离子方程式为 , 该反应的化学平衡常数为(已知 , , )。(3)、往滤液Ⅲ中加入溶液反应的离子方程式为。(4)、滤液Ⅲ中溶质的主要成分是 , 加过滤后得到沉淀,再加适量稀硫酸溶解又生成 , 这两步操作的目的是。(5)、用惰性电极电解溶液时,在极得到单质镍,另一电极的电极反应式为:。
(1)、将硫化镍矿粉碎的目的是 , 煅烧NiS生成NiO和的化学方程式为。(2)、向滤液Ⅰ中加入FeS是为了生成难溶于水的硫化物沉淀而除去、等杂质,则除去的离子方程式为 , 该反应的化学平衡常数为(已知 , , )。(3)、往滤液Ⅲ中加入溶液反应的离子方程式为。(4)、滤液Ⅲ中溶质的主要成分是 , 加过滤后得到沉淀,再加适量稀硫酸溶解又生成 , 这两步操作的目的是。(5)、用惰性电极电解溶液时,在极得到单质镍,另一电极的电极反应式为:。四、原理综合题
-
17.(1)、Ⅰ.丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应。
反应1: (平衡常数)
反应2: (平衡常数)
若丙烷脱氢制丙烯反应3: (平衡常数)的正反应活化能为akJ/mol,则逆反应活化能为kJ/mol,(用和表示)。(2)、在恒温恒容容器中发生反应1,下列能说明已达到平衡状态的有____(填标号)。A、每断裂键,同时断裂键 B、气体的平均相对分子质量不再变化 C、混合气体的密度不再变化 D、(3)、Ⅱ.与催化重整制合成气是研究热点之一,重整能获得氢能同时能高效转化温室气体
恒压下进行与催化重整实验,初始压强为 , 起始投料 , 会发生如下反应反应4:
反应5:
①预测反应4能自发进行的反应条件(填“高温”或“低温”)
②和的平衡转化率随温度变化曲线如图所示。

曲线(填“A”或“B”)表示的平衡转化率。800K,反应4的压强平衡常数(是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)、研究表明二氧化碳氧化丙烷脱氢制取丙烯可采用铬的氧化物为催化剂,其反应机理如图所示。该工艺可有效维持催化剂活性(催化剂因积碳粘附慢慢失去活性),请结合方程式说明原因:。 (5)、铬的某种氧化物晶胞结构如图所示。六棱柱边长为apm,高为bpm,代表阿伏加德罗常数的值。该晶体的化学式为 , 该晶体的密度(用计算表达式表示)
(5)、铬的某种氧化物晶胞结构如图所示。六棱柱边长为apm,高为bpm,代表阿伏加德罗常数的值。该晶体的化学式为 , 该晶体的密度(用计算表达式表示)
五、有机推断题
-
18. 化合物G是合成一种杀虫剂的重要中间体,其合成路线如图:
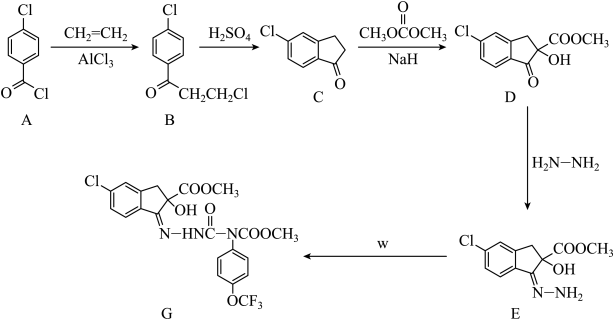
回答下列问题
(1)、B中官能团的名称为 , A生成B的反应类型为。(2)、写出B生成C的反应方程式。(3)、W的分子式为 , 其结构简式为。(4)、满足下列条件所有的A的同分异构体有种。①属于芳香族化合物; ②能发生银镜反应;
写出其中核磁共振氢谱有3组峰的所有结构简式。
(5)、请以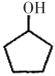 和
和 为原料设计合成
为原料设计合成 的路线(无机试剂任选)。
的路线(无机试剂任选)。
-
-
-