甘肃省酒泉市2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 我国践行科技兴国的发展战略,近年来收获了丰硕的科技成果。下列说法正确的是( )A、“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅 B、“神舟”十六号飞船航天员穿的航天服使用了多种合成纤维 C、“祝融号”火星车利用正十一烷储能,正十一烷属于有机高分子化合物 D、“鲲龙”水陆两栖飞机实现海上直飞,其所用燃料航空煤油是纯净物2. 下列示意图与化学用语表述内容不相符的是( )
A
B
C
D
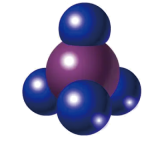

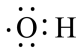
分子的空间填充模型
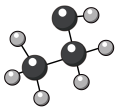
乙醇的球棍模型
聚异戊二烯的结构简式
羟基的电子式
A、A B、B C、C D、D3. 下列反应的离子方程式书写正确的是( )A、铜片与稀反应生成气体: B、溶液中加入稀硫酸: C、大理石溶于醋酸中: D、硫化亚铁溶于稀硝酸中:4. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,乙醇分子中含有的共价键数目为 B、环状(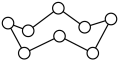 )分子中含有的键数目为
C、浓硫酸与足量铜加热反应,生成的分子数目为
D、光照条件下,将与充入一密闭容器内充分反应后,容器内气体的分子数目为
5. 草莽酸是合成治疗禽流感的药物达菲的原料之一,下列关于它的叙述正确的是( )
)分子中含有的键数目为
C、浓硫酸与足量铜加热反应,生成的分子数目为
D、光照条件下,将与充入一密闭容器内充分反应后,容器内气体的分子数目为
5. 草莽酸是合成治疗禽流感的药物达菲的原料之一,下列关于它的叙述正确的是( )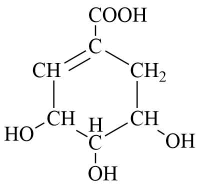 A、养莽酸和足量钠反应生成(标准状况) B、含有三种含氧官能团 C、能发生加成反应,取代反应和氧化反应 D、有机物中所有碳原子处于同一平面6. 下列实验装置设计正确,且能达到实验目的的是( )
A、养莽酸和足量钠反应生成(标准状况) B、含有三种含氧官能团 C、能发生加成反应,取代反应和氧化反应 D、有机物中所有碳原子处于同一平面6. 下列实验装置设计正确,且能达到实验目的的是( )选项
A
B
C
D
实验目的
制取氨气
收集
制取
除去乙烯中混有的少量的
实验装置

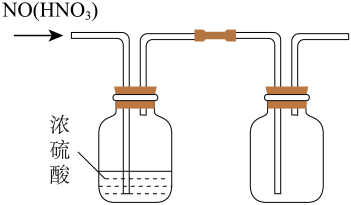
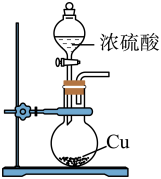
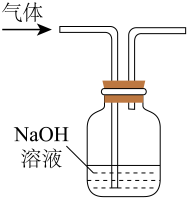 A、A B、B C、C D、D7. 自然界中臭氧形成反应的能量变化如图所示。下列说法中正确的是( )
A、A B、B C、C D、D7. 自然界中臭氧形成反应的能量变化如图所示。下列说法中正确的是( )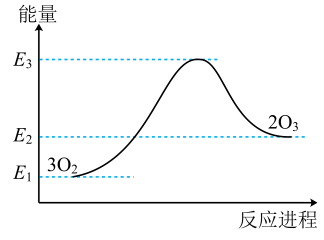 A、根据能量图可以判断为放热反应 B、臭氧比氧气稳定 C、O2的能量低于O3的能量 D、断开中的化学键吸收的能量大于形成中的化学键释放的能量8. 如图为某原电池的结构示意图。下列说法正确的是( )
A、根据能量图可以判断为放热反应 B、臭氧比氧气稳定 C、O2的能量低于O3的能量 D、断开中的化学键吸收的能量大于形成中的化学键释放的能量8. 如图为某原电池的结构示意图。下列说法正确的是( )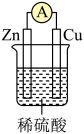 A、锌片为负极,锌片发生还原反应 B、电子的流动方向:锌→导线→铜→稀硫酸→锌 C、在铜电极上氢离子失去电子放出氢气 D、若有锌被溶解,电路中就有电子通过9. 将2molSO2和2molO2通入在一固定容积1L的密闭容器中进行如下反应:2SO2(g)+O2(g)2SO3(g),已知反应进行到10min时达到平衡,此时SO3的物质的量为1.8mol。下列说法错误的是( )A、10min内,用O2表示该反应的平均反应速率为0.09mol•L-1•min-1 B、10min后反应体系的各组分的浓度不再发生变化 C、10min时,2v正(O2)=v逆(SO3) D、11min时,升高温度,反应体系中各组分的体积分数不变10. 下列化学实验中操作、现象及结论都正确的是( )
A、锌片为负极,锌片发生还原反应 B、电子的流动方向:锌→导线→铜→稀硫酸→锌 C、在铜电极上氢离子失去电子放出氢气 D、若有锌被溶解,电路中就有电子通过9. 将2molSO2和2molO2通入在一固定容积1L的密闭容器中进行如下反应:2SO2(g)+O2(g)2SO3(g),已知反应进行到10min时达到平衡,此时SO3的物质的量为1.8mol。下列说法错误的是( )A、10min内,用O2表示该反应的平均反应速率为0.09mol•L-1•min-1 B、10min后反应体系的各组分的浓度不再发生变化 C、10min时,2v正(O2)=v逆(SO3) D、11min时,升高温度,反应体系中各组分的体积分数不变10. 下列化学实验中操作、现象及结论都正确的是( )选项
操作或装置
现象
结论
A
向鸡蛋清溶液中加入适量醋酸铅溶液并充分混合
溶液中有沉淀析出
可用醋酸铅溶液分离提纯蛋白质
B
向某溶液中滴加溶液并加热,用湿润的蓝色石蕊试纸检验产生的气体
试纸变红
该溶液中含有
C
在烧杯中将氢氧化钡晶体和氯化铵晶体混合搅拌
片刻后用手触摸烧杯底部感到冰凉,同时能闻到有刺激性气味的气体生成
此反应为吸热反应
D
向适量淀粉溶液中加入溶液,然后在温水中放置分钟,冷却后向其中加入适量新制氢氧化铜悬浊液,加热
混合液中无红色沉淀生成
说明淀粉没有发生水解
A、A B、B C、C D、D11. “空气吹出法”是工业上常用的一种海水提溴技术,流程图如下。下列说法正确的是( )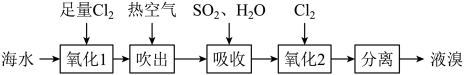 A、氧化1和氧化2过程中发生的主要反应的离子方程式为 B、“吹出”后剩余溶液中,大量存在的离子有 C、工业上每获得 , 需要消耗标准状况下的体积为 D、分离出的液溴可以储存在铁质容器中12. 下表是某风味固体饮料中的部分配料与说明:
A、氧化1和氧化2过程中发生的主要反应的离子方程式为 B、“吹出”后剩余溶液中,大量存在的离子有 C、工业上每获得 , 需要消耗标准状况下的体积为 D、分离出的液溴可以储存在铁质容器中12. 下表是某风味固体饮料中的部分配料与说明:配料
白砂糖
食品添加剂(柠檬黄、L—抗坏血酸、山梨酸钾等)
矿物质(焦磷酸铁等)
生产日期
请见包装背面
保质期
18个月
贮存条件
常温条件贮存,并置于阴凉干燥处
①蔗糖是白砂糖的主要成分,与麦芽糖互为同分异构体;②柠檬黄是常见的天然色素;③L—抗坏血酸易被氧化而发挥抗氧化作用,是常用的抗氧化剂;④铁是血红细胞形成的必需元素;⑤本饮料不含任何的防腐剂。上述判断正确的是( )
A、只有①③⑤ B、只有②③④ C、只有①③④ D、①②③④⑤13. 下列有关物质的工业制法错误的是( )A、合成氨反应: B、电解熔融氧化铝冶炼铝: C、加热分解冶炼 D、电解溶液冶炼钠:14. 环氧乙烷被广泛地应用于洗涤,制药,印染等行业,生产工艺主要有乙烯直接氧化法,反应为: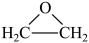 ,下列关于乙烯直接氧化法的说法合理的是( ) A、原料无爆炸危险 B、反应原子利用率为100% C、所用的原料来源于石油的分馏 D、氧化反应温度越高越好15. 在催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )
,下列关于乙烯直接氧化法的说法合理的是( ) A、原料无爆炸危险 B、反应原子利用率为100% C、所用的原料来源于石油的分馏 D、氧化反应温度越高越好15. 在催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是( )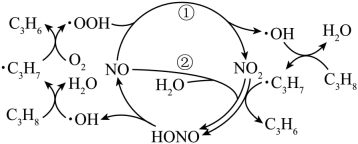 A、是反应中间体 B、反应过程中C的成键数目保持不变 C、含N分子参与的反应一定有电子转移 D、催化剂参与了化学反应过程
A、是反应中间体 B、反应过程中C的成键数目保持不变 C、含N分子参与的反应一定有电子转移 D、催化剂参与了化学反应过程二、实验题
-
16. 硫代硫酸钠常用作分析试剂及还原剂,易溶于水。某实验小组用如图装置(部分夹持、加热仪器已略去)制备硫代硫酸钠并测定其纯度。已知:在酸性条件下不稳定。
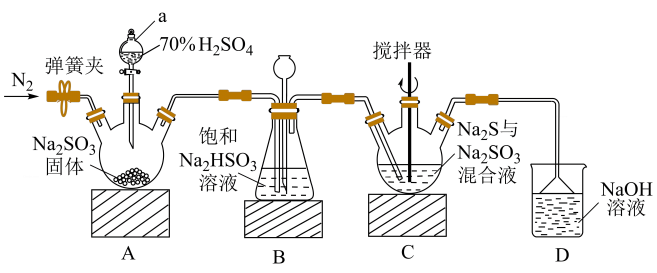
回答下列问题:
(1)、仪器组装完毕后,必须进行的实验操作是。(2)、仪器a的名称是。(3)、装置A中发生反应的化学方程式为。(4)、装置B的作用为。(5)、反应结束后,关闭a的活塞,打开弹簧夹,通入 , 目的是。(6)、将制得的样品溶于水,加入碘水溶液时,二者恰好完全反应 , 则样品的纯度为(用含m、c、V的代数式表示)。三、有机推断题
-
17. 以石油气为原料生产香料H的合成路线如下图所示。常温常压下,A为气态烷烃,且在一定条件下可裂解,D、E分子中所含的碳原子数相同。回答下列问题:
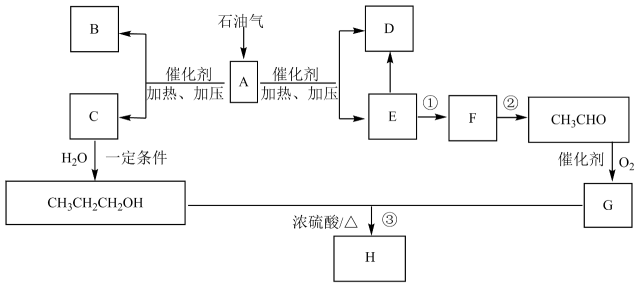 (1)、E的电子式为;G中官能团的名称是;H的结构简式为。(2)、①的反应类型为;③的反应类型为。(3)、写出A中互为同分异构体的有机物的结构简式:。(4)、写出E生成高分子化合物的化学方程式:。(5)、写出反应②的化学方程式:。(6)、写出F和G反应的化学方程式:。(7)、反应③的实验装置如图所示,饱和碳酸钠溶液的作用为(填字母)。
(1)、E的电子式为;G中官能团的名称是;H的结构简式为。(2)、①的反应类型为;③的反应类型为。(3)、写出A中互为同分异构体的有机物的结构简式:。(4)、写出E生成高分子化合物的化学方程式:。(5)、写出反应②的化学方程式:。(6)、写出F和G反应的化学方程式:。(7)、反应③的实验装置如图所示,饱和碳酸钠溶液的作用为(填字母)。
a.中和乙酸并溶解丙醇 b.降低乙酸丙酯在水中的溶解度 c.加速酯的生成,提高其产率
四、填空题
-
18. 海洋资源的利用具有非常广阔的前景。
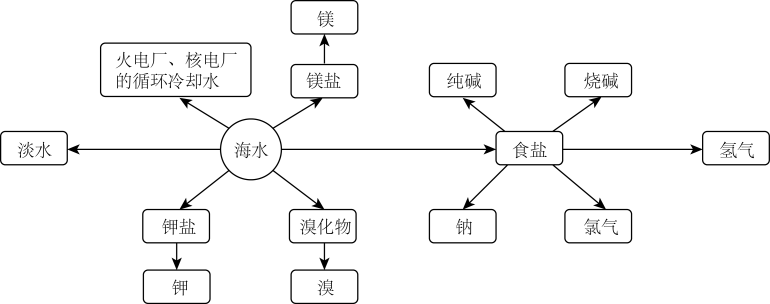
回答下列问题:
(1)、实验室模拟蒸馏法淡化海水时,应向蒸馏烧瓶中加入沸石,目的是。(2)、粗盐中可溶性杂质离子包含 , 要除去这些杂质离子得到精盐水,加入试剂的顺序可为(填字母)。a.溶液、溶液、溶液、盐酸
b.溶液、溶液、溶液、盐酸
c.溶液、溶液、溶液、盐酸
(3)、无水在熔融状态下通电会产生和 , 该反应的化学方程式为。(4)、从海带中提取碘的实验过程如下图所示:
i.步骤①中灼烧海带时,应将海带放入(填仪器名称)中灼烧。
ii.请写出步骤④反应的离子方程式:。
五、原理综合题
-
19. Ⅰ.汽车尾气中生成过程的能量变化如图所示。
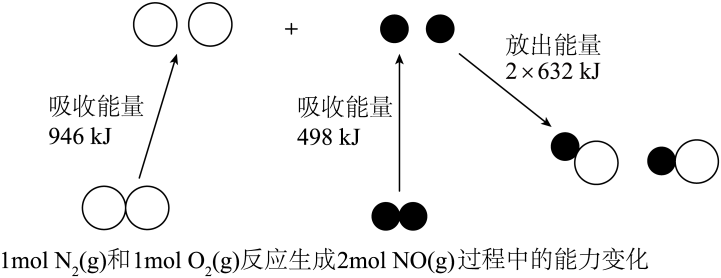 (1)、Ⅰ.汽车尾气中生成过程的能量变化如图所示。
(1)、Ⅰ.汽车尾气中生成过程的能量变化如图所示。
和完全反应生成会(填“吸收”或“放出”)能量。 (2)、Ⅱ.汽车尾气中含有等有害气体,某新型催化剂能促使发生如下反应 , 将转化为无毒气体。回答下列问题:
(2)、Ⅱ.汽车尾气中含有等有害气体,某新型催化剂能促使发生如下反应 , 将转化为无毒气体。回答下列问题:
为了测定在该催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的和浓度如表所示:时间/s
0
1
2
3
4
5
前内的平均反应速率。平衡时的转化率为。
(3)、恒容时,下列措施能使该反应速率增大的是(填字母,下同)。a.适当升高温度 b.将生成的和分离出去 c.充入氦气 d.选择高效催化剂
(4)、一定温度下,在固定容积的密闭容器中,通入和 , 在催化剂作用下发生反应。下列能作为反应达到平衡状态的依据的是。a.单位时间内消耗 , 同时生成
b.
c.容器内总压强不再改变
d.浓度之比为
(5)、研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证不同条件对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中。实验编号
初始浓度/
初始浓度/
催化剂的比表面积/
Ⅰ
280
82
Ⅱ
124
Ⅲ
350
82
①实验Ⅱ的温度是 , 实验Ⅰ、Ⅱ的目的是。
②对比实验Ⅰ、Ⅲ,得出的结论是。
-
-
-