北京市昌平区2022-2023学年高一下学期期末质量抽测化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 北京冬奥会的成功举办,极大程度促进了我国群众参与冰雪运动。下列滑雪用品涉及的主要材料中,不属于有机物的是( )
 A、滑雪杖——合金 B、滑雪板——聚乙烯 C、滑雪头盔——聚氯乙烯 D、防护镜——聚甲基丙烯酸甲酯2. 下列设备工作时,把化学能转化为电能的是( )
A、滑雪杖——合金 B、滑雪板——聚乙烯 C、滑雪头盔——聚氯乙烯 D、防护镜——聚甲基丙烯酸甲酯2. 下列设备工作时,把化学能转化为电能的是( )A
B
C
D




砷化镓太阳能电池
燃气灶
风力发电机
燃料电池
A、A B、B C、C D、D3. 下列原子半径最小的是( )A、F B、Cl C、Br D、I4. 下列各组元素中,属于同一周期的是( )A、Na、K B、N、Al C、S、Cl D、H、O5. 下列物质中,含有共价键的是( )A、 B、 C、 D、6. 下列物质的电子式书写不正确的是( )A、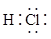 B、
B、 C、
C、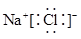 D、
D、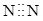 7. 作为一种新的灭菌保鲜技术,辐照已成为当代科技兴农的重要手段,例如利用对粮、蔬、果、肉等进行辐照灭菌。下列关于的说法中,正确的是( )A、质子数为27 B、中子数为60 C、质量数为87 D、核外电子数为338. 下列分子中,含有碳碳双键的是( )A、 B、 C、 D、9. M是一种烃,它的结构是:
7. 作为一种新的灭菌保鲜技术,辐照已成为当代科技兴农的重要手段,例如利用对粮、蔬、果、肉等进行辐照灭菌。下列关于的说法中,正确的是( )A、质子数为27 B、中子数为60 C、质量数为87 D、核外电子数为338. 下列分子中,含有碳碳双键的是( )A、 B、 C、 D、9. M是一种烃,它的结构是: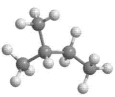 , 下列化合物中与M互为同分异构体的是( ) A、 B、 C、 D、10. 乙烯分子的球棍模型如下图所示,下列关于乙烯分子的说法中,不正确的是( )
, 下列化合物中与M互为同分异构体的是( ) A、 B、 C、 D、10. 乙烯分子的球棍模型如下图所示,下列关于乙烯分子的说法中,不正确的是( ) A、分子式为 B、官能团为 C、结构式是
A、分子式为 B、官能团为 C、结构式是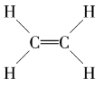 D、能使酸性高锰酸钾溶液褪色
11. 某微粒的结构示意图为
D、能使酸性高锰酸钾溶液褪色
11. 某微粒的结构示意图为 。下列关于该微粒的说法中,不正确的是( ) A、元素符号是 B、原子核外有3个电子层 C、元素非金属性比强 D、元素属于短周期元素12. 下列关于乙酸的说法中,不正确的是( )A、官能团为 B、无色无味,易溶于水 C、能与溶液反应 D、能与反应13. 下列说法中,不正确的是( )A、天然气燃烧为放热反应 B、水蒸发的过程吸热 C、碳酸氢钠与柠檬酸的反应为放热反应 D、反应物的总能量低于生成物的总能量,反应时从环境吸收能量14. 下列反应中,属于取代反应的是( )A、乙烯与氢气反应生成乙烷 B、乙醇与氧气反应生成二氧化碳和水 C、乙烯与溴反应生成1,2-二溴乙烷 D、甲烷与氯气反应生成一氯甲烷和氯化氢15. 光气在农药、医药等领域都有许多用途。一定温度下,恒容密闭容器中,与在催化剂的作用下发生反应:。下列说法中能说明该反应已经达到化学平衡状态的是( )A、消耗的同时消耗 B、的浓度相等 C、的浓度不再变化 D、在密闭容器中共存16. 下列说法中不正确的是( )A、淀粉遇碘单质变蓝 B、葡萄糖能水解 C、油脂属于酯类 D、糖类、油脂、蛋白质均含有元素17. 下列事实不能用元素周期律解释的是( )A、酸性: B、氢化物稳定性: C、金属性: D、热稳定性:18. 辛烷完全燃烧的反应是。用表示阿伏加德罗常数,下列说法中正确的是( )A、中含有碳氢键和碳碳单键 B、中含有氢氢键 C、参加反应,转移的电子数目为 D、常温常压下,中所含分子数为19. 酸性条件下,用进行脱硫处理的原理如下图所示。下列说法中,不正确的是( )
。下列关于该微粒的说法中,不正确的是( ) A、元素符号是 B、原子核外有3个电子层 C、元素非金属性比强 D、元素属于短周期元素12. 下列关于乙酸的说法中,不正确的是( )A、官能团为 B、无色无味,易溶于水 C、能与溶液反应 D、能与反应13. 下列说法中,不正确的是( )A、天然气燃烧为放热反应 B、水蒸发的过程吸热 C、碳酸氢钠与柠檬酸的反应为放热反应 D、反应物的总能量低于生成物的总能量,反应时从环境吸收能量14. 下列反应中,属于取代反应的是( )A、乙烯与氢气反应生成乙烷 B、乙醇与氧气反应生成二氧化碳和水 C、乙烯与溴反应生成1,2-二溴乙烷 D、甲烷与氯气反应生成一氯甲烷和氯化氢15. 光气在农药、医药等领域都有许多用途。一定温度下,恒容密闭容器中,与在催化剂的作用下发生反应:。下列说法中能说明该反应已经达到化学平衡状态的是( )A、消耗的同时消耗 B、的浓度相等 C、的浓度不再变化 D、在密闭容器中共存16. 下列说法中不正确的是( )A、淀粉遇碘单质变蓝 B、葡萄糖能水解 C、油脂属于酯类 D、糖类、油脂、蛋白质均含有元素17. 下列事实不能用元素周期律解释的是( )A、酸性: B、氢化物稳定性: C、金属性: D、热稳定性:18. 辛烷完全燃烧的反应是。用表示阿伏加德罗常数,下列说法中正确的是( )A、中含有碳氢键和碳碳单键 B、中含有氢氢键 C、参加反应,转移的电子数目为 D、常温常压下,中所含分子数为19. 酸性条件下,用进行脱硫处理的原理如下图所示。下列说法中,不正确的是( )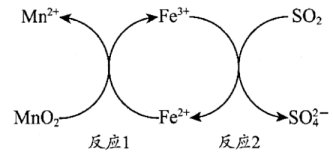 A、反应1中做氧化剂 B、反应1的产物有 C、反应2中做还原剂 D、反应2中做反应物20. 利用废铝箔(主要成分为 , 含少量等)制明矾的一种工艺流程如下:
A、反应1中做氧化剂 B、反应1的产物有 C、反应2中做还原剂 D、反应2中做反应物20. 利用废铝箔(主要成分为 , 含少量等)制明矾的一种工艺流程如下:
资料:
下列说法中,不正确的是( )
A、①体现了铝能与碱溶液反应的性质 B、乙溶液中含有的离子有 C、由④可推测,室温下明矾的溶解度小于和的溶解度 D、均具有两性21. 将形状和大小相同的条分别打磨后,与相同体积的盐酸和盐酸完全反应,放出气体的体积随时间的变化如图所示。下列说法中正确的是( )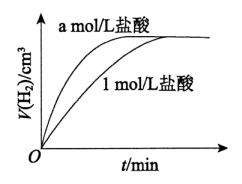 A、反应的离子方程式是: B、可推断: C、可推断:反应中镁过量 D、若用硫酸代替上述实验中盐酸,反应速率不变
A、反应的离子方程式是: B、可推断: C、可推断:反应中镁过量 D、若用硫酸代替上述实验中盐酸,反应速率不变二、有机推断题
-
22. 有机化学是以有机化合物为研究对象的学科,它的研究范围包括有机物的来源、结构、性质、合成和应用等。(1)、Ⅰ.下图是一些烃的球棍模型,回答以下问题:
上述模型①-④中,不正确的是(填序号) , 原因是(从原子结构角度予以说明)。 (2)、⑤的结构简式是。(3)、Ⅱ.餐厨垃圾在酶的作用下可获得乙醇,进一步反应可制备有机物C和高分子材料G,转化关系如下:
(2)、⑤的结构简式是。(3)、Ⅱ.餐厨垃圾在酶的作用下可获得乙醇,进一步反应可制备有机物C和高分子材料G,转化关系如下:
乙醇中含有的官能团名称是。(4)、反应ⅰ、ⅱ的化学方程式分别是、;反应类型分别是、。(5)、G的结构简式是。(6)、下列说法中,不正确的是(选填字母)。a.E、F均属于烃
b.的分子式为
c.反应ⅲ为取代反应三、填空题
-
23. 某研究小组探究原电池的原理并进行实验。(1)、下列反应中,可通过原电池装置实现化学能直接转化为电能的是(选填序号)。
① ②
③ ④
(2)、甲同学用导线将电流表与片、片相连接,插入盛有稀硫酸的烧杯中进行实验Ⅰ,如图1所示。
①能证明化学能转化为电能的实验现象是:电流表指针偏转、。
②从构成原电池的基本要素来看,的作用是(选填序号,下同) , 稀硫酸的作用是。
a.电极反应物 b.电极材料 c.离子导体 d.电子导体
(3)、乙同学想利用反应设计一个原电池,请在图2上标明所使用的用品。 (4)、氢氧燃料电池是一种新型发电装置(如图3所示),下列叙述不正确的是。
(4)、氢氧燃料电池是一种新型发电装置(如图3所示),下列叙述不正确的是。a.通氢气的一极是正极,发生氧化反应
b.电子由电极经溶液流向电极
c.总反应为

四、工业流程题
-
24. 溴被称为“海洋元素”,以下是一种从苦卤浓缩液中提取溴的流程示意图:
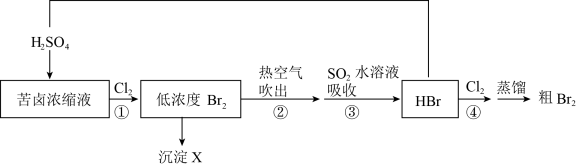
资料:常用提溴原料含溴量
提溴原料
天然海水
苦卤浓缩液
溴含量
0.045
7.270
(1)、选用苦卤浓缩液而不是天然海水作为提溴原料的原因是。(2)、海水中溴元素的存在形式是 , 写出①的离子方程式 , 该反应中两种单质的氧化性关系为 , 从原子结构角度解释原因:。(3)、③中发生反应的离子方程式是。(4)、低浓度经过操作②、③、④后得到的是。(5)、“蒸馏”操作利用的是物质哪种性质的差异性:。五、填空题
-
25. 甲酸被认为是一种有前途的储氢化合物。在催化剂作用下,甲酸分解制氢的过程如图所示。
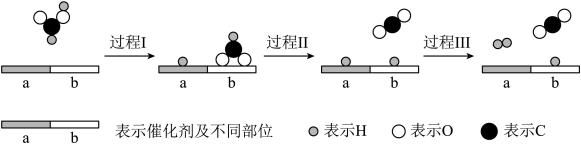 (1)、中官能团的名称是。(2)、常压下甲酸的沸点是。甲酸沸腾的过程中,外界提供的能量的作用是。(3)、过程Ⅰ中断裂的化学键是 , 过程Ⅲ中形成的化学键是。(4)、分解制氢的总反应方程式是 , 两种产物的电子式分别是、。(5)、分解制氢是一个可逆反应。在密闭容器中,通入蒸汽,一段时间后,核素存在于以下分子中:。
(1)、中官能团的名称是。(2)、常压下甲酸的沸点是。甲酸沸腾的过程中,外界提供的能量的作用是。(3)、过程Ⅰ中断裂的化学键是 , 过程Ⅲ中形成的化学键是。(4)、分解制氢的总反应方程式是 , 两种产物的电子式分别是、。(5)、分解制氢是一个可逆反应。在密闭容器中,通入蒸汽,一段时间后,核素存在于以下分子中:。六、实验题
-
26. 利用催化技术可将汽车尾气中的和转化为和 , 化学方程式是:(1)、某温度下,在容积不变的密闭容器中通入和 , 测得不同时间的浓度如下表:
时间
0
1
2
3
……
3.60
3.05
2.85
2.76
……
用的浓度变化表示的平均反应速率为。
(2)、反应物初始浓度相同时,实验温度为和 , 进行以下实验:实验编号
实验目的
同种催化剂的比表面积
一段时间内的平均速率/
Ⅰ
对照实验
280
80
Ⅱ
研究催化剂比表面积对尾气转化速率的影响
a
120
Ⅲ
b
c
d
【实验分析与结论】
①补全表格a. , b. , c. , d.。
②测得 , 对比实验Ⅰ、Ⅱ,可得结论:。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是。
七、元素或物质推断题
-
27. 为常见的主族元素,根据下表信息回答问题。
元素
元素性质/原子结构信息
A
短周期元素原子半径最大(稀有气体不参与比较)
B
+3价阳离子的核外电子排布与氖原子相同
C
原子核外电子层与电子层的电子数相等
D
与同周期,化合价有等
E
原子结构示意图:
 (1)、写出元素的原子结构示意图。(2)、A、B最高价氧化物对应水化物的碱性强弱:(填化学式)。(3)、用电子式表示和D形成化合物的过程:。(4)、元素在周期表中的位置 , 关于元素及其化合物的推断中,正确的是。
(1)、写出元素的原子结构示意图。(2)、A、B最高价氧化物对应水化物的碱性强弱:(填化学式)。(3)、用电子式表示和D形成化合物的过程:。(4)、元素在周期表中的位置 , 关于元素及其化合物的推断中,正确的是。a.与的最低负化合价相同
b.的单质可与和形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:
d.氢化物稳定性:
(5)、D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号) , 原因是。(6)、元素与同主族,比多2个电子层,与氧以比例形成的化合物②的物质类别为 , 任意写出一个能体现②的类别通性的反应方程式。(7)、第四周期ⅥA族的元素硒是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)a.硒原子的半径比硫原子的大 b.的稳定性比的强
c.能与溶液反应 d.可以使酸性高锰酸钾溶液褪色
-
-
-
-
-