辽宁省沈阳市2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 下列有关化学用语正确的是( )A、乙醇的结构式:
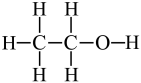 B、的电子式:
B、的电子式: C、葡萄糖的结构简式:
D、的结构式
2. 一氯取代物没有同分异构体的烷烃是( )A、2-甲基丙烷 B、2,2-二甲基丙烷 C、2-甲基丁烷 D、2,3-二甲基丁烷3. 下列离子方程式正确的是( )A、向稀中滴加溶液: B、向溶液中通入过量 C、铅酸蓄电池放电时的正极反应: D、燃料电池,当电解质为溶液时,负极反应:4. a、b、c、d四种金属,已知:①a+b2+=b+a2+;②将金属片a、c插入稀硫酸中,用导线将它们与电流表相连,a表面有大量气泡逸出;③b、d用导线连接放入d的硫酸盐溶液中,电极反应为d2++2e-=d,b-2e-=b2+。则这四种金属的活动性由强到弱的顺序是( )A、c>a>b>d B、d>b>a>c C、c>b>a>d D、d>c>a>b5. 下列关于基本营养物质说法正确的是( )A、淀粉和纤维素是天然有机高分子化合物,互为同分异构体 B、蛋白质在酸、碱或酶的作用下能发生水解反应 C、植物油含较多饱和脂肪酸的甘油酯,动物油含较多不饱和脂肪酸的甘油酯 D、糖类、油脂、蛋白质均是由C、H、O、N四种元素组成的6. 设为阿伏加德罗常数的值,下列说法不正确的是( )A、和的固体混合物中含有的阳离子数为 B、标准状况下,含有的原子数为 C、某密闭容器中盛有和各充分反应后,分子的数目为 D、加热条件下,足量的硫黄与64克的铜反应转移的电子数为7. 下列实验装置或操作正确且能达到实验目的的是( )
C、葡萄糖的结构简式:
D、的结构式
2. 一氯取代物没有同分异构体的烷烃是( )A、2-甲基丙烷 B、2,2-二甲基丙烷 C、2-甲基丁烷 D、2,3-二甲基丁烷3. 下列离子方程式正确的是( )A、向稀中滴加溶液: B、向溶液中通入过量 C、铅酸蓄电池放电时的正极反应: D、燃料电池,当电解质为溶液时,负极反应:4. a、b、c、d四种金属,已知:①a+b2+=b+a2+;②将金属片a、c插入稀硫酸中,用导线将它们与电流表相连,a表面有大量气泡逸出;③b、d用导线连接放入d的硫酸盐溶液中,电极反应为d2++2e-=d,b-2e-=b2+。则这四种金属的活动性由强到弱的顺序是( )A、c>a>b>d B、d>b>a>c C、c>b>a>d D、d>c>a>b5. 下列关于基本营养物质说法正确的是( )A、淀粉和纤维素是天然有机高分子化合物,互为同分异构体 B、蛋白质在酸、碱或酶的作用下能发生水解反应 C、植物油含较多饱和脂肪酸的甘油酯,动物油含较多不饱和脂肪酸的甘油酯 D、糖类、油脂、蛋白质均是由C、H、O、N四种元素组成的6. 设为阿伏加德罗常数的值,下列说法不正确的是( )A、和的固体混合物中含有的阳离子数为 B、标准状况下,含有的原子数为 C、某密闭容器中盛有和各充分反应后,分子的数目为 D、加热条件下,足量的硫黄与64克的铜反应转移的电子数为7. 下列实验装置或操作正确且能达到实验目的的是( )选项
A
B
C
D
装置操作

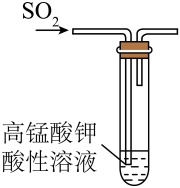
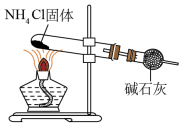
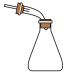
目的
熔化固体
检验二氧化硫的还原性
制备氨气
接收石油分馏所得馏分
A、A B、B C、C D、D8. 类比法是一种学习化学的重要方法。下列“类比”合理的是( )选项
已知
类比
A
稀溶液构成原电池,Mg做负极
稀溶液构成原电池,Mg做负极
B
工业上,电解熔融冶炼金属Mg
工业上,电解熔融冶炼金属Al
C
与反应生产 , 是酸性氧化物
与反应生产 , 是酸性氧化物
D
能使溶液和溴水褪色,且原理相同
能使溶液和溴水褪色,且原理相同
A、A B、B C、C D、D9. 变量控制是科学研究的重要方法。四支相同的试管中分别盛有2mL5%H2O2溶液,向其中加入水或1mol·L-1FeCl3溶液,在下列条件下发生反应,其中化学反应速率最大的是( )A
B
C
D
加入试剂
2滴水
2滴水
2滴FeCl3溶液
2滴FeCl3溶液
水浴温度/℃
20
40
20
40
A、A B、B C、C D、D10. 某物质的结构简式为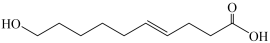 ,下列有关该物质的叙述正确的是( ) A、该物质有三种含氧官能团 B、既是乙醇的同系物也是乙酸的同系物 C、与
,下列有关该物质的叙述正确的是( ) A、该物质有三种含氧官能团 B、既是乙醇的同系物也是乙酸的同系物 C、与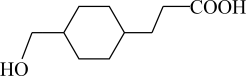 互为同分异构体
D、1mol该物质与碳酸钠反应得
11. 下列由实验得出的结论正确的是( )
互为同分异构体
D、1mol该物质与碳酸钠反应得
11. 下列由实验得出的结论正确的是( )实验
结论
A.
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色、可溶于四氯化碳
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D.
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
A、A B、B C、C D、D12. 按照自左向右的顺序连接实验仪器,能证明亚硫酸的酸性强于次氯酸的是( )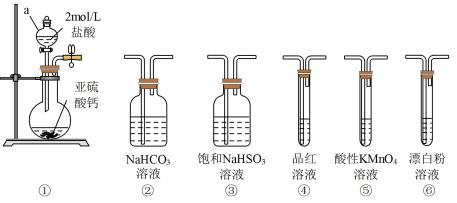 A、①③②⑤④⑥ B、①③⑥⑤④ C、①②③⑥④⑤ D、①②⑥⑤④13. 我国科研人员研制出“”电池。以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为:。其工作原理如图所示,下列说法不正确的是( )
A、①③②⑤④⑥ B、①③⑥⑤④ C、①②③⑥④⑤ D、①②⑥⑤④13. 我国科研人员研制出“”电池。以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为:。其工作原理如图所示,下列说法不正确的是( )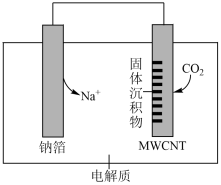 A、放电时,电子流向为:钠箔导线 B、放电时,向正极移动 C、放电时,正极的电极反应式为 D、该电池可用溶液做电解质14. 在Pd催化剂表面脱氢的反应历程与能量的关系如图所示。下列说法不正确的( )
A、放电时,电子流向为:钠箔导线 B、放电时,向正极移动 C、放电时,正极的电极反应式为 D、该电池可用溶液做电解质14. 在Pd催化剂表面脱氢的反应历程与能量的关系如图所示。下列说法不正确的( )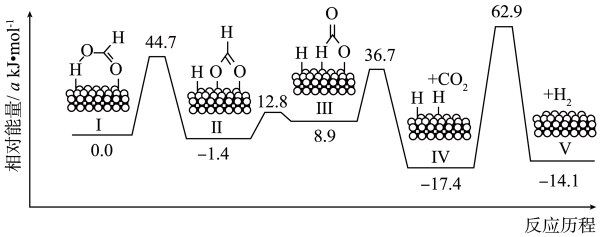 A、分解生成和放出热量 B、由图可知:相同微粒被Pd催化剂吸附后形成的体系,可能具有不同的能量 C、用或代替 , 得到的产物都有HD和 D、由反应历程预测:在Pd表面积一定时,当达到一定值时,再增大可能对反应速率没有影响15. 温度时,向容积为的密闭容器中加入D(足量)和A,发生反应 , 第后 , 温度调整到(忽略调整温度时所用的时间)。测得下列各时刻A的物质的量如下表所示。反应中没有使用催化剂,下列说法不正确的是( )
A、分解生成和放出热量 B、由图可知:相同微粒被Pd催化剂吸附后形成的体系,可能具有不同的能量 C、用或代替 , 得到的产物都有HD和 D、由反应历程预测:在Pd表面积一定时,当达到一定值时,再增大可能对反应速率没有影响15. 温度时,向容积为的密闭容器中加入D(足量)和A,发生反应 , 第后 , 温度调整到(忽略调整温度时所用的时间)。测得下列各时刻A的物质的量如下表所示。反应中没有使用催化剂,下列说法不正确的是( )0
2.00
1.50
1.25
1.15
1.00
0.95
0.93
A、 , 生成B的平均速率为 B、可以利用混合气的平均相对分子质量不变,判断平衡建立 C、由表中数据可知 D、若在恒容绝热装置中进行上述反应,可以利用装置压强不变判断平衡建立二、实验题
-
16. 某化学学习小组探究浓度对硝酸氧化能力的影响。(1)、
Ⅰ.资料显示:浓硝酸能将NO氧化成 , 而稀硝酸不能氧化NO;氢氧化钠能吸收 , 但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。

回答下列问题:
装置a的名称。(2)、写出装置①中反应的离子反应方程式。(3)、写出装置②中反应的化学反应方程式。(4)、①~⑥装置中,没有发生氧化还原反应的是。(填装置序号)(5)、下列说法正确的是。A.能证明氧化性的相对强弱的实验现象为③中溶液上方出现红棕色气体
B.②中的试剂为水
C.滴加浓硝酸前要先打开弹簧夹通一段时间氮气
D.⑥的作用是吸收尾气NO
(6)、Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:
下列说法正确的是____。A、硝酸的浓度越大,其还原产物中高价态的N元素成分越多 B、硝酸与铁反应往往同时生成多种还原产物 C、铁能与大于溶液反应说明不存在“钝化”现象(7)、已知:在上述反应条件下,反应后铁以形式存在于溶液中。当硝酸浓度为时,计算氧化剂与还原剂的物质的量之比为:。三、填空题
-
17. 图表蕴含大量的信息,是分析解决化学问题的重要工具。(1)、
I.结合下图回答问题
图中三种分子最稳定的是(填化学式)。 (2)、若反应生成气体(选“吸收”或“放出”)kJ热量。(3)、Ⅱ.某温度时,在一个的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
(2)、若反应生成气体(选“吸收”或“放出”)kJ热量。(3)、Ⅱ.某温度时,在一个的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如下图所示。根据图中数据,回答下列问题:
该反应的化学方程式为;(4)、从开始至 , B的平均反应速率为;平衡时,C的物质的量为;(5)、Ⅲ.已知:“零级反应”是指反应速率与反应物浓度无关的化学反应。某温度下,在恒容密闭容器中发生反应 , 有关数据如下表:
下列说法正确的是。时间段 产物Z的平均生成速率 0~2 0.20 0~4 0.15 0~6 0.10 ①时,Z的浓度可能等于
②时,可逆反应可能建立平衡状态
③时,无论反应是否为零级反应,Y的体积分数一定约为
④时,无论反应是否为零级反应,可逆反应都不可能建立平衡状态
⑤时,X的物质的量为
⑥时,可逆反应可能刚刚建立平衡状态
四、有机推断题
-
18. A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有香味的无色透明油状液体。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
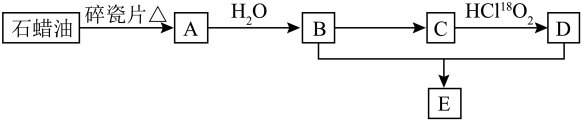
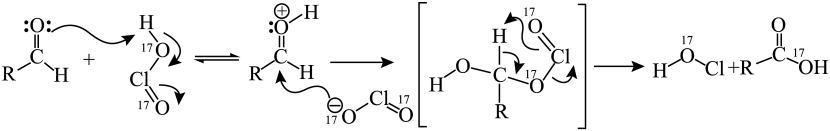
已知:
 (1)、回答下列问题。
(1)、回答下列问题。①的反应类型是;
②A、D中官能团的名称分别是、;
③E的名称是。
(2)、下列关于有机物A、B、C、D、E的说法正确的。①通过煤的干馏可以得到A
②医疗上常用(体积分数)的B溶液做消毒剂
③由C的官能团预测:C可能与新制的氢氧化铜反应,生成砖红色的氧化铜沉淀
④当温度低于D的熔点时,D可凝结成类似冰一样的晶体
⑤E的密度大于水
(3)、根据已知信息,写出反应的化学方程式:。(4)、丁烷是由石蜡油获得A的过程中的中间产物之一,它的一氯代物同分异构体有种。写出其中含有三个甲基的有机物结构简式:。(5)、三名科学家因在有机合成的复分解反应研究方面做出重大贡献而获得诺贝尔化学奖。一种利用该类型反应生产乙烯的合成路线如下图所示。
①步骤Ⅰ~Ⅳ中属于加成反应的是(填序号)
②写出上述合成路线的总反应方程式:。
五、工业流程题
-
19. 为治理雾霾天气,可采用多种方法实现工业废气脱硫。(1)、
Ⅰ.软锰矿浆(主要成分 , 含有少量铁、铝等氧化物)可脱除燃煤烟气中的 , 又可制得电池材料。主要流程如图:
提高烟气吸收效率的可行措施有(写出两点)。 (2)、写出“沉锰”步骤发生反应的离子方程式:。(3)、现将该烟气以的流量通入到装有的溶液的装置中,后,恰好完全反应。计算该烟气中含量:。(4)、II.活性是一种固体脱硫剂(无水无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性脱除沼气中的可转化成。
(2)、写出“沉锰”步骤发生反应的离子方程式:。(3)、现将该烟气以的流量通入到装有的溶液的装置中,后,恰好完全反应。计算该烟气中含量:。(4)、II.活性是一种固体脱硫剂(无水无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性脱除沼气中的可转化成。
“脱除沼气中”反应的化学方程式为。(5)、工业上要求脱除过程温度不能超过 , 原因是。(6)、Ⅲ.有人设想利用电化学原理除去 , 并将化学能转化为电能。装置图如下。
电池的正极是。(填“a”或“b”)(7)、写出a电极的电极反应。
-
-
-