福建省厦门市2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、单选题
-
1. 福建土楼的外墙是用糯米,石灰、黏土和细砂混合而成。夯筑时,往墙体中间埋入竹片作为“墙骨”。下列说法错误的是( )A、糯米的主要成分是淀粉,其作用是充当粘合剂 B、石灰的主要成分是CaSO4 , 其作用是防水 C、细砂的主要成分是SiO2 , 其作用是增大墙体的强度 D、“墙骨”的主要成分是纤维素,其作用是增加墙体的韧性2. 甲酸和乙醇在浓硫酸作用下反应生成甲酸乙酯,该反应中各物质的化学用语或模型错误的是( )A、甲酸的结构式为:
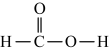 B、乙醇的球棍模型:
B、乙醇的球棍模型: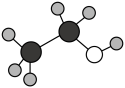 C、甲酸乙酯的结构简式:CH3COOCH3
D、H2O的电子式:
C、甲酸乙酯的结构简式:CH3COOCH3
D、H2O的电子式: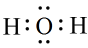 3. 下列有关元素周期律的说法正确的是( )A、热稳定性:HCl>H2S>PH3 B、离子半径:O2->Al3+>Na+ C、元素原子失电子能力:Be>K>Mg D、酸性:HNO3>H2SiO3>H2CO34. 用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分如图所示。下列说法正确的是( )
3. 下列有关元素周期律的说法正确的是( )A、热稳定性:HCl>H2S>PH3 B、离子半径:O2->Al3+>Na+ C、元素原子失电子能力:Be>K>Mg D、酸性:HNO3>H2SiO3>H2CO34. 用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分如图所示。下列说法正确的是( )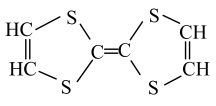 A、该有机物属于烯烃 B、四个硫原子一定共平面 C、1mol该有机物可与2mol氢气加成 D、一氯代物有2种5. 下列实验能达到目的的是( )
A、该有机物属于烯烃 B、四个硫原子一定共平面 C、1mol该有机物可与2mol氢气加成 D、一氯代物有2种5. 下列实验能达到目的的是( )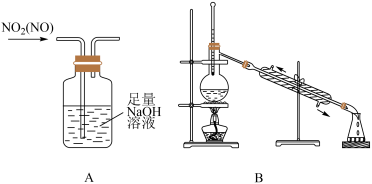
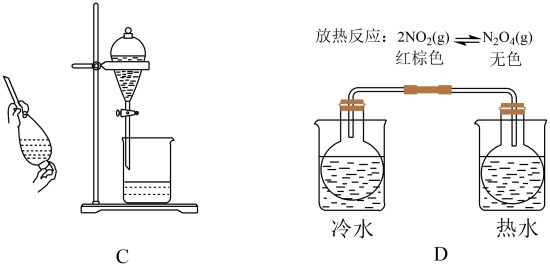 A、图A是除去NO2中的NO B、图B是米酒蒸馏 C、图C是乙醇萃取碘水中的碘 D、图D是探究温度对平衡状态的影响6. 利用CO2 , H2 , C2H2和CH3OH生产丁二酸二甲酯,其过程如图所示,下列说法错误的是( )
A、图A是除去NO2中的NO B、图B是米酒蒸馏 C、图C是乙醇萃取碘水中的碘 D、图D是探究温度对平衡状态的影响6. 利用CO2 , H2 , C2H2和CH3OH生产丁二酸二甲酯,其过程如图所示,下列说法错误的是( )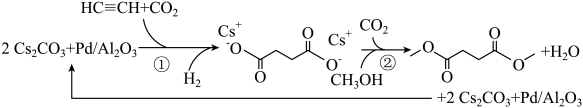 A、C2H2分子中碳碳三键和碳氢键之间的夹角为180° B、丁二酸二甲酯的分子式为C6H10O4 C、过程①未涉及碳氢键的断裂 D、过程②实现了Cs2CO3的再生7. 恒温恒容下,进行反应: , 下列说法不能说明该反应已达到化学平衡状态的是( )A、生成N2的速率与消耗H2的速率相等 B、容器内压强不再改变 C、反应混合物中N2、H2、NH3的百分组成不再改变 D、单位时间内,断裂3mol H-H键的同时断裂6mol N-H键8. 我国科学家设计了一款高能量密度新型电池,装置如图所示。下列说法错误的是( )
A、C2H2分子中碳碳三键和碳氢键之间的夹角为180° B、丁二酸二甲酯的分子式为C6H10O4 C、过程①未涉及碳氢键的断裂 D、过程②实现了Cs2CO3的再生7. 恒温恒容下,进行反应: , 下列说法不能说明该反应已达到化学平衡状态的是( )A、生成N2的速率与消耗H2的速率相等 B、容器内压强不再改变 C、反应混合物中N2、H2、NH3的百分组成不再改变 D、单位时间内,断裂3mol H-H键的同时断裂6mol N-H键8. 我国科学家设计了一款高能量密度新型电池,装置如图所示。下列说法错误的是( )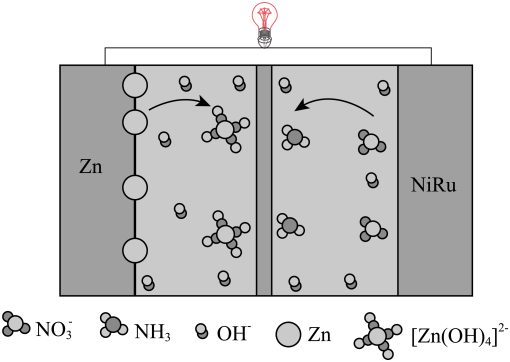 A、NiRu为正极 B、Zn电极的电极反应式为: C、工作时,电解质溶液中的OH-向Zn电极移动 D、理论上生成11.2L(标准状况)NH3时,外电路转移电子数目为8NA9. 我国科学家研发了高效催化转化为NH3的路径,如图所示,下列说法错误的是( )
A、NiRu为正极 B、Zn电极的电极反应式为: C、工作时,电解质溶液中的OH-向Zn电极移动 D、理论上生成11.2L(标准状况)NH3时,外电路转移电子数目为8NA9. 我国科学家研发了高效催化转化为NH3的路径,如图所示,下列说法错误的是( )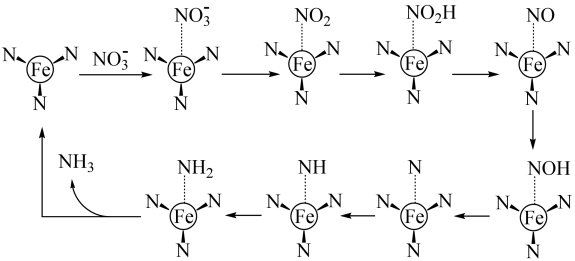 A、FeN3是催化剂 B、该路径中N元素化合价逐步降低 C、用15N标记 , 反应结束后会在FeN3中检测出15N D、该路径的总反应式为:10. W、X、Y、Z是原子序数依次增大的短周期元素,其中只有Y和Z同周期。由上述元素组成的物质甲~已转化关系如图。其中,乙为气体,丁为有机混合物,已为淡黄色固体。下列说法正确的是( )
A、FeN3是催化剂 B、该路径中N元素化合价逐步降低 C、用15N标记 , 反应结束后会在FeN3中检测出15N D、该路径的总反应式为:10. W、X、Y、Z是原子序数依次增大的短周期元素,其中只有Y和Z同周期。由上述元素组成的物质甲~已转化关系如图。其中,乙为气体,丁为有机混合物,已为淡黄色固体。下列说法正确的是( )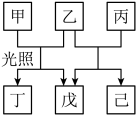 A、元素原子得电子能力:Z>W>Y>X B、甲一定属于烃类 C、氧化性:乙<己 D、X与Z可形成含非极性键的化合物
A、元素原子得电子能力:Z>W>Y>X B、甲一定属于烃类 C、氧化性:乙<己 D、X与Z可形成含非极性键的化合物二、填空题
-
11. 微生物构成的氮的循环如图所示。
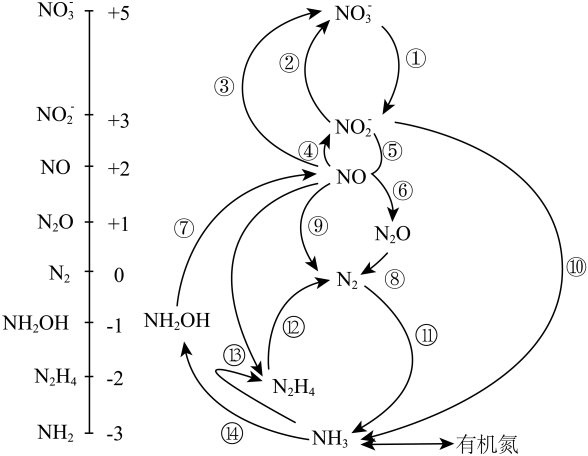 (1)、NH3的电子式为 , 与N同周期的非金属元素的气态氢化物稳定性最强的为。(2)、实验室制备NH3的化学方程式为。检验NH3是否收集满的方法为。(3)、过程⑬的化学方程式为。反应中若将H替换成D(氘),当生成20gD2O时,产物中含有的N-D键的数目为NA。(4)、羟胺(NH2OH)的结构式为 , 其与H2O2反应可实现⑦的转化,化学方程式为 , 为提高反应速率可适当升高温度,但温度过高该反应速率反而降低的原因是。12. 木质素中的对乙基苯酚转化为苯酚与乙烯的过程如下:
(1)、NH3的电子式为 , 与N同周期的非金属元素的气态氢化物稳定性最强的为。(2)、实验室制备NH3的化学方程式为。检验NH3是否收集满的方法为。(3)、过程⑬的化学方程式为。反应中若将H替换成D(氘),当生成20gD2O时,产物中含有的N-D键的数目为NA。(4)、羟胺(NH2OH)的结构式为 , 其与H2O2反应可实现⑦的转化,化学方程式为 , 为提高反应速率可适当升高温度,但温度过高该反应速率反而降低的原因是。12. 木质素中的对乙基苯酚转化为苯酚与乙烯的过程如下: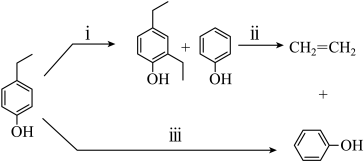 (1)、可用溴水鉴别气体产物是C2H4还是C2H6 , 化学方程式为 , 反应类型为。(2)、
(1)、可用溴水鉴别气体产物是C2H4还是C2H6 , 化学方程式为 , 反应类型为。(2)、 中苯环上的一氯代物有种。
中苯环上的一氯代物有种。 中最多个原子共平面。 (3)、反应iii能量变化如下图所示,该反应为反应(填“吸热”或“放热”),反应过程中能量的转换值为。
中最多个原子共平面。 (3)、反应iii能量变化如下图所示,该反应为反应(填“吸热”或“放热”),反应过程中能量的转换值为。 (4)、对乙基苯酚经过系列转化会生成对羟基苯甲酸。
(4)、对乙基苯酚经过系列转化会生成对羟基苯甲酸。
①可用(填试剂名称)检验物质b中的醛基。
②0.2mol c和足量的钠反应可生成LH2(标准状况)。
(5)、以乙烯为原料经过系列反应可得聚四氟乙烯。使用液态磷酸(磷酸包含在聚四氟乙烯键合的碳化硅基质中)作为电解质的氢氧燃料电池如图所示:
①利用四氟乙烯合成聚四氟乙烯的化学方程式为。
②b极的电极反应式为。
③若反应生成18gH2O,理论上外电路转移的电子的数目是。
三、实验题
-
13. 某实验小组利用下图装置探究H2C2O4溶液与酸性KMnO4溶液的反应(夹持装置略去)。
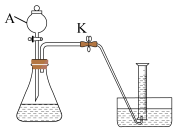
查阅资料:①H2C2O4为二元弱酸。
②溶液浓度越大,越不利于气体的扩散。
(1)、H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为。(2)、仪器A的名称为。(3)、检查装置气密性的方法为。(4)、若以单位时间内生成的气体体积作为反应速率的观测指标,则量筒中的试剂为____。A、饱和NaHCO3溶液 B、饱和NaCl溶液 C、水 D、饱和Na2CO3溶液(5)、探究H2C2O4溶液与酸性KMnO4溶液的浓度对反应速率的影响,实验数据如下表所示:实验
序号
KMnO4溶液
H2C2O4溶液
H2SO4溶液
褪色时间
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
t/s
1
0.005
4.0
0.2
2.0
0.120
307
2
0.020
4.0
0.2
2.0
0.120
545
3
0.010
4.0
0.5
2.0
0.120
201
4
0.010
4.0
0.7
2.0
0.120
163
5
0.010
4.0
0.9
2.0
0.120
360
6
0.010
4.0
1.0
2.0
c1
512
①c1=。
②某同学从实验1和2的褪色时间分析出实验2的反应速率小于实验1,请分析该结论是否正确,并说明原因:。
③结合实验数据,下列说法错误的是。(填标号)
A.其他条件不变时,c(H2C2O4)浓度越高,反应速率越快
B.其他条件不变时,当c(H2C2O4)为0.8mol·L-1 , 褪色时间一定介于163s至360s之间
C.实验5中v(H2C2O4)=0.15mol·L-1·min-1
D.其他条件不变时,当c(H2C2O4)>0.9mol·L-1 , 溶液浓度增大,不利于CO2扩散,可能导致褪色时间延长
(6)、H2C2O4溶液与酸性KMnO4溶液生成的Mn2+对该反应有催化作用。请以实验1为对照组,设计实验方案证明Mn2+的催化作用。四、工业流程题
-
14. 从分银渣(含Sb2S3、SnO2以及铅等杂质)中分离提取Na2SbO4和CaSnO3流程如图所示:
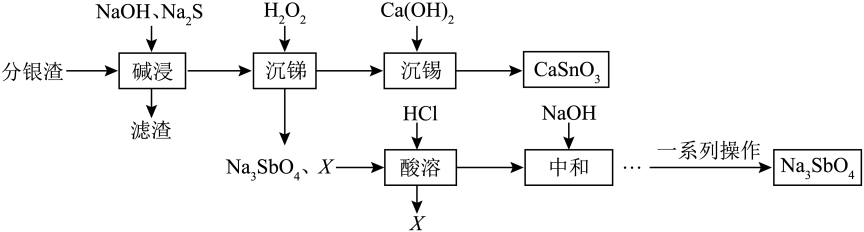
查阅资料:①Sn和C属于同主族元素,Sb和N属于同主族元素。
②“碱浸”中Sb元素发生反应的离子方程式为:、
(1)、Sn原子的质子数为50,其原子结构示意图为。(2)、“碱浸”中,可采取的方法提高浸取速率,其中,SnO2与NaOH反应的离子方程式为。(3)、“沉锑”中,X为。(4)、“沉锑”中,金属沉淀率与H2O2质量浓度关系如下图所示。为分离Sb元素和Sn元素,需控制H2O2质量浓度为 , 原因是 , 该过程Na3SbS3转化为Na2SbO4的离子方程式为。 (5)、“一系列操作”为。(6)、用1t分银渣(含Sb元素质量分数6.1%)制得51kgNa3SbO4 , 则Na3SbO4的产率为。(7)、该流程中,可循环利用的物质是(填化学式)。
(5)、“一系列操作”为。(6)、用1t分银渣(含Sb元素质量分数6.1%)制得51kgNa3SbO4 , 则Na3SbO4的产率为。(7)、该流程中,可循环利用的物质是(填化学式)。
-