上海市浦东新区2022年教学质量自主调研化学三模试卷
试卷更新日期:2023-10-07 类型:中考模拟
一、选择题
-
1. 元素符号正确的是( )A、mg B、SI C、Hg D、cU2. 在氧气中燃烧,产生蓝紫色火焰的是( )A、氢气 B、红磷 C、铁丝 D、硫3. 节日烟花的火焰呈紫色时,烟花中可能含有的物质是( )A、K2SO4 B、Ca(NO3)2 C、Cu D、Na2SO44. 关于硫酸铜的描述中,错误的是( )A、类别:盐 B、俗称:胆矾 C、式量:160 D、用途:检验水5. 下列物质溶于水,所得溶液显酸性的是( )A、CO2 B、KCl C、Na2SO4 D、Na2CO36. 含氮量最高的氮肥是( )A、NH4HCO3 B、NH4Cl C、CO(NH2)2 D、(NH4)2SO47. 气球遇热膨胀的微观解释是( )A、分子质量增大 B、分子个数增多 C、分子体积增大 D、分子间隔增大8. 下列说法合理的是( )A、干冰和冰是同种物质 B、CO和H2是可燃性气体 C、NH4NO3中N元素的化合价相同 D、SO2、CO2是空气污染物9. 与金刚石互为同素异形体的是( )A、活性炭 B、木炭 C、C60 D、铅笔芯10. 能鉴别稀硫酸和稀盐酸的试剂是( )A、硝酸钡溶液 B、硝酸银溶液 C、石蕊试液 D、铁锈11. 有关置换反应的说法,正确的是( )A、有金属单质生成 B、有化合物生成 C、反应都在常温下进行 D、反应物的化合价都会改变12. 实验设计不合理的是( )A、探究可燃物燃烧的条件
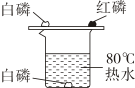 B、探究Fe、Cu、Ag 的活动性
B、探究Fe、Cu、Ag 的活动性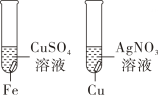 C、鉴别CO2和CO
C、鉴别CO2和CO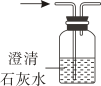 D、验证质量守恒定律
D、验证质量守恒定律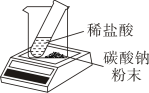 13. 干垃圾焚烧前一般需要粉碎处理,粉碎的目的是( )A、缓解温室效应 B、使可燃物分子变小 C、使其充分燃烧 D、减少参加反应的氧气量14. 向盛有铜和氧化铜的烧杯中滴加稀盐酸,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法错误的是( )
13. 干垃圾焚烧前一般需要粉碎处理,粉碎的目的是( )A、缓解温室效应 B、使可燃物分子变小 C、使其充分燃烧 D、减少参加反应的氧气量14. 向盛有铜和氧化铜的烧杯中滴加稀盐酸,反应过程中剩余固体的质量与加入稀盐酸的质量关系如图所示。下列说法错误的是( )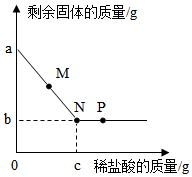 A、M点时,溶液中的溶质是CuCl2 B、N点时,剩余固体是铜 C、P点时,溶液的pH<7 D、混合物中铜的质量为(a-b)g15. 叙述正确的是( )A、分子可以构成物质,所以物质一定都是由分子构成的 B、单质只含有一种元素,所以含一种元素的纯净物都是单质 C、碱的溶液呈碱性,所以呈碱性的溶液一定是碱的溶液 D、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小16. 常温下,某反应:M+酸→N+盐,其中M、N的物质类别可能是( )A、盐、碱 B、碱、酸 C、单质、单质 D、氧化物、氧化物17. 某固体粉末可能含有碳酸钙、氧化铜、氧化铁、木炭粉中的几种,取该固体粉末按下列流程进行实验(各步均完全反应)。下列推断正确的是( )
A、M点时,溶液中的溶质是CuCl2 B、N点时,剩余固体是铜 C、P点时,溶液的pH<7 D、混合物中铜的质量为(a-b)g15. 叙述正确的是( )A、分子可以构成物质,所以物质一定都是由分子构成的 B、单质只含有一种元素,所以含一种元素的纯净物都是单质 C、碱的溶液呈碱性,所以呈碱性的溶液一定是碱的溶液 D、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小16. 常温下,某反应:M+酸→N+盐,其中M、N的物质类别可能是( )A、盐、碱 B、碱、酸 C、单质、单质 D、氧化物、氧化物17. 某固体粉末可能含有碳酸钙、氧化铜、氧化铁、木炭粉中的几种,取该固体粉末按下列流程进行实验(各步均完全反应)。下列推断正确的是( )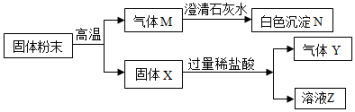 A、固体X可能是混合物 B、溶液Z中只含一种溶质 C、气体M和气体Y都是二氧化碳 D、原固体粉末中没有氧化铜
A、固体X可能是混合物 B、溶液Z中只含一种溶质 C、气体M和气体Y都是二氧化碳 D、原固体粉末中没有氧化铜二、简答题
-
18. 根据所学化学知识回答下列问题。
①实验室用过氧化氢溶液和二氧化锰制取氧气,二氧化锰的作用是 , 其中锰元素以 (选填“游离”或“化合”)态存在,制取氧气的化学方程式是。
②自来水厂净水过程中除去色素和异味用到活性炭,主要利用其性。
③“中国芯”彰显中国“智”造。芯片的基材主要是高纯硅,工业上利用三氯硅烷(HSiCl3)制取高纯硅。三氯硅烷含有种元素,1mol HSiCl3中约含个氯原子。
④某工业品盐酸的溶质质量分数为37%。“37%”的含义是;要配制100g 7.4%的稀盐酸,需要37%的盐酸g。
19. 下表是KNO3在不同温度时的溶解度。温度(℃)
0
20
40
60
80
100
溶解度(g/100g水)
13.3
31.6
63.9
110
169
246
①20℃,KNO3的溶解度是。
②在一瓶含有KNO3固体的KNO3溶液,使KNO3固体完全溶解的方法是。(写出一种方法)
③将Xg KNO3固体投入盛有100g水的烧杯中,搅拌、加热,测不同温度下烧杯中溶液的质量,如图所示。
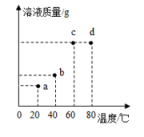
I.a点溶液的溶质质量分数(只需列比例式)。
II.溶液一定处于饱和状态的点是(填字母编号)。
III.b点时的溶液质量比a点时多g。
IV.X的取值范围是。
20. 某校兴趣小组同学利用图1装置研究稀盐酸与氢氧化钠溶液反应的过程,仪器A中溶液慢慢加入烧杯中溶液,用pH和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。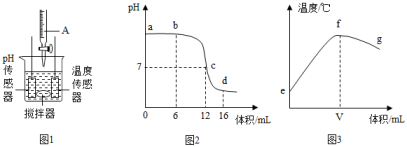
①图1烧杯中发生反应的化学方程式为。
②图1仪器A中物质是 , 判断的依据为。图3中V的数值最接近 (填“6”、“12”或“16”)。
③取图2中d 点所示溶液加热蒸干得固体为。图3中e→f变化趋势可说明。
④请利用图1实验结束后的溶液,设计一种方法也可验证稀盐酸与氢氧化钠溶液能发生反应。
21. 一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。①工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2 , 该反应的化学方程式为 , 得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
②某化学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气。根据①中所写的化学方程式,合成气中CO和H2的质量比为。
II.用合成气还原足量氧化铜.实验装置如下图所示:
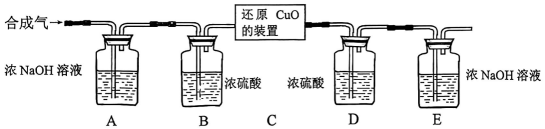
设计的实验步骤:
a.连接好装置并检查气密性。
b.装入药品,通入一段时间合成气。c.分别称量装置D、E的质量。
d.缓缓通入合成气,加热装置C,使其充分反应。e.停止加热,继续通入合成气至恢复到室温。
f.再次分别称量装置D、E的质量。
装置D的质量
装置E的质量
反应前
292.4g
198.2g
反应后
296.0g
201.5g
经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤(填实验步骤的序号)中点燃(点燃前应对气体验纯)。
③该小组的同学按上述步骤进行实验;并记录了实验现象和数据:装置C中出现的现象是。
称量数据如右表所示。
I.甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。写出任意一个化学方程式
。
II.乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中未反应的CH4 , 也可能还原了CuO。试通过计算说明他的推测依据。
III.丙同学提出,实验步骤e中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。你认为该误差对乙同学的推测结果是否有影响?并说明理由。