2023-2024 学年 浙教版科学九年级上册 2.2 金属的化学性质 同步练习
试卷更新日期:2023-10-07 类型:同步测试
一、选择题
-
1. 现有等质量的X、Y两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知X、Y在生成物中化合价均为+2价)。则下列说法中不正确的是( )
 A、反应结束后生成氢气的总质量:X>Y B、相对原子质量:X>Y C、两种金属的活动性:Y>X D、金属与酸反应生成的盐的质量:X>Y2. 把一些锌粉放入Fe(NO3)2和AgNO3的混合溶液中,完全反应后过滤,向滤渣中加入稀盐酸有气体产生,根据以上现象,得出正确结论是( )A、滤渣中一定有Zn、Fe、Ag B、滤渣中一定有Fe、Ag,可能有Zn C、滤渣中一定有Zn、Fe,可能有Ag D、滤渣中一定有Ag,可能有Zn、Fe3. ”类推”是学习科学过程中常用的思维方法。现有以下类推结果,其中错误的是( )
A、反应结束后生成氢气的总质量:X>Y B、相对原子质量:X>Y C、两种金属的活动性:Y>X D、金属与酸反应生成的盐的质量:X>Y2. 把一些锌粉放入Fe(NO3)2和AgNO3的混合溶液中,完全反应后过滤,向滤渣中加入稀盐酸有气体产生,根据以上现象,得出正确结论是( )A、滤渣中一定有Zn、Fe、Ag B、滤渣中一定有Fe、Ag,可能有Zn C、滤渣中一定有Zn、Fe,可能有Ag D、滤渣中一定有Ag,可能有Zn、Fe3. ”类推”是学习科学过程中常用的思维方法。现有以下类推结果,其中错误的是( )①酸碱中和反应生成盐和水,所以生成盐和水反应一定是中和反应
②氧化物中含有氧元素,所以含有氧元素的化合物一定是氧化物
③金属铝与盐酸反应生成AICl3和H2 , 所以金属铁与盐酸反应生成FeCl3和H2
④浓盐酸试剂瓶敞口久置后变稀且质量减轻,所以浓硫酸敞口久置也变稀且质量减轻
A、① B、①③ C、①②④ D、全部4. 科学家发明了一种车用制氢装置,其制氢气的原理是:硼(B)和水在高温下反应生成氢氧化硼和氢气。反应的化学方程式为:2B+6H2O=高温=2B(OH)2+3H2 , 该反应属于( )A、置换反应 B、分解反应 C、化合反应 D、复分解反应5. 取一定量的铁粉和硫粉均匀混合后放进试管中,用酒精灯加热,当试管中的光扩展到整支试管后立即停止加热,静置冷却,最终得到不能被磁铁吸引的黑色物质。下列分析错误的是( )A、铁从游离态变为化合态 B、反应后的生成物属于盐 C、此反应为吸热反应 D、此反应为化合反应6. ”证据理论”是科学学科核心素养的重要组成部分。下列推论合理的是( )A、化学变化常常伴随能量的变化,所以有能量变化的一定属于化学变化 B、Na2O,CaO均能与水反应生成碱,因此所有金属氧化物都能与水反应生成碱 C、活泼金属与酸反应生成氢气是置换反应,所以有单质气体生成的反应都是置换反应 D、合金的硬度一般比组成它们的纯金属更高,因此黄铜(铜锌合金)的硬度高于铜和锌7. 我国科研人员成功研制出一种纳米纤维可将二氧化碳转化成某种液体燃料,同时生成一种物质丁,丁是最常见的溶剂,其微观示意图如图所示,下列说法正确的是( ) A、该反应属于置换反应 B、参加反应的甲与乙分子个数比为3:1 C、四种物质中乙、丙是有机物 D、丙属于氧化物8. 下列实验方案不能达到实验目的的是( )
A、该反应属于置换反应 B、参加反应的甲与乙分子个数比为3:1 C、四种物质中乙、丙是有机物 D、丙属于氧化物8. 下列实验方案不能达到实验目的的是( )实验目的
实验方案
A
验证溶液中是否有银离子
取样先加入氯化钡溶液再加入稀硝酸
B
鉴别NaOH溶液和Ca(OH)2溶液
分别滴入Na2CO3溶液,
C
防止铁制品生锈
喷漆等方法使它隔绝水和氧气
D
检验溶液中是否含有葡萄糖
用新制的氢氧化铜悬浊液混合受热,观察是否有砖红色沉淀产生
A、A B、B C、C D、D9. 硫化氢(H2S)俗称“臭蛋气”,可用于工业制取硫磺,化学方程式为2H2S+O2 2H2O+2S,该反应属于( )A、复分解反应 B、置换反应 C、分解反应 D、化合反应10. 模型能够直观反映化学变化的结果。将一定质量的镁条放入某一溶液(如图),其溶质硫酸锌和硫酸亚铁的质量相同,充分反应后烧杯内固体的组成和质量大小关系不可能的是( ) A、
A、 B、
B、 C、
C、 D、
D、
二、填空题
-
11. 向一定质量的Mg(NO3)2和Cu(NO3)2混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,发现质量仍为a克。(1)、请写出其中一个化学反应方程式 。(2)、反应后的滤液中一定含有的溶质是 。(3)、往反应后的滤渣中加稀盐酸,无气泡产生,则滤渣中一定含有的物质是 。12. 如图为甲、乙、丙、丁四种物质转化关系图。
 (1)、若甲、丁均为单质,则该反应最有可能属于 反应(填基本反应类型)(2)、如果丁是水,写出一个符合该转化关系的化学方程式 。13. 下图所示实验可用于研究金属的性质。
(1)、若甲、丁均为单质,则该反应最有可能属于 反应(填基本反应类型)(2)、如果丁是水,写出一个符合该转化关系的化学方程式 。13. 下图所示实验可用于研究金属的性质。铁丝
铜丝
铁丝
铜丝
稀硫酸
-稀硫酸
硫酸铜溶液
硝酸银溶液
①
②
③
④
(1)、①中有气体生成,生成的气体为(2)、下列实验组合中,能得出铁、铜、银的金属活动性顺序的是 。(填序号)A、①④ B、③④ C、①②④14. 社会发展让人们的出行更加方便,汽车逐渐走进寻常百姓家。回答有关问题: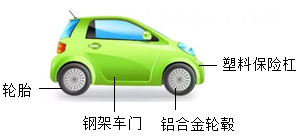 (1)、如图汽车的部件中主要由有机合成材料制成的是。(2)、汽车表面的烤漆不仅美观,还能起到的作用。(3)、化石燃料的大量使用,带来了环境的污染和资源的枯竭等问题。我市自2018年开始推广使用车用乙醇汽油,到2019年实现全市全覆盖。乙醇(C2H5OH)燃烧的化学方程式是。(4)、在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是。(填一种即可)15. 科学就在我们身边,(1)、农业上可用来改良酸性土壤的是(用化学式表示);(2)、测定番茄汁的酸碱度可选用的是 。A、酚酞试液 B、氨水 C、pH试纸 D、石蕊试液(3)、街边的垃圾箱随处可见,它的材质部分材料是不锈钢属于(填合成或金属材料)。不锈钢主要通过方法来进行防锈。
(1)、如图汽车的部件中主要由有机合成材料制成的是。(2)、汽车表面的烤漆不仅美观,还能起到的作用。(3)、化石燃料的大量使用,带来了环境的污染和资源的枯竭等问题。我市自2018年开始推广使用车用乙醇汽油,到2019年实现全市全覆盖。乙醇(C2H5OH)燃烧的化学方程式是。(4)、在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是。(填一种即可)15. 科学就在我们身边,(1)、农业上可用来改良酸性土壤的是(用化学式表示);(2)、测定番茄汁的酸碱度可选用的是 。A、酚酞试液 B、氨水 C、pH试纸 D、石蕊试液(3)、街边的垃圾箱随处可见,它的材质部分材料是不锈钢属于(填合成或金属材料)。不锈钢主要通过方法来进行防锈。三、实验探究题
-
16. 科学兴趣小组采用不同方案对金属活动性的强弱进行了研究。
甲同学:将铜丝放入硝酸银溶液中,观察现象。
乙同学:把铁制容器和铝制容器放在同一潮湿环境中,一段时间后观察容器表面的锈蚀情况。实验后,同学们进行汇报和评价交流。
(1)、甲同学根据的实验现象,得出金属铜的活动性比银强。(2)、乙同学观察到铁制容器表面有明显的锈蚀现象,而铝制容器表面无明显变化。据此他得出铁的活动性比铝强的结论。小组讨论后一致认为乙同学的方案设计不合理,他们的理由是:铝制容器表面无明显变化是因为导致容器中的铝无法与氧气接触发生反应,因此不能用此方法比较铁与铝的活动性强弱。17. 为探究锌、铁、铜、银的四种金属的活动性顺序,小科设计了如图所示的实验。 (1)、运用控制变量法设计实验方案是科学研究的重要方法。在A、B、C三个实验中,需要控制的实验条件除了金属与稀硫酸的接触面积、稀硫酸的体积、温度以外还需要控制的条件是 。(2)、你认为从中选择四个实验即可验证锌、铁、铜、银的金属活动性顺序。这四个实验的组合是。18. 镁条放置在空气中一段时间,表面会形成一层黑色物质。小科查得以下资料:
(1)、运用控制变量法设计实验方案是科学研究的重要方法。在A、B、C三个实验中,需要控制的实验条件除了金属与稀硫酸的接触面积、稀硫酸的体积、温度以外还需要控制的条件是 。(2)、你认为从中选择四个实验即可验证锌、铁、铜、银的金属活动性顺序。这四个实验的组合是。18. 镁条放置在空气中一段时间,表面会形成一层黑色物质。小科查得以下资料:I.常温下,空气中的氮气和稀有气体不会与镁发生反应。
II.无水CaCl2固体有较强的吸水性,能吸收空气中的水蒸气。
为探究镁表面黑色物质的成因是与空气中的哪些成分有关,他开展如图实验进行探究。

数日后第①组镁条表面出现黑色物质,第②、③组只观察到镁条表面变暗,并没有出现黑色物质。
(1)、对比第①、②两组实验,可以得出“镁条变黑一定与 有关”的结论。(2)、对比第 两组实验,可以得出镁条变黑还需要空气中二氧化碳气体的参与。(3)、小科通过查阅资料发现:镁条表面变黑,实质是镁与空气中的水、氧气、二氧化碳发生了反应。为了使实验结论更加严谨,还应该补做第④组实验,且观察到镁条表面无明显变化才能得出结论,则第④组实验“?”处应填写 。四、解答题
-
19. 硫酸盐的结晶水合物通常称为”矾”,我国多部古籍都有记载。(1)、东汉《神农本草经》记载,胆矾能”化铁为铜”。胆矾的化学式为CuSO4·5H2O,胆矾受热失去结晶水的过程属于(选填”物理”或”化学”)变化;将铁片浸入硫酸铜溶液可实现”化铁为铜”,反应的化学方程是 , 说明铁的金属活动性比铜(选填”强”或”弱”)。(2)、唐代《千金翼方》记载,明矾可入药用。明矾的化学式为KAI(SO4)2·12H2O,其中含有种金属元素。(3)、明代《天工开物》记载,绿矾可用黄铁矿为原料制得。绿矾的化学式为FeSO4·7H2O。FeSO4·7H2O属于(选填”纯净物”或”混合物;20. 黄铜是由铜和锌组成的合金,常被用于制造阀门、水管、空调内外机连接管和散热器等。当黄铜的含锌量不同时,其性能不同,见下表。小实同学用足量的稀硫酸对10克某铜锌合金样品进行科学探究,有关数据见下图。
含锌量
性能及用途
≤35%
塑性好,适于冷热加压加工
36%~46%
塑性减小而抗拉强度上升,只适于热压力加工
>46%
抗拉强度下降,无使用价值

请回答以下问题:
(1)、图中M的值为克。(2)、AB和BC不在同一直线上的原因是。(3)、求这块合金样品中所含锌的质量分数。21. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。 (1)、小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是。(2)、在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是。(3)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。22. 铝在空气中久置会慢慢失去光泽,将足量久置在空气中的铝片放入一定量的稀硫酸中, 其放出氢气质量与时间的关系如图所示 (反应时温度变化忽略不计)。查资料得知:
(1)、小柯用放置很久的铝箔与稀盐酸反应,产生氢气质量和反应时间关系如图所示。在0~t1时间段内,铝箔表面看不到明显的气泡,原因是。(2)、在t2~t3时间段产生气泡的速度逐渐放缓,直到反应停止时,铝箔还有大量剩余。t2~t3时间段产生气泡速度放缓的原因是。(3)、为进一步测量铝箔中单质铝的质量分数,小柯取1.9克铝箔样品与50.0克稀盐酸充分反应(2Al+6HCl=2AlCl3+3H2↑),铝箔完全溶解后剩余溶液的总质量为51.7克。计算样品中单质铝的质量分数。22. 铝在空气中久置会慢慢失去光泽,将足量久置在空气中的铝片放入一定量的稀硫酸中, 其放出氢气质量与时间的关系如图所示 (反应时温度变化忽略不计)。查资料得知:①其他条件相同时,反应物接触面积越大,反应物的浓度越高,反应速度越快;
②反应速率越快,相同时间内生成物的质量越大。请根据上述资料和所学知识解释0-t4各时间段内氢气的质量变化情况。
 23. 暖宝宝又叫暖贴,在寒冷的冬季外出时,贴于肩部、腹部或关节部位,对防止冻伤驱寒有很好的效果。它不用火、电、水或其他能源,撕开外袋即可发热,并可保持8-18小时左右(平均温度52℃)。
23. 暖宝宝又叫暖贴,在寒冷的冬季外出时,贴于肩部、腹部或关节部位,对防止冻伤驱寒有很好的效果。它不用火、电、水或其他能源,撕开外袋即可发热,并可保持8-18小时左右(平均温度52℃)。
资料一:暖宝宝使用双层包装。外层是常规不透气外袋,内层是由微孔透气膜制成的无纺布袋,里面装有发热材料。
资料二:暖宝宝发热材料主要是铁粉、活性炭、蛭石、水、食盐等。蛭石薄膜状,是当今世界首屈一指的超级保温材料。活性炭有强吸附性,它的疏松结构中储有水蒸气。
资料三:日常生活中,铁质物品在盐溶液中更容易生锈。
注意事项:⒈暖宝宝须妥善保存,避免外袋破损。
⒉不可将暖宝宝直接贴于皮肤表面。
综合上述信息并运用所学知识,解释暖宝宝发热的工作原理,及注意事项。