山西省吕梁市2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-09-27 类型:期末考试
一、选择题(本题共18个小题,每小题3分,共54分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
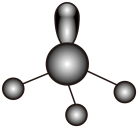
1. 《凉州词》中写道“葡萄美酒夜光杯,欲饮琵琶马上催”。夜光杯的主要成分为 , 古代制作琵琶的主要原料为木料或竹料、丝线等,下列说法不正确的是( )A、美酒酿制过程中有气体产生 B、夜光杯的主要成分属于氧化物 C、木料或竹料的主要成分为纤维素 D、由蚕丝搓纺而成的丝线的主要成分为蛋白质2. 下列化学用语表示正确的是( )A、的VSEPR模型:
 B、葡萄糖的结构简式:
C、乙酸乙酯的实验式:
D、
B、葡萄糖的结构简式:
C、乙酸乙酯的实验式:
D、 的名称为2,4,4-三甲基戊烷
3. 设为阿佛伽德罗常数的值,下列说法正确的是( )A、(无机苯)的结构与苯相似,1 mol无机苯中键数目为 B、1 mol配合物中键数目为 C、100 g 46%的乙醇溶液中,含键的数目为 D、78 g苯和苯乙烯()的混合物中,含有的碳氢键数为4. 下列关于有机物说法正确的是( )
的名称为2,4,4-三甲基戊烷
3. 设为阿佛伽德罗常数的值,下列说法正确的是( )A、(无机苯)的结构与苯相似,1 mol无机苯中键数目为 B、1 mol配合物中键数目为 C、100 g 46%的乙醇溶液中,含键的数目为 D、78 g苯和苯乙烯()的混合物中,含有的碳氢键数为4. 下列关于有机物说法正确的是( )①酯在碱性条件下的水解反应称为皂化反应
②核酸检测是确认病毒类型
 有效手段,核酸属于天然高分子化合物
有效手段,核酸属于天然高分子化合物③油脂水解可得到氨基酸和甘油
④纤维素和淀粉都是多糖,二者互为同分异构体
⑤溴乙烷、酰胺和蛋白质在一定条件都能水解
⑥过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
A、①②③ B、②⑤ C、⑤⑥ D、④⑤5. 配离子球棍模型如下图所示。下列关于该配离子的说法中不正确的是( )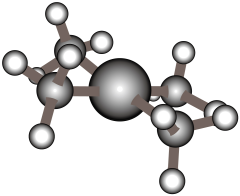 A、配位数为4 B、中的采用杂化 C、配体是 , 的空间构型为三角锥形 D、若用代替与形成配位键,则配位键的强度将减弱6. 下列比较正确的是( )A、键长由小到大:金刚石<碳化硅<硅 B、熔点由低到高:二氧化碳<氧化镁<氯化钠 C、硬度由大到小:C60>铁>氯化钠 D、共价键的极性由强到弱:7. 可用于制造火柴,其分子结构如图所示。下列说法不正确的是( )
A、配位数为4 B、中的采用杂化 C、配体是 , 的空间构型为三角锥形 D、若用代替与形成配位键,则配位键的强度将减弱6. 下列比较正确的是( )A、键长由小到大:金刚石<碳化硅<硅 B、熔点由低到高:二氧化碳<氧化镁<氯化钠 C、硬度由大到小:C60>铁>氯化钠 D、共价键的极性由强到弱:7. 可用于制造火柴,其分子结构如图所示。下列说法不正确的是( )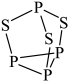 A、S元素的电负性大于P元素 B、的键角小于 C、1 mol 分子中孤电子对的数目为 D、该分子结构中S、P最外层电子数均达到8电子稳定结构8. 下列说法正确的是( )A、根据“相似相溶”原理,能溶于水,不溶于 B、邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 C、水加热到很高的温度都难以分解是因为水分子间存在氢键 D、烷基是推电子基团,所以甲酸、乙酸、丙酸的酸性逐渐增强9. 下列实验装置能达到相应实验目的的是( )
A、S元素的电负性大于P元素 B、的键角小于 C、1 mol 分子中孤电子对的数目为 D、该分子结构中S、P最外层电子数均达到8电子稳定结构8. 下列说法正确的是( )A、根据“相似相溶”原理,能溶于水,不溶于 B、邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点高 C、水加热到很高的温度都难以分解是因为水分子间存在氢键 D、烷基是推电子基团,所以甲酸、乙酸、丙酸的酸性逐渐增强9. 下列实验装置能达到相应实验目的的是( ) A、图1证明乙炔可使溴水褪色 B、图2制备硝基苯 C、图3证明溴乙烷与NaOH醇溶液共热生成了乙烯 D、图4制备乙烯10. Tf2O在医药领域有广泛的应用前景,其结构如图所示,其中W、X、Y、Z为原子半径依次增大的短周期非金属元素,W位于元素周期表的p区。下列说法不正确的是( )
A、图1证明乙炔可使溴水褪色 B、图2制备硝基苯 C、图3证明溴乙烷与NaOH醇溶液共热生成了乙烯 D、图4制备乙烯10. Tf2O在医药领域有广泛的应用前景,其结构如图所示,其中W、X、Y、Z为原子半径依次增大的短周期非金属元素,W位于元素周期表的p区。下列说法不正确的是( )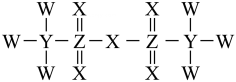 A、沸点: B、基态原子未成对电子数: C、中元素的化合价为价 D、Y形成的氢化物可能既含极性键,又含非极性键11. 国家一类抗癌新药乙烷硒啉(Ethaselen)进入临床研究,其结构如图。下列说法正确的是( )
A、沸点: B、基态原子未成对电子数: C、中元素的化合价为价 D、Y形成的氢化物可能既含极性键,又含非极性键11. 国家一类抗癌新药乙烷硒啉(Ethaselen)进入临床研究,其结构如图。下列说法正确的是( )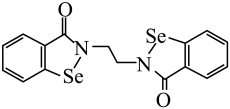 A、基态Se原子的价层电子排布式为 B、分子所含元素中第一电离能最大的为O C、分子中的碳原子都采取杂化 D、分子中有8种不同化学环境的碳原子12. 药物“达芦那韦”可用于治疗HIV感染,合成“达芦那韦”的部分路线如图所示,下列说法不正确的是( )
A、基态Se原子的价层电子排布式为 B、分子所含元素中第一电离能最大的为O C、分子中的碳原子都采取杂化 D、分子中有8种不同化学环境的碳原子12. 药物“达芦那韦”可用于治疗HIV感染,合成“达芦那韦”的部分路线如图所示,下列说法不正确的是( ) A、A分子中所有原子可能在同一平面 B、B的同分异构体有7种(含B且不考虑立体异构) C、C
A、A分子中所有原子可能在同一平面 B、B的同分异构体有7种(含B且不考虑立体异构) C、C 分子式为
D、反应②为还原反应
13. 下列实验操作能达到相应实验目的是( )
分子式为
D、反应②为还原反应
13. 下列实验操作能达到相应实验目的是( )实验目的
实验操作
A
检验淀粉已经完全水解
取少量水解液加适量氢氧化钠溶液使其呈碱性,加入银氨溶液混合加热,观察是否有有光亮的银镜生成
B
证明Y中是否含有醛基
向1 mL 1%的NaOH溶液中加入2 mL 2%的溶液,振荡后再加入0.5 mL有机物Y,加热,观察是否出现砖红色沉淀
C
除去苯中混有的少量苯酚
加入NaOH溶液,振荡,静置分层后,用分液漏斗可分离出苯
D
检验RX是溴代烷
将RX与NaOH水溶液共热,经充分反应后冷却,向冷却液中加溶液,观察沉淀颜色
A、A B、B C、C D、D14. 下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )A、属于酯类的有4种 B、属于羧酸类的有2种 C、存在分子中含有六元环的同分异构体 D、既含有羟基又含有醛基的有3种15. 利用如图所示的有机物X可生产Y。下列说法正确的是( )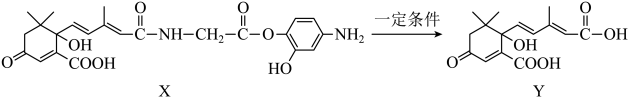 A、Y可以发生加聚反应、缩聚反应、取代反应、银镜反应 B、X既能与酸反应生成盐和水又能与碱反应生成盐和水 C、Y既可以与溶液发生显色反应,又可使酸性溶液褪色 D、1 mol X分别与足量的氢氧化钠溶液、氢气反应,消耗二者的物质的量之比为5∶716. 下图是活性炭中的含氧基团催化双氧水氧化苯制苯酚的反应历程,下列说法正确的是( )
A、Y可以发生加聚反应、缩聚反应、取代反应、银镜反应 B、X既能与酸反应生成盐和水又能与碱反应生成盐和水 C、Y既可以与溶液发生显色反应,又可使酸性溶液褪色 D、1 mol X分别与足量的氢氧化钠溶液、氢气反应,消耗二者的物质的量之比为5∶716. 下图是活性炭中的含氧基团催化双氧水氧化苯制苯酚的反应历程,下列说法正确的是( )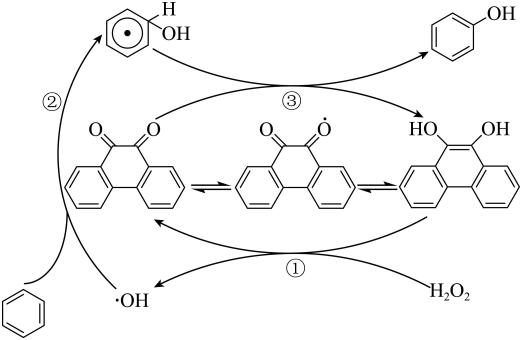 A、有7个 B、反应②中没有元素化合价变化 C、
A、有7个 B、反应②中没有元素化合价变化 C、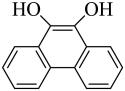 在反应过程中起催化作用
D、已知中的氧氧键比中的氧氧键的键长短,则氧化苯比容易
17. 有一种由简单单体聚合而成的高分子,结构片段如图所示,下列有关说法正确的是( )
在反应过程中起催化作用
D、已知中的氧氧键比中的氧氧键的键长短,则氧化苯比容易
17. 有一种由简单单体聚合而成的高分子,结构片段如图所示,下列有关说法正确的是( )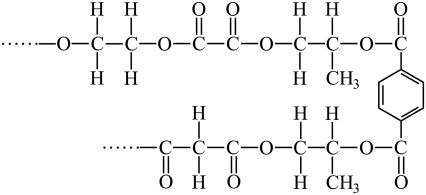 A、该高分子由4种单体缩聚而成 B、该高分子的几种羧酸单体互为同系物 C、该高分子的单体之一为乙二醇,乙二醇可被连续催化氧化生成单体之一的草酸 D、该高分子有固定熔、沸点,1 mol上述结构片段在NaOH溶液中完全水解,最多消耗5 mol NaOH18. 是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示。已知:B代表 , A的原子分数坐标为(0,0,0),摩尔质量为M g/mol,晶胞边长为a pm,为阿佛伽德罗常数的值。下列说法正确的是( )
A、该高分子由4种单体缩聚而成 B、该高分子的几种羧酸单体互为同系物 C、该高分子的单体之一为乙二醇,乙二醇可被连续催化氧化生成单体之一的草酸 D、该高分子有固定熔、沸点,1 mol上述结构片段在NaOH溶液中完全水解,最多消耗5 mol NaOH18. 是钙钛矿型太阳能电池的重要吸光材料,其晶胞结构如图所示。已知:B代表 , A的原子分数坐标为(0,0,0),摩尔质量为M g/mol,晶胞边长为a pm,为阿佛伽德罗常数的值。下列说法正确的是( )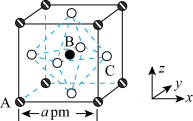 A、该晶体为共价晶体 B、的配位数为8 C、C的原子分数坐标为( , 1,) D、该晶体的密度为
A、该晶体为共价晶体 B、的配位数为8 C、C的原子分数坐标为( , 1,) D、该晶体的密度为二、非选择题
-
19. 完成下列问题(1)、基态的核外电子排布式。(2)、
 的系统命名法为 , (3)、苯酚钠溶液中通入少量二氧化碳反应的离子方程式。(4)、肉桂醛(
的系统命名法为 , (3)、苯酚钠溶液中通入少量二氧化碳反应的离子方程式。(4)、肉桂醛( )发生银镜反应的化学方程式。 20. 第Ⅷ族元素铁、钴、镍性质相似,称为铁系元素。单质及其化合物在生命科学、工业生产等领域有着重要的应用。回答下列问题。(1)、卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。
)发生银镜反应的化学方程式。 20. 第Ⅷ族元素铁、钴、镍性质相似,称为铁系元素。单质及其化合物在生命科学、工业生产等领域有着重要的应用。回答下列问题。(1)、卟吩分子中所有原子共平面,具有独特的电子结构,其结构如图1。血红素是由中心与配体卟吩衍生物结合成的大环配位化合物,其结构如图2。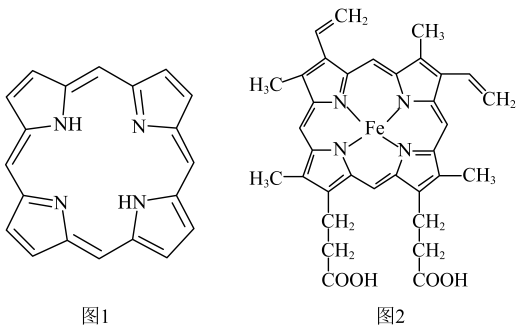
卟吩分子中N原子采取杂化,血红素中心离子的配位数为 , 血红素中含有的化学键有(填序号)。
a.离子键 b.共价键 c.氢键 d.配位键 e.金属键
(2)、某种半导体NiO具有NaCl型结构(如图),其晶胞参数为a pm。
①已知阿伏加德罗常数为 , 则NiO晶体的摩尔体积。(列出算式)
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,键中离子键成分的百分数小于键,原因是。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为;N所替代的O的位置可能是。
21. 对氨基苯磺酸是制备药物的重要中间体,可用苯胺( )、浓硫酸为原料合成。实验流程、装置示意图如下。
)、浓硫酸为原料合成。实验流程、装置示意图如下。 
相关数据如下表:
名称
相对分子质量
熔点/℃
沸点/℃
溶解性
苯胺
93
184
微溶于水,溶于乙醇、乙醚等有机溶剂
对氨基苯磺酸
173
288
——
微溶于冷水,溶于热水,不溶于乙醇、乙醚等有机溶剂
回答下列问题:
(1)、仪器A的名称。(2)、写出该反应的化学方程式。(3)、步骤1中加热方式是(填“水浴”、“油浴”或“直接加热”)。步骤1加入浓硫酸时,为防止温度过高致苯胺被氧化,可采取的措施有。(4)、下列有关说法正确是____A、反应产物中可能有邻氨基苯磺酸 B、冷凝管进出水方向是b进a出 C、如果加热后发现忘加沸石,应立刻补加 D、步骤2将混合液倒入盛有冷水烧杯中,用玻璃棒摩擦器壁可促使晶体析出(5)、对氨基苯磺酸粗产品因含杂质而显色,可用重结晶法进行提纯。从下列选项中选择合理操作并排序:()→()→()→()→过滤→洗涤→干燥。a.沸水溶解 b.过滤 c.趁热过滤 d.蒸发结晶 e.冷却结晶 f.加入活性炭
(6)、对氨基苯磺酸与对二甲氨基苯甲醛在一定条件下可以发生显色反应。利用这一原理,用分光光度法可以测定对氨基苯磺酸的含量,吸光度与对氨基苯磺酸浓度关系如图所示。
取1.00 g对氨基苯磺酸样品,配成1 L溶液,取样加入显色剂,测得吸光度为0.52。则样品中对氨基苯磺酸的质量分数是。
22. 化合物G是一种药物合成中间体,其合成路线如下: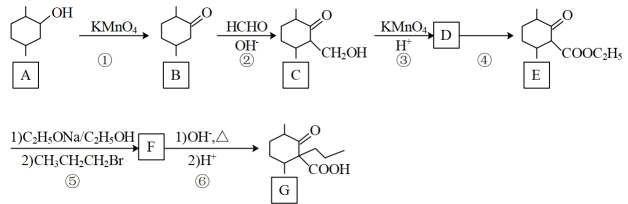
回答下列问题:
(1)、E中的官能团名称是 , ②的反应类型是。(2)、碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出B中的手性碳。。(3)、B的同分异构体中,含有六元环且能发生银镜反应的化合物共有种(不考虑立体异构)。写出其中核磁共振氢谱有6种不同化学环境的氢,峰面积比为1:1:1:4:4:3的结构简式。(4)、D→E的化学方程式为。(5)、下列说法正确的是____。A、E→F的反应类型为加成反应 B、化合物A与乙醇互为同系物 C、化合物G的分子式是 D、化合物B一氯代物有7种(6)、设计由甲苯和乙酰乙酸乙酯()制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。