山西省阳泉市2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-09-27 类型:期末考试
一、单选题
-
1. 材料是人类赖以生存和发展的物质基础。下列有关材料的说法正确的是( )A、y19大飞机机身蒙皮使用的铝锂合金,属于金属材料 B、制作“神舟”飞船航天服使用的聚酯纤维,属于再生纤维 C、钠离子电池正极材料使用的石墨烯,属于有机高分子材料 D、北斗卫星使用的氮化铝芯片,属于传统无机非金属材料2. 化学与生产、生活密切相关。下列说法错误的是( )A、非处方药的包装上印有“OTC”标识 B、可用灼烧法鉴别蚕丝和人造丝织物 C、煤的干馏、气化和液化都是物理变化 D、苯甲酸钠是一种防腐剂,果汁饮料中可以适量添加3. 下列化学用语正确的是( )A、乙烯的结构简式: B、二氧化碳的空间填充模型:
 C、羟基的电子式:
C、羟基的电子式: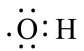 D、正丁烷的球棍模型:
D、正丁烷的球棍模型: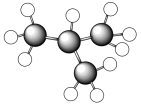 4. 以下各组常见的有机物,二者互为同分异构体的是( )A、淀粉与纤维素 B、蔗糖与葡萄糖 C、
4. 以下各组常见的有机物,二者互为同分异构体的是( )A、淀粉与纤维素 B、蔗糖与葡萄糖 C、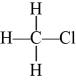 与
与 D、
D、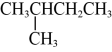 与
与 5. 下列有关含氮化合物的性质与用途具有对应关系的是( )A、受热易分解,可用作化肥 B、液氨汽化时吸收大量的热量,可用作制冷剂 C、具有氧化性,可用于生产硝酸 D、铁能与冷的浓硝酸反应,可用于制备氢气6. 实验室保存下列物质时,必须用棕色细口瓶的是( )A、 B、浓硝酸 C、 D、浓硫酸7. 科学家已获得了气态分子,其结构为正四面体形(如图所示)。已知断裂1 mol N—N键吸收193 kJ能量,断裂1 mol N≡N键吸收946 kJ能量,下列说法正确的是( )
5. 下列有关含氮化合物的性质与用途具有对应关系的是( )A、受热易分解,可用作化肥 B、液氨汽化时吸收大量的热量,可用作制冷剂 C、具有氧化性,可用于生产硝酸 D、铁能与冷的浓硝酸反应,可用于制备氢气6. 实验室保存下列物质时,必须用棕色细口瓶的是( )A、 B、浓硝酸 C、 D、浓硫酸7. 科学家已获得了气态分子,其结构为正四面体形(如图所示)。已知断裂1 mol N—N键吸收193 kJ能量,断裂1 mol N≡N键吸收946 kJ能量,下列说法正确的是( )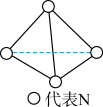 A、属于一种新型的化合物 B、1 mol 转化为时要吸收734 kJ能量 C、比消耗的能量少 D、和互为同素异形体,转化为属于化学变化8. 为了除去粗盐中的Ca2+、Mg2+、S和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤; ②加过量NaOH溶液; ③加适量盐酸;④加过量Na2CO3溶液; ⑤加过量BaCl2溶液。其中正确的操作顺序是( )A、④①②⑤③ B、①④②⑤③ C、⑤②④①③ D、②④⑤①③9. 锂海水电池在航海中有着重要应用,其示意图如图所示,电池反应为2Li+2H2O=2LiOH+H2↑。下列说法不正确的是( )
A、属于一种新型的化合物 B、1 mol 转化为时要吸收734 kJ能量 C、比消耗的能量少 D、和互为同素异形体,转化为属于化学变化8. 为了除去粗盐中的Ca2+、Mg2+、S和泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤; ②加过量NaOH溶液; ③加适量盐酸;④加过量Na2CO3溶液; ⑤加过量BaCl2溶液。其中正确的操作顺序是( )A、④①②⑤③ B、①④②⑤③ C、⑤②④①③ D、②④⑤①③9. 锂海水电池在航海中有着重要应用,其示意图如图所示,电池反应为2Li+2H2O=2LiOH+H2↑。下列说法不正确的是( )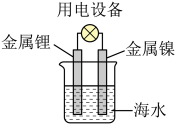 A、金属镍作正极 B、金属锂发生氧化反应 C、可将化学能转化为电能 D、电子从锂电极经海水流向镍电极10. 速率与限度是研究化学反应的重要视角,下列叙述错误的是( )A、对于反应 , 其他条件不变,增加木炭的量,反应速率不变 B、用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率会加快 C、100 mL 2 mol·L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 D、在给定条件下,达到平衡时,可逆反应完成程度达到最大11. 利用反应设计一个原电池,下列装置示意图正确的是( )A、
A、金属镍作正极 B、金属锂发生氧化反应 C、可将化学能转化为电能 D、电子从锂电极经海水流向镍电极10. 速率与限度是研究化学反应的重要视角,下列叙述错误的是( )A、对于反应 , 其他条件不变,增加木炭的量,反应速率不变 B、用锌片和稀硫酸反应制取氢气时,用粗锌比纯锌反应生成氢气的速率会加快 C、100 mL 2 mol·L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 D、在给定条件下,达到平衡时,可逆反应完成程度达到最大11. 利用反应设计一个原电池,下列装置示意图正确的是( )A、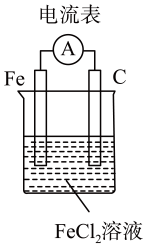 B、
B、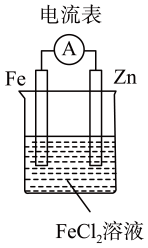 C、
C、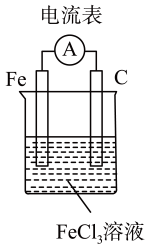 D、
D、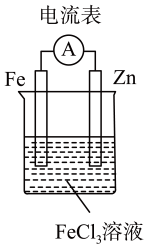 12. 下列说法正确的是( )A、硫黄在纯氧中燃烧生成SO3 B、浓硫酸能使纸张变黑体现了浓硫酸的吸水性 C、工业上制硫酸若用水吸水SO3易形成酸雾,所以用98.3%的浓硫酸来吸水SO3 D、在某溶液中先加稀HNO3再加BaCl2溶液有无白色沉淀生成来检验溶液中是否存在SO13. 实验室用如图所示的装置进行甲烷与氯气在光照下反应的实验。光照下反应一段时间后,下列说法正确的是( )
12. 下列说法正确的是( )A、硫黄在纯氧中燃烧生成SO3 B、浓硫酸能使纸张变黑体现了浓硫酸的吸水性 C、工业上制硫酸若用水吸水SO3易形成酸雾,所以用98.3%的浓硫酸来吸水SO3 D、在某溶液中先加稀HNO3再加BaCl2溶液有无白色沉淀生成来检验溶液中是否存在SO13. 实验室用如图所示的装置进行甲烷与氯气在光照下反应的实验。光照下反应一段时间后,下列说法正确的是( )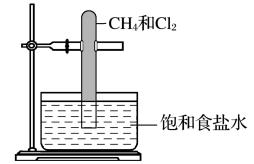 A、试管中发生了取代反应,试管内壁上有油珠产生 B、反应后的混合气体能使湿润的石蕊试纸变红,说明生成的一氯甲烷具有酸性 C、甲烷和反应后的产物有4种 D、和完全反应后液面上升,液体充满试管14. 下列说法正确的是( )A、油脂都兼有酯和烯烃的一些化学性质 B、利用植物秸秆等生物质中的纤维素可以生产酒精,用作燃料 C、酸性既可以验证乙烷和乙烯,还可以除去乙烷中混有的乙烯 D、、、醋酸溶液与金属钠反应,产生的速率是依次增大15. 下列实验操作能达到实验目的的是( )
A、试管中发生了取代反应,试管内壁上有油珠产生 B、反应后的混合气体能使湿润的石蕊试纸变红,说明生成的一氯甲烷具有酸性 C、甲烷和反应后的产物有4种 D、和完全反应后液面上升,液体充满试管14. 下列说法正确的是( )A、油脂都兼有酯和烯烃的一些化学性质 B、利用植物秸秆等生物质中的纤维素可以生产酒精,用作燃料 C、酸性既可以验证乙烷和乙烯,还可以除去乙烷中混有的乙烯 D、、、醋酸溶液与金属钠反应,产生的速率是依次增大15. 下列实验操作能达到实验目的的是( )选项
实验操作
实验目的
A
取少量样品于试管中,加入稀溶液,试管口放一张湿润红色石蕊试纸,观察现象
判断样品中是否含有
B
将炽热的木炭与浓硫酸混合后所得气体通入澄清石灰水中
验证碳的氧化产物为
C
将适量气体通入硅酸钠溶液,观察能否出现白色胶状沉淀
比较Cl和Si元素非金属强弱
D
其他条件相同,溶液和溶液反应,测定不同温度下出现乳白色浑浊所需时间
探究温度对反应速率的影响
A、A B、B C、C D、D16. 下列金属冶炼的反应原理,不正确的是( )A、2NaCl(熔融) B、(浓) C、 D、17. 有机物M是合成药物的中间体,其结构简式如图,下列有关M的叙述中正确的是( ) A、该有机物含4种官能团 B、它是乙醇的同系物 C、该有机物既能发生加成反应,也能发生取代反应 D、用酸性高锰酸钾溶液可直接确认该分子中含有碳碳双键18. 乙醇分子结构中各种化学键如图所示,下列对乙醇的有关说法不正确的是( )
A、该有机物含4种官能团 B、它是乙醇的同系物 C、该有机物既能发生加成反应,也能发生取代反应 D、用酸性高锰酸钾溶液可直接确认该分子中含有碳碳双键18. 乙醇分子结构中各种化学键如图所示,下列对乙醇的有关说法不正确的是( )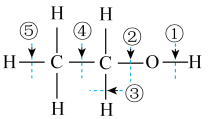 A、与金属钠反应时断裂①键 B、受羟基影响乙醇的化学性质比乙烷活泼 C、乙醇在铜催化下和氧气反应时键①和③断裂 D、乙醇和乙酸、浓硫酸共热时键②断裂19. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、1mol Cu与足量S完全反应,转移的电子数目为2 B、常温常压下,28g乙烯和丙烯的混合气体中,含有碳原子的数目为2 C、50mL 18.4浓硫酸与足量铜加热反应,生成的分子数目为0.56 D、一定条件下,将1mol 与3mol 充入一密闭容器内充分反应后,容器内气体的分子数目为220. 将3.84g铜粉与一定质量浓硝酸反应,当铜完全溶解时,收集到NO、NO2混合气体2.24L(标准状况下),则所消耗酸的物质的量是( )A、0.1mol B、0.11mol C、0.16mol D、0.22mol
A、与金属钠反应时断裂①键 B、受羟基影响乙醇的化学性质比乙烷活泼 C、乙醇在铜催化下和氧气反应时键①和③断裂 D、乙醇和乙酸、浓硫酸共热时键②断裂19. 设为阿伏加德罗常数的值,下列叙述正确的是( )A、1mol Cu与足量S完全反应,转移的电子数目为2 B、常温常压下,28g乙烯和丙烯的混合气体中,含有碳原子的数目为2 C、50mL 18.4浓硫酸与足量铜加热反应,生成的分子数目为0.56 D、一定条件下,将1mol 与3mol 充入一密闭容器内充分反应后,容器内气体的分子数目为220. 将3.84g铜粉与一定质量浓硝酸反应,当铜完全溶解时,收集到NO、NO2混合气体2.24L(标准状况下),则所消耗酸的物质的量是( )A、0.1mol B、0.11mol C、0.16mol D、0.22mol二、填空题
-
21. 化学与生活息息相关。请根据你所学知识回答下列问题。(1)、在葡萄酒酸制过程中添加适量二氧化硫不仅能杀菌,还能防止葡萄酒中的一些成分被氧化,起到保质的作用。这是利用了二氧化硫、能杀菌消毒和的性质。(2)、一些化工生产以及煤、石油的燃烧都可能生成二氧化硫,若任由其排放会造成大气污染,还可能形成 , 危害地面生物。在煤中加入适量生石灰可有效防止二氧化硫的排放,原因是(用化学方程式表示)。某化学兴趣小组的同学收集到我市某电厂的尾气,将其(填操作及现象),说明尾气中无二氧化硫。(3)、为早日实现“碳达峰、碳中和”的目标,我国大力发展光伏发电代替火力发电。光伏电池所用材料是;“碳达峰、碳中和”中的“碳”指的是。北京冬奥会亮相的氢燃料电动汽车是典型的绿色环保车,电池采用碱性电解质,工作时的负极反应方程式为。
三、实验题
-
22. 氮及其化合物是重要的化工原料。回答下列问题:(1)、利用如图所示装置及药品制取氨气。
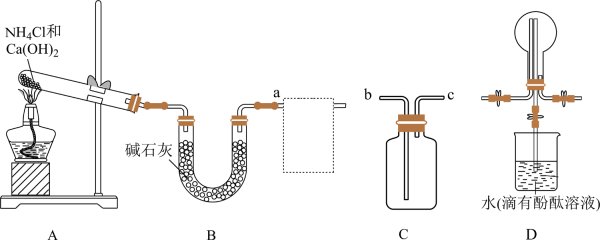
①A中制取氨气的化学方程式为。
②C为方框内氨气的收集装置,则a应与(填“b”或“c”)相连。
③证明氨气已集满的操作和现象是。
(2)、若观察到装置D中的烧瓶内产生了红色喷泉。则说明氨气具有的性质是。(3)、氨经催化氧化可制备硝酸,氨催化氧化的化学方程式为。(4)、可用碱液吸收:(未配平),已知M是一种盐,且在生成物中M与的物质的量比为1∶1.则M的化学式为。(5)、NO可在一定条件下,用氨气还原成可直接排入空气中的无毒气体,此反应中氧化剂和还原剂的物质的量之比四、填空题
-
23. 茶温度下,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
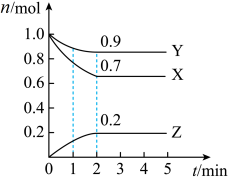 (1)、从开始至2min,X的平均反应速率为。(2)、该反应的化学方程式为。(3)、1min时,(填“>”、“<”或“=”下同),2min时,转化率。(4)、若2min时向容器中通入氩气(容器体积不变),X的化学反应速率将(填“增大”、“减小”或“不变”。下同),5min时,压缩容器体积,反应速率会。(5)、若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是。
(1)、从开始至2min,X的平均反应速率为。(2)、该反应的化学方程式为。(3)、1min时,(填“>”、“<”或“=”下同),2min时,转化率。(4)、若2min时向容器中通入氩气(容器体积不变),X的化学反应速率将(填“增大”、“减小”或“不变”。下同),5min时,压缩容器体积,反应速率会。(5)、若X、Y、Z均为气体(容器体积不变),下列能说明反应已达平衡的是。a.X、Y、Z三种气体的浓度相等
b.混合气体的相对分子质量不随时间变化
c.混合气体的总压强不随时间变化
d.反应速率
e.
五、有机推断题
-
24. A是来自石油的重要有机化工原料,也可用作果实催熟剂。(1)、石油分馏得到重油的过程是(填“化学”或“物理”)变化。
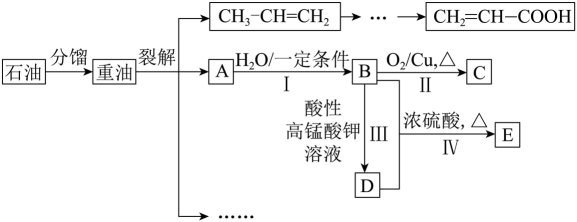 (2)、A的电子式为 , D中官能团的名称为 , 反应Ⅰ的类型为。(3)、反应Ⅱ的化学方程式为。(4)、丙烯()在催化剂、加热条件下与反应可生成一种重要的化工原料丙烯酸()。下列关于丙烯酸的说法正确的是____(填选项字母)。A、与乙酸互为同系物 B、能发生加成、酯化、氧化反应 C、能与溶液反应生成 D、一定条件下能发生加聚反应,生成(5)、利用反应Ⅳ可制取E,实验装置如图所示。
(2)、A的电子式为 , D中官能团的名称为 , 反应Ⅰ的类型为。(3)、反应Ⅱ的化学方程式为。(4)、丙烯()在催化剂、加热条件下与反应可生成一种重要的化工原料丙烯酸()。下列关于丙烯酸的说法正确的是____(填选项字母)。A、与乙酸互为同系物 B、能发生加成、酯化、氧化反应 C、能与溶液反应生成 D、一定条件下能发生加聚反应,生成(5)、利用反应Ⅳ可制取E,实验装置如图所示。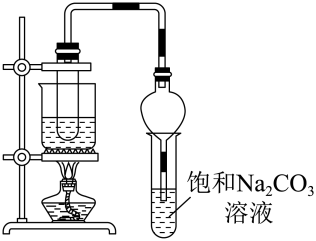
①反应Ⅳ的化学方程式为。
②球形漏斗的主要作用是。
③若实验所用D质量为6.0 g,B质量为5.0 g,得到纯净产品E质量为6.6 g,则E的产率是多少(写出计算过程)?
-
-
-