鲁教版(五四制)初中化学2023-2024学年九年级上学期第二单元 常见的酸和碱素养检测
试卷更新日期:2023-09-26 类型:单元试卷
一、选择题(每小题3分,共30分)
-
1. 下列关于物质保存方法的原因,不正确的是( )
选项
保存方法
原因
A
生石灰应密封保存
生石灰易与空气中的水蒸气等物质反应
B
浓硫酸应密封保存
浓硫酸在空气中易吸水
C
浓盐酸应密封保存
浓盐酸易挥发
D
氢氧化钙应密封保存
氢氧化钙易与空气中的氧气反应
A、A B、B C、C D、D2. 物质的性质决定用途。下列关于物质的性质与用途对应错误的是( )A、熟石灰呈碱性,可用于改良酸性土壤 B、活性炭具有疏松多孔的结构,吸附性强,可用作冰箱除味剂 C、氢氧化钠是常见的碱,可用于中和人体胃液中过多的胃酸 D、浓硫酸有吸水性,在实验室中常作干燥剂3. 物质分类是化学学习的常用方法。下列物质的分类判断中,正确的是( )A、CO2、H2SO3属于氧化物 B、HNO3、NaHSO4属于酸 C、MgO、CO2属于金属氧化物 D、Na2SO4、Ca(HCO3)2属于盐4. 某同学用pH试纸测定了生活中一些物质的pH如下。能使酚酞溶液变红的物质是( )物质
食醋
橘子汁
食盐水
炉具清洁剂
pH
2
4
7
12
A、食醋 B、橘子汁 C、食盐水 D、炉具清洁剂5. 某物质能使无色酚酞变红,下列说法正确的是( )A、该物质一定是碱 B、该物质的溶液显碱性 C、该物质的溶液加水稀释,pH增大 D、向该物质中滴加稀盐酸,一定发生中和反应6. 动手实验是学习化学的必要途径,如图所示的实验操作中,正确的是( )A、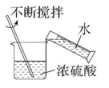 B、
B、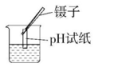 C、
C、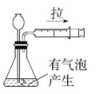 D、
D、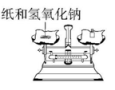 7. 某化工厂产生的污水pH=2,主要污染物是硫酸。现要将污水调节至接近中性,达标后再排放,下列说法不正确的是( )A、检测:用pH试纸或pH计检测污水的酸碱度 B、原理:处理酸性污水的实质是消耗污水中的氢离子 C、验证:取水样,加入少量氯化钡溶液后出现白色沉淀,证明处理未达标 D、应用:可与造纸厂排放的碱性污水混合,达标后再排放8. 室温下,用数字pH仪连接电脑实时测得的稀盐酸和氢氧化钠溶液反应过程中的pH变化曲线如图,下列相关叙述错误的是( )
7. 某化工厂产生的污水pH=2,主要污染物是硫酸。现要将污水调节至接近中性,达标后再排放,下列说法不正确的是( )A、检测:用pH试纸或pH计检测污水的酸碱度 B、原理:处理酸性污水的实质是消耗污水中的氢离子 C、验证:取水样,加入少量氯化钡溶液后出现白色沉淀,证明处理未达标 D、应用:可与造纸厂排放的碱性污水混合,达标后再排放8. 室温下,用数字pH仪连接电脑实时测得的稀盐酸和氢氧化钠溶液反应过程中的pH变化曲线如图,下列相关叙述错误的是( )
 A、图中X溶液为氢氧化钠溶液 B、a点溶液能使紫色石蕊试液变红 C、c点溶液中的溶质是NaCl和NaOH D、b点表示HCl与NaOH等质量反应9. 甲、乙、丙三种物质有如下转化关系:甲
A、图中X溶液为氢氧化钠溶液 B、a点溶液能使紫色石蕊试液变红 C、c点溶液中的溶质是NaCl和NaOH D、b点表示HCl与NaOH等质量反应9. 甲、乙、丙三种物质有如下转化关系:甲 乙
乙 丙。在不断搅拌下,往装有甲溶液的容器中逐滴加入稀盐酸依次发生了①、②反应,同时测定容器中液体的透光强度(液体越浑浊,透光强度越小),结果如图。下列分析错误的是( )
丙。在不断搅拌下,往装有甲溶液的容器中逐滴加入稀盐酸依次发生了①、②反应,同时测定容器中液体的透光强度(液体越浑浊,透光强度越小),结果如图。下列分析错误的是( )
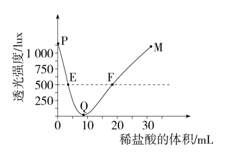 A、乙难溶于水 B、甲可能是NaOH C、QM段对应的反应是② D、E、F对应的液体组成不同10. 取一定质量的氧化铁粉末放入烧杯,然后先加入稀盐酸,后加入氢氧化钠溶液,烧杯中的固体质量与加入的溶液质量关系如图所示。以下分析正确的是(提示:氯化铁溶液显酸性)( )
A、乙难溶于水 B、甲可能是NaOH C、QM段对应的反应是② D、E、F对应的液体组成不同10. 取一定质量的氧化铁粉末放入烧杯,然后先加入稀盐酸,后加入氢氧化钠溶液,烧杯中的固体质量与加入的溶液质量关系如图所示。以下分析正确的是(提示:氯化铁溶液显酸性)( )
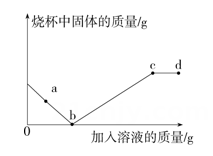 A、a点时观察到红色物质全部溶解,溶液变为黄色 B、b点时溶质的成分是FeCl3和HCl C、b、c、d点对应溶液的pH依次增大 D、a~b段与b~c段发生的反应中有元素化合价的变化
A、a点时观察到红色物质全部溶解,溶液变为黄色 B、b点时溶质的成分是FeCl3和HCl C、b、c、d点对应溶液的pH依次增大 D、a~b段与b~c段发生的反应中有元素化合价的变化二、填空及简答题(共43分)
-
11. 化学来源于生活,又服务于生活。(1)、洁厕剂中的稀盐酸可用来除铁锈,反应的化学方程式为。白醋和铁锈也能发生类似的反应,是因为白醋、盐酸中都含有(填离子符号)。(2)、胃液分泌过多会引起胃病。服用含有氢氧化铝的药物可缓解病痛,其治疗的化学原理为(用化学方程式表示)。(3)、某同学不小心被黄蜂蜇了(黄蜂毒液呈碱性),为了减轻疼痛可以涂抹____(填字母)。A、食醋(pH=3) B、浓硫酸 C、食盐水(pH=7) D、苏打水(pH=8)(4)、酿酒厂生产白酒时,常加入适量稀硫酸来控制酸度,发酵完成后进行蒸馏,即可得到白酒。盐酸的价格比硫酸低,同样能控制酸度,请说明控制酸度不用盐酸的原因:。12. 探究稀盐酸和氢氧化钠溶液反应的实质,请回答有关问题。
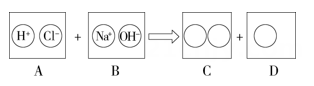 (1)、将上图C、D中圆圈内对应的化学式或离子符号填写在下面空白处:C中、;D中。(2)、用化学方程式表示图中所体现的化学反应:。此反应的基本类型是 , 此反应的实质是。(3)、实验时,甲同学将稀盐酸滴入装有氢氧化钠固体的试管中,触摸试管有灼热感,他马上得出结论:氢氧化钠与稀盐酸反应会放出大量的热。该同学的观点是否准确?请简要说明:。(4)、乙同学进行以下实验:在一支试管中加入NaOH溶液,再向其中滴加稀盐酸,振荡,最后滴加2滴酚酞试液,振荡,溶液不变色。乙据此判断酸和碱恰好完全反应。乙同学得出这样的结论是(填“正确”或“不正确”)的,理由是。(5)、氢氧化钠溶液极易吸收空气中的二氧化碳而变质为(写化学式),该反应的化学方程式为。(6)、证明一瓶氢氧化钠溶液已变质,可选用试剂。如果已变质,则现象为 , 发生反应的化学方程式为。13. 如图以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题:
(1)、将上图C、D中圆圈内对应的化学式或离子符号填写在下面空白处:C中、;D中。(2)、用化学方程式表示图中所体现的化学反应:。此反应的基本类型是 , 此反应的实质是。(3)、实验时,甲同学将稀盐酸滴入装有氢氧化钠固体的试管中,触摸试管有灼热感,他马上得出结论:氢氧化钠与稀盐酸反应会放出大量的热。该同学的观点是否准确?请简要说明:。(4)、乙同学进行以下实验:在一支试管中加入NaOH溶液,再向其中滴加稀盐酸,振荡,最后滴加2滴酚酞试液,振荡,溶液不变色。乙据此判断酸和碱恰好完全反应。乙同学得出这样的结论是(填“正确”或“不正确”)的,理由是。(5)、氢氧化钠溶液极易吸收空气中的二氧化碳而变质为(写化学式),该反应的化学方程式为。(6)、证明一瓶氢氧化钠溶液已变质,可选用试剂。如果已变质,则现象为 , 发生反应的化学方程式为。13. 如图以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题:
 (1)、稀盐酸中阳离子的符号是;(2)、反应①中石蕊试液变为色;(3)、反应②⑤的化学方程式分别为、;(4)、写出反应③的化学方程式:。(5)、探究上述稀盐酸与氢氧化钙溶液反应后烧杯中的盐酸是否过量:甲同学向反应后的溶液中滴加酚酞试液,观察到无色酚酞试液不变色,则证明盐酸不过量。该实验设计是否合理?(填“合理”或“不合理”),理由是。乙同学向反应后的溶液中滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,证明了盐酸过量。该实验设计是否合理?(填“合理”或“不合理”),理由是。(6)、若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是CuSO4、BaCl2、Na2CO3中的;写出X与稀盐酸反应的化学方程式:。(7)、将X溶液与Ca(OH)2溶液反应后所得混合物进行过滤,向滤液中滴入过量稀盐酸,无明显现象,则原滤液中溶质的组成可能是。
(1)、稀盐酸中阳离子的符号是;(2)、反应①中石蕊试液变为色;(3)、反应②⑤的化学方程式分别为、;(4)、写出反应③的化学方程式:。(5)、探究上述稀盐酸与氢氧化钙溶液反应后烧杯中的盐酸是否过量:甲同学向反应后的溶液中滴加酚酞试液,观察到无色酚酞试液不变色,则证明盐酸不过量。该实验设计是否合理?(填“合理”或“不合理”),理由是。乙同学向反应后的溶液中滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,证明了盐酸过量。该实验设计是否合理?(填“合理”或“不合理”),理由是。(6)、若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是CuSO4、BaCl2、Na2CO3中的;写出X与稀盐酸反应的化学方程式:。(7)、将X溶液与Ca(OH)2溶液反应后所得混合物进行过滤,向滤液中滴入过量稀盐酸,无明显现象,则原滤液中溶质的组成可能是。三、实验探究题(共14分)
-
14. 一位化学教师在实验室取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂。某化学兴趣小组的同学在该老师的指导下,对该生石灰样品开展了以下探究活动。
【提出问题】生石灰样品的成分是什么?
【作出猜想】生石灰样品的成分可能是CaO、Ca(OH)2和CaCO3中的一种或几种。
(1)、【实验探究】小华同学设计如下实验进行探究。实验
实验操作
实验现象
实验结论
①
取样品于烧杯中,加水溶解,用手触摸烧杯壁
烧杯壁发热
②
将①中液体过滤,向滤液中滴入
溶液变红
有Ca(OH)2
③
取少量②中的滤渣,向其中滴加少量稀盐酸
无CaCO3
(2)、【交流讨论】同学们经过讨论,发现通过实验②不能得出样品中一定含有Ca(OH)2 , 理由是。(3)、某同学提出实验③结论也不正确。他改进实验③,并通过实验证明生石灰样品中含有碳酸钙,他改进实验③的操作内容是。(4)、通过小组合作,最后得出样品中肯定含有CaO和CaCO3 , 可能含有Ca(OH)2。请写出生成CaCO3的化学方程式:。(5)、【继续探究】为确定可能含有的物质是否存在,同学们继续探究。取0.76 g该生石灰样品放入烧杯中,进行了以下探究实验:
【讨论与分析】该生石灰样品的成分是。

四、计算题(共13分)
-
15. 某化学兴趣小组为测定某工厂生产的MgCl2的纯度(即质量分数),称取10.0 g该MgCl2样品放于烧杯中,加水使之完全溶解,再向烧杯中加入60.0 g溶质质量分数为16%的NaOH溶液,充分反应后,过滤,将沉淀洗涤、常温干燥,称得固体质量为5.8 g。
(已知:该MgCl2产品中含有少量Na2SO4等杂质,杂质均能溶于水,且不与NaOH反应)
请计算:
(1)、假设60.0 g溶质质量分数为16%的NaOH溶液完全反应,需要MgCl2的质量是g(不写计算过程)。由此可以判断,烧杯内10.0 g样品中的MgCl2(填“全部”或“部分”)与NaOH溶液发生了反应。(2)、该样品中MgCl2的质量分数是多少?(写出计算过程)
-