重庆市2022-2023学年高一下学期期末联合诊断检测化学试题
试卷更新日期:2023-09-22 类型:期末考试
一、单选题
-
1. 我国历史文化悠久,科技发展迅猛,给人类留下了无数瑰宝。下列物品的主要成分是硅酸盐的是( )
A
B
C
D




东汉马踏飞燕
白釉绿彩长颈鹿
我国宇航员穿的航天服
我国研制的歼20用的隐形涂料
A、A B、B C、C D、D2. “即热快餐”外层分别装了两种互不接触的化学物质,使用时将两种物质混合即可对食物进行加热,这两种物质可能是( )A、食盐和铁粉 B、和 C、生石灰和水 D、浓硫酸和水3. 我国华为公司的技术标准成为世界5G通讯标准的重要组成部分,6G也正在研发,5G、6G都离不开光导纤维。制造光导纤维的材料是( )A、二氧化硅 B、铜合金 C、晶体硅 D、纤维素4. 已知: , 下列有关化学用语正确的是( )A、的结构示意图: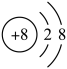 B、乙烯的最简式:
C、的电子式:
B、乙烯的最简式:
C、的电子式: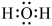 D、的空间充填模型:
D、的空间充填模型: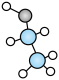 5. 下列各组离子在水溶液中能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、6. 用固体与稀盐酸反应制取 , 生成的体积与时间的关系如下图所示。下列说法不正确的是( )
5. 下列各组离子在水溶液中能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、6. 用固体与稀盐酸反应制取 , 生成的体积与时间的关系如下图所示。下列说法不正确的是( )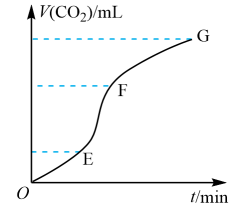 A、图中OE段收集的最少 B、图中EF段反应速率最快 C、该反应是吸热反应 D、将粉碎可以加快反应速率7. 下列金属冶炼的反应原理正确的是( )A、 B、(水溶液) C、(熔融) D、8. 下列装置或操作能达到实验目的的是( )
A、图中OE段收集的最少 B、图中EF段反应速率最快 C、该反应是吸热反应 D、将粉碎可以加快反应速率7. 下列金属冶炼的反应原理正确的是( )A、 B、(水溶液) C、(熔融) D、8. 下列装置或操作能达到实验目的的是( )

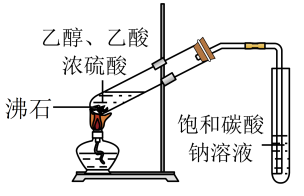

A.一根玻璃棒蘸浓氨水,另一玻璃棒蘸浓盐酸,观察氨气与氯化氢反应的现象
B.收集
C.实验室制乙酸乙酯
D.验证的还原性
A、A B、B C、C D、D9. 某机物与几种试剂反应的现象如下表所示,则该有机物可能是( )试剂
钠
溴水
现象
产生气泡
褪色
产生气泡
A、苯乙烯 B、乙酸 C、 D、10. 某实验小组自制如下图所示的水果电池。下列有关说法不正确的是( )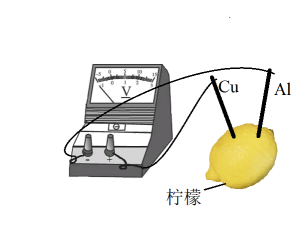 A、柠檬的作用是提供电解质溶液 B、电子由铜流出经外电路流回铝 C、负极的电极反应式为 D、电极有产生,且发生还原反应11. 下列因果关系正确的是( )A、浓硫酸有脱水性,用浓硫酸可除去中的水蒸气 B、浓硝酸见光易分解,浓硝酸要保存在棕色试剂瓶里 C、氢氟酸具有弱酸性,氢氟酸可用来刻蚀玻璃 D、氨气液化时吸收大量的热,液氨常用作制冷剂12. 下列离子方程式正确的是( )A、向稀溶液中加入盐酸: B、溶液中滴加足量氨水: C、少量溶液与溶液反应:。 D、二氧化硅与溶液反应:13. 已知:。要检验某食盐中是否含(),可选用的试剂有:①蒸馏水;②淀粉;③蓝色石蕊试纸;④碘化钾淀粉试纸;⑤乙酸;⑥蔗糖。进行上述实验时,必须使用的试剂是( )A、①②③ B、①④⑤ C、①②④⑥ D、①②③④⑤⑥14. 某种磁铁矿样品中含 , , 其它不含铁的杂质15.0%,则该样品中铁的质量分数约为( )A、58.5% B、55.7% C、55.0% D、54.3%
A、柠檬的作用是提供电解质溶液 B、电子由铜流出经外电路流回铝 C、负极的电极反应式为 D、电极有产生,且发生还原反应11. 下列因果关系正确的是( )A、浓硫酸有脱水性,用浓硫酸可除去中的水蒸气 B、浓硝酸见光易分解,浓硝酸要保存在棕色试剂瓶里 C、氢氟酸具有弱酸性,氢氟酸可用来刻蚀玻璃 D、氨气液化时吸收大量的热,液氨常用作制冷剂12. 下列离子方程式正确的是( )A、向稀溶液中加入盐酸: B、溶液中滴加足量氨水: C、少量溶液与溶液反应:。 D、二氧化硅与溶液反应:13. 已知:。要检验某食盐中是否含(),可选用的试剂有:①蒸馏水;②淀粉;③蓝色石蕊试纸;④碘化钾淀粉试纸;⑤乙酸;⑥蔗糖。进行上述实验时,必须使用的试剂是( )A、①②③ B、①④⑤ C、①②④⑥ D、①②③④⑤⑥14. 某种磁铁矿样品中含 , , 其它不含铁的杂质15.0%,则该样品中铁的质量分数约为( )A、58.5% B、55.7% C、55.0% D、54.3%二、有机推断题
-
15. 乙烯的年产量可以用来衡量一个国家的石油化工发展水平,以原油为原料生产一些化工产品的流程图如下。
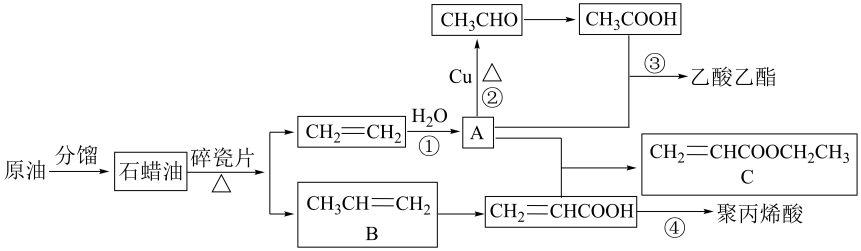
请回答下列问题:
(1)、A的结构简式是;B的名称是;反应①的反应类型是。(2)、C中的含氧官能团名称是;反应③的条件是。(3)、下列有关B的说法错误的是(填字母)。a. B能使酸性高锰酸钾溶液褪色
b. B能在空气中燃烧
c. B中的所有原子在同一个平面内
d. B与溴发生加成反应的产物是
(4)、反应②和④的化学方程式分别为:②;④。三、原理综合题
-
16. 我国力争2030年前实现碳达峰,2060年前实现碳中和。的捕集利用已成为科学家们研究的重要课题。加氢可转化为二甲醚(CH3OCH3),反应原理为。该反应的能量变化如图所示。
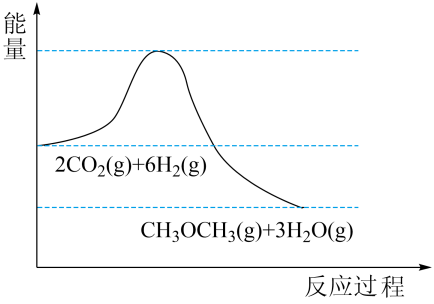
请回答下列问题:
(1)、该反应为(填“放热”或“吸热”)反应。(2)、在固定体积的密闭容器中发生该反应,能说明该反应达到平衡状态的是(填字母)。a.的含量保持不变
b.混合气体的密度不变c.混合气体的平均相对分子质量不变
d.(3)、在体积为密闭容器中充入和 , 测得、的物质的量随时间变化如图所示。
①反应到达3min时,(填“>”“<”或“=”)。
②0~5min内,。
③反应达到平衡状态时,的体积分数为%(保留1位小数)。
④“二甲醚(CH3OCH3)酸性燃料电池”的工作原理示意图如图所示。X电极为(填“正”或“负”)极;电路中电子移动方向是;Y电极的电极反应式为。

四、实验题
-
17. 某课外活动小组用如下实验装置制取氨气并探究氨气的性质(部分夹持装置已略去)。
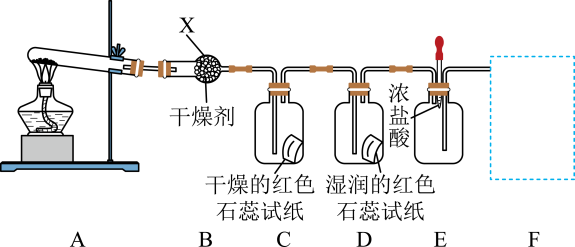
请回答下列问题:
(1)、仪器X的名称是;干燥剂是(填名称)。(2)、D中的现象是;E中滴入浓盐酸后的现象是。(3)、A中反应的化学方程式为。(4)、虚线框内可选用下列装置中的装置(填字母)。 (5)、为验证氨气极易溶于水,其实验装置如图1所示,引发喷泉的操作为。
(5)、为验证氨气极易溶于水,其实验装置如图1所示,引发喷泉的操作为。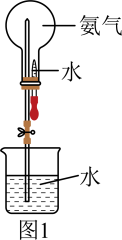 (6)、将氯气与氨气混合会产生大量白烟,工业上常用此反应来检验输送氯气的管道是否漏气,则其反应的化学方程式为。
(6)、将氯气与氨气混合会产生大量白烟,工业上常用此反应来检验输送氯气的管道是否漏气,则其反应的化学方程式为。五、工业流程题
-
18. 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为)为原料生产和。
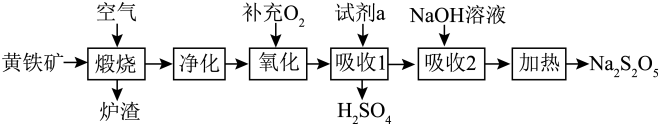
请回答下列问题:
(1)、中铁元素的化合价为;试剂a为。(2)、若要增大煅烧过程的反应速率,应采取的措施是(写两条即可)。(3)、煅烧时主要反应的化学方程式为。(4)、“氧化”时,反应的化学方程式为。(5)、可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中的含量。请配平其反应的化学方程式:若要检验是否变质生成了 , 所用的试剂是。
(6)、在测定某葡萄酒中的含量时,取葡萄酒样品,消耗碘标准液。样品中的含量为。
-
-
-