湖北省武汉市江夏区2023年中考三模化学试题
试卷更新日期:2023-09-22 类型:中考模拟
一、单选题
-
1. 性质决定用途,以下物质性质属于化学性质的是( )A、碳酸氢钠受热能分解 B、蜡烛受热可以熔化 C、一氧化碳难溶于水 D、氢气密度小于空气2. 如图所示实验操作正确的是( )A、滴加液体
 B、闻气体气味
B、闻气体气味  C、熄灭酒精灯
C、熄灭酒精灯  D、稀释浓硫酸
D、稀释浓硫酸  3. 武汉特色小吃热干面是用碱水面、芝麻酱、植物油、酱油、醋等烹饪而成,是中国五大名面之一,以下说法不正确的是( )A、植物油属于油脂,是重要的供能物质 B、在远处闻到热干面的香味,说明分子在不停运动 C、酿造食醋中含醋酸(CH3COOH),是一种酸性物质 D、食用加铁酱油可预防缺铁性贫血,铁元素属于人体所需的常量元素4. 碳酸氢铵(NH4HCO3)是农业生产中常用的化学肥料,下列有关说法正确的是( )A、NH4HCO3中的阳离子为 B、NH4HCO3中氢元素的化合价为+3价 C、碳原子的结构示意图为
3. 武汉特色小吃热干面是用碱水面、芝麻酱、植物油、酱油、醋等烹饪而成,是中国五大名面之一,以下说法不正确的是( )A、植物油属于油脂,是重要的供能物质 B、在远处闻到热干面的香味,说明分子在不停运动 C、酿造食醋中含醋酸(CH3COOH),是一种酸性物质 D、食用加铁酱油可预防缺铁性贫血,铁元素属于人体所需的常量元素4. 碳酸氢铵(NH4HCO3)是农业生产中常用的化学肥料,下列有关说法正确的是( )A、NH4HCO3中的阳离子为 B、NH4HCO3中氢元素的化合价为+3价 C、碳原子的结构示意图为 D、NH4HCO3属于复合肥
5. 氢气和氧气在Pd基催化剂表面可反应生成H2O2 , 其微观示意图如下,下列说法错误的是( )
D、NH4HCO3属于复合肥
5. 氢气和氧气在Pd基催化剂表面可反应生成H2O2 , 其微观示意图如下,下列说法错误的是( ) A、“吸附”时,没有发生化学变化 B、“解离”时,结构技破坏的分子是O2 C、“结合”时,形成新分子 D、“脱离”时,反应前后分子的数目发生了改变6. 已知A,B,C,D,E是初中化学中常见的五种物质,均含有同一种元素。其中,A为单质, B和C含有相同的元素。它们在一定条件下的转化关系如图所示(“→”表示物质间的转化关系,反应条件和部分反应物、生成物已省略),根据初中所学知识判断下列说法正确的是( )
A、“吸附”时,没有发生化学变化 B、“解离”时,结构技破坏的分子是O2 C、“结合”时,形成新分子 D、“脱离”时,反应前后分子的数目发生了改变6. 已知A,B,C,D,E是初中化学中常见的五种物质,均含有同一种元素。其中,A为单质, B和C含有相同的元素。它们在一定条件下的转化关系如图所示(“→”表示物质间的转化关系,反应条件和部分反应物、生成物已省略),根据初中所学知识判断下列说法正确的是( )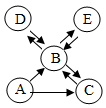 A、A→B的反应一定是化合反应 B、D和E的物质类别可以相同,也可以不同 C、若D是一种白色固体,则B→D的反应属于复分解反应 D、若C为单质, A和B含有相同的元素,其他条件不变。则D→B的反应一定是分解反应7. 实验室某废液的溶质为硝酸铜、硝酸银和硝酸铝,取该废液进行如下图所示实验。
A、A→B的反应一定是化合反应 B、D和E的物质类别可以相同,也可以不同 C、若D是一种白色固体,则B→D的反应属于复分解反应 D、若C为单质, A和B含有相同的元素,其他条件不变。则D→B的反应一定是分解反应7. 实验室某废液的溶质为硝酸铜、硝酸银和硝酸铝,取该废液进行如下图所示实验。
下列说法错误的是( )
A、若滤液1呈无色,则滤液2中可能含有两种阳离子 B、若滤渣1由两种金属组成,则滤液可能呈蓝色 C、若向滤渣1中加入稀盐酸无气泡产生,则滤渣2可能是纯净物 D、若向滤渣1中滴加稀盐酸有气泡冒出,则滤液1中可能含有三种溶质8. 将CO和铁的氧化物FexOy置于密闭容器中,一定条件下充分反应至完全,反应过程中容器内部分物质的质量变化如图所示。下列说法正确的是( )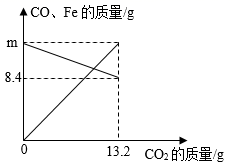 A、m的值为12.6 B、铁的氧化物中x:y=3:4 C、参加反应的铁的氧化物的质量为16g D、当CO2质量为4.4g时,容器内CO质量为14g
A、m的值为12.6 B、铁的氧化物中x:y=3:4 C、参加反应的铁的氧化物的质量为16g D、当CO2质量为4.4g时,容器内CO质量为14g二、实验题
-
9. 利用铁粉、炭粉、氯化钠进行铁的锈蚀实验(装置如图所示,装置气密性良好)。实验1min后温度计读数上升,8min后打开止水夹,水倒吸入性形瓶,实验数据如下表:

实验前的体积
实验后的体积
锥形瓶内空气(含导管内空气)
烧杯内水
烧杯内剩余水
246.0mL
100.0mL
51.5mL
(1)、铁的锈蚀是反应(填“吸热”或“放热”)。(2)、写出铁丝在氧气中燃烧的化学方程式。(3)、计算得出空气中氧气的含量约为(精确到0.1%)。三、填空题
-
10. 如图甲是A、B两种固体物质的溶解度曲线。
 (1)、A的溶解度随温度的升高而(填“增大”或“减小”)。(2)、图甲中,M、N、P三点对应的溶液为A的饱和溶液的是(填字母)。(3)、欲使A溶液的状态从M点转化为P点,可采取的措施是。(4)、在t1℃时,各取A、B物质60g分别加入到两个盛有100g水的烧杯中,充分搅拌得到A溶液和B溶液,然后分别将其放入盛有等量冰块的大烧杯中静置一段时间(如图乙)。下列有关说法正确的是____。A、图乙中B溶液的溶质质量分数为37.5% B、图乙中向装有A溶液的烧杯中加40g水,搅拌后形成的溶液一定还是饱和溶液 C、图甲中t1℃时,向40.0g质量分数为35%的溶液中加入5.0g溶质,可得到41.1%的溶液 D、图甲中将t2℃时上述两种物质的饱和溶液分别降温至t1℃,所得溶液质量可能相等
(1)、A的溶解度随温度的升高而(填“增大”或“减小”)。(2)、图甲中,M、N、P三点对应的溶液为A的饱和溶液的是(填字母)。(3)、欲使A溶液的状态从M点转化为P点,可采取的措施是。(4)、在t1℃时,各取A、B物质60g分别加入到两个盛有100g水的烧杯中,充分搅拌得到A溶液和B溶液,然后分别将其放入盛有等量冰块的大烧杯中静置一段时间(如图乙)。下列有关说法正确的是____。A、图乙中B溶液的溶质质量分数为37.5% B、图乙中向装有A溶液的烧杯中加40g水,搅拌后形成的溶液一定还是饱和溶液 C、图甲中t1℃时,向40.0g质量分数为35%的溶液中加入5.0g溶质,可得到41.1%的溶液 D、图甲中将t2℃时上述两种物质的饱和溶液分别降温至t1℃,所得溶液质量可能相等四、流程题
-
11. 以某菱镁矿石(主要成分是MgCO3 , 含少量MnCO3、SiO2)取MgSO4·7H2O,流程如下:

已知:①“转化”时主要反应是:。
②MgSO4·7H2O中镁元素质量分数为9.76%,采用热分析法测定所得MgSO4·7H2O样品中镁元素质量分数。
(1)、“酸浸”时发生反应,写出其中一个化学反应方程式。(2)、“转化”时可以观察到的现象是。(3)、硫酸镁溶液在不同温度下进行浓缩结晶,可得到不同的晶体:温度/℃
-3.9-1.8
1.8-48.1
48.1-67.5
67.5-200
析出晶体
MgSO4·12H2O
MgSO4·7H2O
MgSO4·6H2O
MgSO4·H2O等
①“操作1”的具体操作是:蒸发浓缩滤液至表面有晶膜出现(此时MgSO4溶液已饱和)、、过滤、洗涤、低温干燥。
②“操作1”所得滤液中能分离出一种可循环使用的物质,循环使用的目的是提高原料利用率。节约资源和成本,减少污染。
关于上述生产工艺流程,下列说法不正确的是。
A.“酸浸”时,粉碎菱镁矿石和搅拌的目的是使其充分反应
B.过滤所得滤渣中SiO2和MnO2均属于金属氧化物
C.“操作1”所得滤液中能分离出一种可循环使用的物质是NaCl
D.高于900℃后,硫酸镁部分分解,测得剩余固体中镁元素质量分数小于20%
(4)、若用100t菱镁矿石制得246tMgSO4·7H2O产品,忽略反应过程中镁元素损失,求该菱镁矿石中MgCO3的质量分数。五、科学探究题
-
12. “氧净”是一种常见洗涤剂,主要成分之一是过碳酸钠(Na2CO4)。某化学研究性学习小组的同学对过碳酸钠进行了以下探究活动。
【查阅资料】
过碳酸钠是一种易溶于水的白色固体粉末,能与水反应生成一种盐和一种强氧化性的物质。
(1)、【实验探究一】20℃时,配制1%过碳酸钠水溶液,进行如下实验。
实验步骤
实验现象
实验结论
①测定该溶液的pH
紫色石蕊溶液显蓝色
说明溶液呈碱性
②取适量请混合液于试管中,加入少量MnO2 , 将带火星的木条伸入试管中
木条复燃
说明其溶液含有。
③另取少量该混合液于试管中,滴加几滴氯化钙溶液
有白色沉淀生成
说明其溶液含有碳酸钠。
(2)、解释与结论:过碳酸钠具有去污能力的原因是其与水反应能产生大量的活性氧,且得到的溶液显碱性。过碳酸钠(NaCO2)与水反应的化学方程式是。(3)、【实验探究二】过碳酸钠含量测定现有一份含碳酸钠杂质的过碳酸钠样品,为测定样品中过碳酸钠的含量,同学们将一定量样品与少量MnO2粉末置于圆底烧瓶,利用以下装置进行实验。(样品中不含其它杂质,MnO2不与稀盐酸、过碳酸钠反应)。
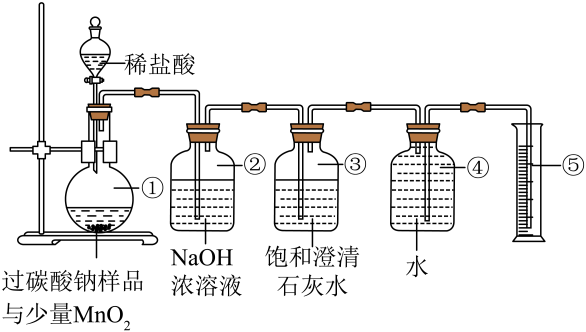
装置③的作用是。(4)、装置④中若水未装满,对O2体积的测定(填“有”或“无”)影响。(5)、计算过碳酸钠样品纯度,需要的数据包括____(填标号)。A、装置②中反应前后的质量差Δm B、装置⑤的中水的体积VmL C、氧气密度ρg/mL D、过碳酸钠样品的质量m六、计算题
-
13. 某兴趣小组为研究酸碱中和反应,取50.0g氧氧化钠溶液于烧杯中,并逐滴加入质量分数为7.3%的稀盐酸,滴加过程中用pH传感器测得烧杯中溶液的pH随加入稀盐酸的质量变化关系,如下图所示。
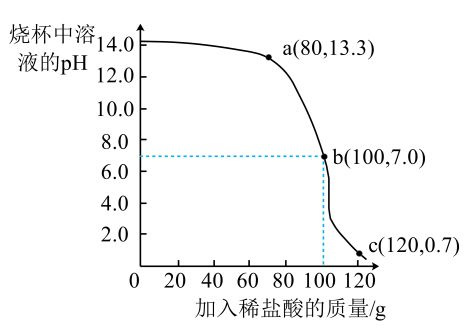 (1)、图中酸碱刚好完全反应的点是a、b、c中的点;(2)、计算氢氧化钠溶液中所含溶质的质量。
(1)、图中酸碱刚好完全反应的点是a、b、c中的点;(2)、计算氢氧化钠溶液中所含溶质的质量。
-
-
-
-