安徽省宣城市2022-2023学年高一下学期化学期末考试试题
试卷更新日期:2023-09-21 类型:期末考试
一、单选题
-
1. 化学与人类健康密切相关。下列物质不能用作食品添加剂的是( )A、氯化镁 B、三聚氰胺 C、山梨酸钾 D、二氧化硫2. 下列是某同学搭建的四种分子结构模型,合理的是( )
选项
A
B
C
D
分子
二氧化碳
甲烷
乙烯
乙酸
模型

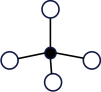
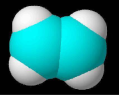
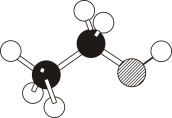 A、A B、B C、C D、D3. 近年来,我国在科技领域取得了多项新突破和新发现。下列说法错误的是( )A、利用二氧化碳合成脂肪酸:实现无机小分子转变成有机高分子 B、发现月壤中的“嫦娥石”:其成分属于盐 C、发射太空光伏发电卫星“太阳花”:太阳能转化为电能 D、革新海水原位电解制氢工艺:关键材料聚四氟乙烯耐腐蚀4. 安全至关重要,下列实验室事故处理方法错误的是是( )A、活泼金属燃烧起火,用灭火毯(石棉布)灭火 B、电器起火,先切断电源,再用二氧化碳灭火器灭火 C、皮肤溅上碱液,先用大量水冲洗,再用2%的硼酸溶液冲洗 D、眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗5. 一种新型制备氨的方法如图所示。下列说法错误的是( )
A、A B、B C、C D、D3. 近年来,我国在科技领域取得了多项新突破和新发现。下列说法错误的是( )A、利用二氧化碳合成脂肪酸:实现无机小分子转变成有机高分子 B、发现月壤中的“嫦娥石”:其成分属于盐 C、发射太空光伏发电卫星“太阳花”:太阳能转化为电能 D、革新海水原位电解制氢工艺:关键材料聚四氟乙烯耐腐蚀4. 安全至关重要,下列实验室事故处理方法错误的是是( )A、活泼金属燃烧起火,用灭火毯(石棉布)灭火 B、电器起火,先切断电源,再用二氧化碳灭火器灭火 C、皮肤溅上碱液,先用大量水冲洗,再用2%的硼酸溶液冲洗 D、眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗5. 一种新型制备氨的方法如图所示。下列说法错误的是( )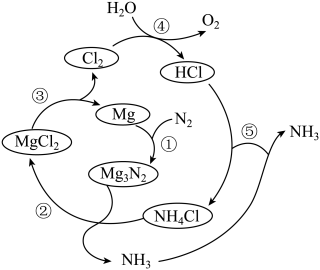 A、反应①属于氮的固定 B、反应③为 C、反应⑤两种气体相遇时,产生白烟 D、该制备总反应为6. 由和组成的混合气体在光照下反应生成四种氯代产物,其沸点如下表所示。利用如图实验装置对液态氯代产物进行分离,下列叙述错误的是( )
A、反应①属于氮的固定 B、反应③为 C、反应⑤两种气体相遇时,产生白烟 D、该制备总反应为6. 由和组成的混合气体在光照下反应生成四种氯代产物,其沸点如下表所示。利用如图实验装置对液态氯代产物进行分离,下列叙述错误的是( )氯代产物
沸点/℃
39.8
61.2
76
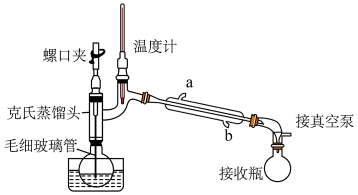 A.毛细玻璃管有平衡气压兼搅拌的作用B.可用热水浴加热,便于控制温度且受热均匀A、分离氯仿控制温度范围: B、冷凝管水流方向为b进a出7. 实验室将粗盐提纯并配制的溶液。本实验必须用到的仪器有( )
A.毛细玻璃管有平衡气压兼搅拌的作用B.可用热水浴加热,便于控制温度且受热均匀A、分离氯仿控制温度范围: B、冷凝管水流方向为b进a出7. 实验室将粗盐提纯并配制的溶液。本实验必须用到的仪器有( )①天平 ②酒精灯 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦冷凝管
A、①②④⑥ B、①③⑤⑥ C、①②⑤⑥ D、②③④⑦8. 下列事实对应离子方程式书写正确的是( )A、工人用白醋除铁锈: B、技术员从海水提溴时用水溶液吸收含溴蒸气: C、药剂师用碳酸氢钠作抗胃酸药: D、环保人员用过量氨水除二氧化硫:9. 下列流程表示工业制硫酸的原理,有关叙述正确的是( )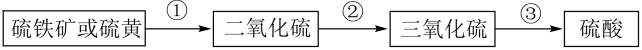 A、①②③都是氧化还原反应 B、硫铁矿主要成分的电子式为
A、①②③都是氧化还原反应 B、硫铁矿主要成分的电子式为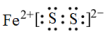 C、③用水做吸收剂
D、二氧化硫实际可产出三氧化硫
10. 为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,中电子的数目为 B、丙烷分子中共价键的数目为 C、溶液中的数目为 D、与足量反应转移的电子数目为11. W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,是形成酸雨的物质之一、下列说法正确的是( )A、Y与X可形成离子化合物 B、原子半径: C、Z的最高价氧化物的水化物是弱酸 D、简单氢化物的沸点:12. 常温下利用下列装置进行实验,能得到相应结论的是( )
C、③用水做吸收剂
D、二氧化硫实际可产出三氧化硫
10. 为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,中电子的数目为 B、丙烷分子中共价键的数目为 C、溶液中的数目为 D、与足量反应转移的电子数目为11. W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,是形成酸雨的物质之一、下列说法正确的是( )A、Y与X可形成离子化合物 B、原子半径: C、Z的最高价氧化物的水化物是弱酸 D、简单氢化物的沸点:12. 常温下利用下列装置进行实验,能得到相应结论的是( )选项
试剂a、b
现象
结论
装置
A
漂白粉浓盐酸
导管口放置的湿润蓝色石蕊试纸先变红后褪色
漂白粉与浓盐酸反应生成
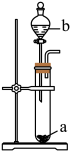
B
铜、稀硝酸
试管上部气体呈红棕色
铜与稀硝酸反应生成
C
钠、75%酒精溶液
收集的气体移近火焰,发出爆鸣声
钠与乙醇反应生成
D
铁、浓硫酸
无明显现象
铁与浓硫酸未发生反应
A、A B、B C、C D、D13. 化学烫发利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。下列说法不正确的是( )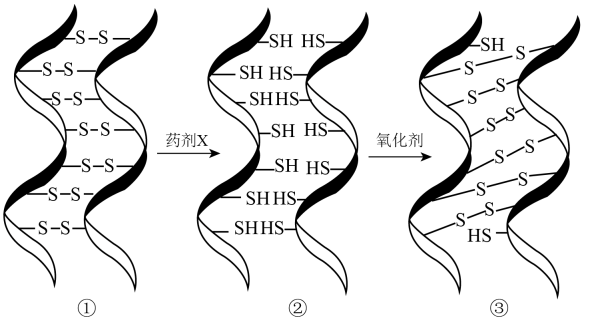 A、药剂X是还原剂 B、头发灼烧时会产生类似烧焦羽毛的特殊气味 C、①→②过程发生了化学键的断裂和形成 D、②→③过程若氧化剂是 , 其还原产物为14. 某课外实验小组在条件下,利用压强传感器等数字化实验设备,探究镁与不同浓度盐酸的反应速率,两组实验所用试剂和实验结果如下:
A、药剂X是还原剂 B、头发灼烧时会产生类似烧焦羽毛的特殊气味 C、①→②过程发生了化学键的断裂和形成 D、②→③过程若氧化剂是 , 其还原产物为14. 某课外实验小组在条件下,利用压强传感器等数字化实验设备,探究镁与不同浓度盐酸的反应速率,两组实验所用试剂和实验结果如下:序号
镁条的质量/g
盐酸
实验结果
物质的量浓度/
体积/
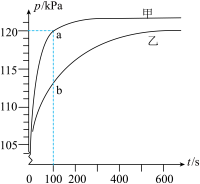
1
0.01
1.0
2
2
0.01
0.5
2
下列说法错误的是( )
A、理论上两组实验最终生成相同物质的量的气体 B、曲线甲所示内的平均反应速率为 C、曲线乙b点的斜率可表征该反应在时的瞬时速率 D、曲线甲表示使用盐酸时的压强随时间的变化15. 可用作脱除气体的脱硫剂,其脱硫和再生的反应过程如下图所示。下列说法错误的是( )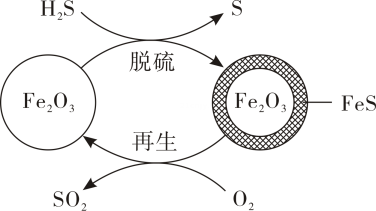 A、脱硫时还原了部分 , 生成S和 B、脱硫时若参加反应,转移 C、再生时氧气浓度越大,所得脱硫剂脱硫效果越好 D、再生过程可表示为
A、脱硫时还原了部分 , 生成S和 B、脱硫时若参加反应,转移 C、再生时氧气浓度越大,所得脱硫剂脱硫效果越好 D、再生过程可表示为二、填空题
-
16. 电池是人类生产和生活中的重要能量来源。回答下列问题:
Ⅰ.硅是太阳能电池的重要材料,工业制备高纯硅的主要过程如下:
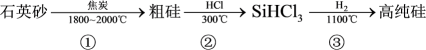
反应②、③的能量变化如右图所示。
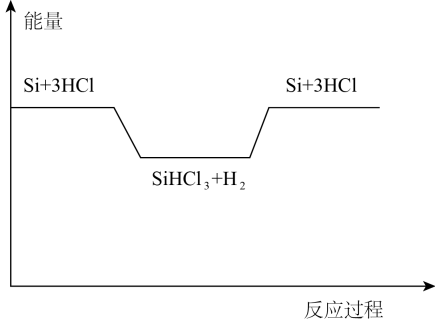 (1)、硅在元素周期表中的位置是。(2)、反应①还生成了可燃性气体,其化学方程式为。(3)、反应②是反应(填“放热”或“吸热”)。已知与结构相似,反应③生成时有化学键断裂。(4)、Ⅱ.某种燃料电池的工作原理如图所示,a、b均为铂电极。
(1)、硅在元素周期表中的位置是。(2)、反应①还生成了可燃性气体,其化学方程式为。(3)、反应②是反应(填“放热”或“吸热”)。已知与结构相似,反应③生成时有化学键断裂。(4)、Ⅱ.某种燃料电池的工作原理如图所示,a、b均为铂电极。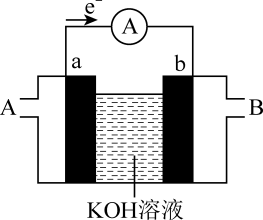
电池工作时,电解质溶液中向极迁移(填“a”或“b”),当有发生迁移,消耗的体积为L(标准状况下)。
(5)、若该电池是氢氧燃料电池,则通入氢气端是(填“A”或“B”)。三、有机推断题
-
17. 乙烯是重要的化工原料,以下合成路线中F是有机高分子。
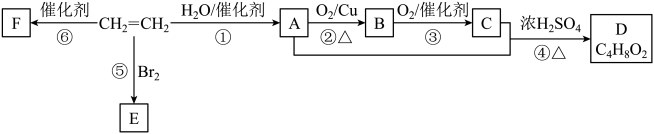
回答下列问题:
(1)、A中官能团的名称为 , E的分子式为。(2)、①~⑤反应中,属于加成反应的有(填标号)。(3)、F的结构简式为。(4)、④的化学方程式为。该反应是可逆反应,下列说法正确的是(填标号)。a.若用标记A中氧原子,则D中含有
b.用饱和氢氧化钠溶液可以去除D中混有的A和C
c.单位时间内,生成同时生成 , 说明反应达到平衡状态
d.等物质的量的B和D充分燃烧,消耗氧气的物质的量相等
四、实验题
-
18. 某兴趣小组同学探究了下列两类实验课题:(1)、
Ⅰ.利用下图实验装置进行气体的制备实验
实验室制取 , 可选用的装置为(填标号)。 (2)、用装置C制取的化学方程式为。(3)、Ⅱ.铜及其化合物在实验中的应用
(2)、用装置C制取的化学方程式为。(3)、Ⅱ.铜及其化合物在实验中的应用铜与浓硝酸反应的装置如下图,仪器D的名称为 , 该反应的离子方程式为。
 (4)、按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。
(4)、按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。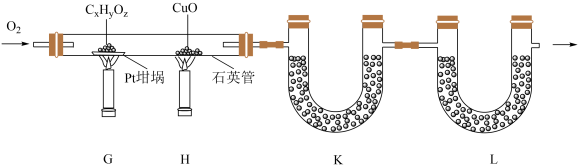
①将装有样品的坩埚和放入石英管中,先 , 而后将已称重的U型管K、L与石英管连接,检查 , 依次点燃煤气灯进行实验。
②的作用是(举1例,用化学方程式表示)。
③K和L中的试剂分别是、(填标号)。
A.无水 B. C.碱石灰 D.
五、工业流程题
-
19. 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备的一种流程如下:
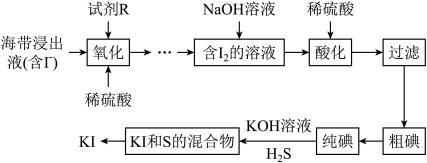
回答下列问题:
(1)、“酸化”时稀硫酸的作用是。(2)、分离和S的混合物得到溶液的试剂和方法如下,正确的是(填标号)。选项
试剂
方法
a
二硫化碳
分液
b
酒精
分液
c
溶液
过滤
(3)、利用下图装置完成与反应制备。
①溶液的作用是(用离子方程式表示)。
②三颈烧瓶中产生的正确操作顺序为(填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入溶液
(4)、产品纯度测定。准确称取样品溶于水配成溶液,量取溶液于锥形瓶中,加入足量用稀硫酸酸化的溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用标准溶液反应至完全(还原产物只有),消耗标准溶液。该产品的纯度为(用含w,V的式子表示)。
-
-
-