(五四制鲁教版)2023-2024学年度八年级下学期期末复习化学试题精编卷
试卷更新日期:2023-09-18 类型:期末考试
一、选择题(每小题3分,共36分)
-
1. 2022年6月5日是第50个世界环境日,中国主题是“共建清洁美丽世界”,旨在进一步深化“绿水青山就是金山银山”的发展理念。下列做法不符合这一主题的是( )A、开发新能源,替代化石燃料,实现节能减排 B、使用可降解塑料,减少白色污染 C、大力提倡农作物秸秆就地焚烧,为土壤提供肥料 D、积极植树造林,严禁乱砍乱伐,促进达成“碳中和”目标2. 下列关于物质用途的描述不正确的是( )A、氧气可用作燃料 B、稀有气体可用作电光源 C、干冰可用作制冷剂 D、氮气可用作焊接金属时的保护气3. 在实验室制取和收集气体的四种装置中,下列用法不正确的是( )A、可制取O2
 B、可制取CO2
B、可制取CO2 C、可收集CO2
C、可收集CO2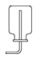 D、可收集O2
D、可收集O2 4. 下列说法正确的是( )A、将CO2通入紫色石蕊溶液中,溶液变红,说明二氧化碳能使石蕊变红 B、向装满二氧化碳的软塑料瓶中倒少量的水并迅速盖紧瓶盖振荡,发现塑料瓶变瘪了,说明二氧化碳能与水反应 C、鱼能在水中生存,说明氧气易溶于水 D、含碳元素的物质充分燃烧能生成二氧化碳,因此燃烧能生成二氧化碳的物质中一定含碳元素5. 下列叙述中,不合理的是( )A、控制燃烧条件可达到灭火的目的 B、一氧化碳和二氧化碳组成元素相同,化学性质也相同 C、化学反应前后元素的种类不变 D、原子是由原子核和核外电子构成的6. 区分H2、CO、CH4的最佳方法是( )A、点燃后观察火焰的颜色 B、检验三种气体燃烧后的产物 C、闻三种气体的气味 D、测三种气体的溶解性7. 两份质量相等的碳酸钙,一份充分煅烧,另一份与足量的稀盐酸充分反应,两种方法得到的二氧化碳的质量( )A、一样多 B、与稀盐酸反应得到的多 C、煅烧后得到的多 D、无法判断8. 一定条件下,在一密闭容器内发生某反应,测得反应过程中各物质的质量数据如表所示:
4. 下列说法正确的是( )A、将CO2通入紫色石蕊溶液中,溶液变红,说明二氧化碳能使石蕊变红 B、向装满二氧化碳的软塑料瓶中倒少量的水并迅速盖紧瓶盖振荡,发现塑料瓶变瘪了,说明二氧化碳能与水反应 C、鱼能在水中生存,说明氧气易溶于水 D、含碳元素的物质充分燃烧能生成二氧化碳,因此燃烧能生成二氧化碳的物质中一定含碳元素5. 下列叙述中,不合理的是( )A、控制燃烧条件可达到灭火的目的 B、一氧化碳和二氧化碳组成元素相同,化学性质也相同 C、化学反应前后元素的种类不变 D、原子是由原子核和核外电子构成的6. 区分H2、CO、CH4的最佳方法是( )A、点燃后观察火焰的颜色 B、检验三种气体燃烧后的产物 C、闻三种气体的气味 D、测三种气体的溶解性7. 两份质量相等的碳酸钙,一份充分煅烧,另一份与足量的稀盐酸充分反应,两种方法得到的二氧化碳的质量( )A、一样多 B、与稀盐酸反应得到的多 C、煅烧后得到的多 D、无法判断8. 一定条件下,在一密闭容器内发生某反应,测得反应过程中各物质的质量数据如表所示:物质
甲
乙
丙
丁
反应前的质量/g
12
26
33
0
反应后的质量/g
9
22
3
a
下列说法正确的是( )
A、a等于10 B、该反应为分解反应 C、丙一定为催化剂 D、丁一定是化合物9. 建立模型是学习化学的重要方法。下列有关模型不正确的是( )A、灭火方法模型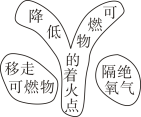 B、原子结构模型
B、原子结构模型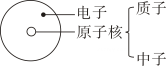 C、空气组成模型
C、空气组成模型 D、物质分类模型
D、物质分类模型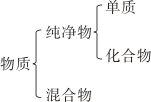 10. 推理是学习化学的一种重要方法,必须严谨、科学。下列推理正确的是( )A、氧化物中一定含有氧元素,则含有氧元素的化合物一定是氧化物 B、同种元素的原子具有相同的质子数,所以具有相同质子数的原子属于同种元素 C、燃烧都伴有发光、放热现象,所以有发光、放热现象的一定是燃烧 D、单质是由同种元素组成的物质,所以由同种元素组成的物质一定是单质11. 模型认知是化学研究的重要科学方法。如图是工业制取硝酸第一步反应的微观示意图。下列说法不正确的是( )
10. 推理是学习化学的一种重要方法,必须严谨、科学。下列推理正确的是( )A、氧化物中一定含有氧元素,则含有氧元素的化合物一定是氧化物 B、同种元素的原子具有相同的质子数,所以具有相同质子数的原子属于同种元素 C、燃烧都伴有发光、放热现象,所以有发光、放热现象的一定是燃烧 D、单质是由同种元素组成的物质,所以由同种元素组成的物质一定是单质11. 模型认知是化学研究的重要科学方法。如图是工业制取硝酸第一步反应的微观示意图。下列说法不正确的是( )
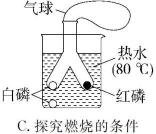
 A、生成的丙、丁的分子个数比为1∶1 B、参加反应的甲、乙的质量比为17∶40 C、反应前后金属铂的质量和化学性质不变 D、丙是空气污染物之一12. 已知白磷的着火点是40 ℃,红磷的着火点是240 ℃。如图实验,三支试管里面充满氮气,初始温度25 ℃,升温至60 ℃后,用注射器同时向②③试管中迅速注入足量氧气。下列说法有误的是( )
A、生成的丙、丁的分子个数比为1∶1 B、参加反应的甲、乙的质量比为17∶40 C、反应前后金属铂的质量和化学性质不变 D、丙是空气污染物之一12. 已知白磷的着火点是40 ℃,红磷的着火点是240 ℃。如图实验,三支试管里面充满氮气,初始温度25 ℃,升温至60 ℃后,用注射器同时向②③试管中迅速注入足量氧气。下列说法有误的是( )
 A、只有②中有燃烧现象 B、由①②现象说明可燃物达着火点未必燃烧 C、若继续水浴升温,则③中一定会燃烧 D、该实验能总结出燃烧的条件
A、只有②中有燃烧现象 B、由①②现象说明可燃物达着火点未必燃烧 C、若继续水浴升温,则③中一定会燃烧 D、该实验能总结出燃烧的条件二、填空题(共45分)
-
13. 日常生活生产中,往往蕴含了许多化学知识。请根据要求回答下列问题。(1)、自来水厂常用二氧化氯(ClO2)作水处理消毒剂,二氧化氯中氯元素的化合价是。(2)、常见钙片中含有的碳酸钙与胃酸(主要成分为盐酸)反应,可以转化为能被人体吸收的氯化钙,反应原理为(用化学方程式表示)。(3)、我国具有丰富的煤炭资源,煤制取乙二醇的产业化发展已列入我国石化产业调整和振兴规划。由煤制取乙二醇的流程示意图为:
煤 合成气(CO和H2)乙二醇
①煤属于(填“可再生”或“不可再生”)资源;
②合成气可用作气体燃料,写出合成气中氢气燃烧的化学方程式:;
③合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质,从物质组成的角度考虑,仅用合成气为原料不可能得到的物质是(填字母序号)。
A.甲醇(CH3OH) B.乙醇(C2H5OH) C.尿素[CO(NH2)2]
14. 空气是一种重要资源。(1)、如图1所示装置可测定空气中氧气的含量。用注射器抽取30 mL空气,硬质玻璃管的容积为 50 mL,在硬质玻璃管中放入过量的铜粉,在右侧玻璃管口套上瘪的气球,点燃酒精灯,反复推拉注射器活塞,待反应结束后,冷却至室温。
①实验时,铜粉过量的目的是。
②冷却后,理论上注射器内剩余气体的体积约为mL。
(2)、利用空气制取氮肥(尿素)的流程如图2所示。(煤的主要成分是碳)
①Ⅰ中参加反应的单质甲为 , 请写出Ⅲ中发生反应的化学方程式:。
②已知常压下,液氮的沸点为-196 ℃,液氧的沸点为-183 ℃。若将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是。
(3)、汽车尾气催化转化器的投入使用,大大降低了空气污染。请在图3方框中,把转化器中某转化反应(4CO+2NO2 4CO2+N2)的微观粒子补充完整。 15. 实验是进行科学探究的重要手段。请根据图示信息回答下列问题。
15. 实验是进行科学探究的重要手段。请根据图示信息回答下列问题。

 (1)、实验A发生反应的化学方程式是。当电源接通一段时间后,a管与b管中气体的体积比约为。(2)、实验B中加入活性炭,是利用其性除去水中的颜色和异味。(3)、信息提示:白磷着火点是40 ℃,红磷着火点是240 ℃~260 ℃。实验C中红磷不能燃烧的原因是。(4)、实验D结束后,打开止水夹,通过进入集气瓶中水的体积约为集气瓶上方空气总体积的五分之一的现象,可得出的结论。16. 甲、乙、丙、丁均为初中化学常见的物质,且含有一种相同的元素。其中甲和乙的组成元素种类相同,固态的乙俗称干冰,丙是石灰石的主要成分,丁是常见的液体,也是相对分子质量最小的氧化物,它们之间的转化关系如图所示。
(1)、实验A发生反应的化学方程式是。当电源接通一段时间后,a管与b管中气体的体积比约为。(2)、实验B中加入活性炭,是利用其性除去水中的颜色和异味。(3)、信息提示:白磷着火点是40 ℃,红磷着火点是240 ℃~260 ℃。实验C中红磷不能燃烧的原因是。(4)、实验D结束后,打开止水夹,通过进入集气瓶中水的体积约为集气瓶上方空气总体积的五分之一的现象,可得出的结论。16. 甲、乙、丙、丁均为初中化学常见的物质,且含有一种相同的元素。其中甲和乙的组成元素种类相同,固态的乙俗称干冰,丙是石灰石的主要成分,丁是常见的液体,也是相对分子质量最小的氧化物,它们之间的转化关系如图所示。
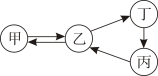 (1)、乙的化学式是; 乙→甲的化学反应类型属于;丙→丁的化学方程式为;(2)、从微观角度解释甲、乙性质有差异的原因:。
(1)、乙的化学式是; 乙→甲的化学反应类型属于;丙→丁的化学方程式为;(2)、从微观角度解释甲、乙性质有差异的原因:。三、实验探究题(共12分)
-
17. 制取气体是初中化学实验的重要内容,根据要求回答下列问题。(浓硫酸可用来干燥某些气体)
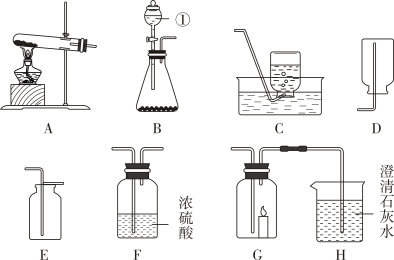 (1)、写出标有序号的仪器名称:①。(2)、实验室利用大理石和稀盐酸反应制取二氧化碳,可选择的发生装置是(填字母序号,下同)。(3)、若要得到干燥的氧气,所选择装置的连接顺序为B→→。(4)、某气体只能用C装置收集,则该气体可能具有的性质为。
(1)、写出标有序号的仪器名称:①。(2)、实验室利用大理石和稀盐酸反应制取二氧化碳,可选择的发生装置是(填字母序号,下同)。(3)、若要得到干燥的氧气,所选择装置的连接顺序为B→→。(4)、某气体只能用C装置收集,则该气体可能具有的性质为。a.能与水反应
b.能与空气中的某些成分发生反应
c.密度与空气接近
(5)、某兴趣小组的同学连接B、G、H装置进行实验。若实验时G装置中蜡烛燃烧更剧烈,H装置中溶液变浑浊,则B装置中反应的化学方程式为。四、计算题(共7分)
-
18. 为了测定某矿样石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中其他成分不与稀盐酸反应也不溶于水)。实验数据如下:
反应前
反应后
烧杯和稀盐酸的质量
石灰石样品的质量
烧杯和其中混合物的质量
150 g
12 g
157.6 g
(1)、生成二氧化碳的质量为g。(2)、求该石灰石样品中碳酸钙的质量分数。
-