(五四制鲁教版)2023-2024学年度九年级下学期期末复习化学试题精编卷
试卷更新日期:2023-09-18 类型:期末考试
一、选择题(每小题3分,共30分)
-
1. 物质的性质决定物质的用途。下列物质的用途和性质不对应的是( )A、铜的导电性好——作导线 B、银导热性好——作装饰品 C、钨的熔点高——作灯丝 D、氮气化学性质稳定——作保护气2. 氯胺酮(C13H16NClO)俗称“K粉”,是一种麻醉药,可使人产生依赖性。下列说法错误的是( )A、氯胺酮被非法使用,会成为毒品 B、坚决不能因好奇尝试吸食“K粉” C、氯胺酮由32个原子构成 D、氯胺酮中氮、氢元素的质量比为7∶83. 分类法是化学学习的重要方法。下列说法不正确的是( )A、生石灰、烧碱、浓硫酸都可用作干燥剂 B、铁、锌、碘等元素都属于人体必需的微量元素 C、NH4NO3、(NH4)2SO4、CO(NH2)2都属于铵态氮肥 D、纯金、青铜、不锈钢都属于金属材料4. 合理膳食是人体健康的重要保证。下列说法错误的是( )A、水是六大基本营养素之一 B、糖类是人体能量的主要来源 C、每天应摄入一定量的蛋白质 D、绿色食品是指颜色为绿色的水果和蔬菜5. “雪容融”是2022年北京冬季残奥会的吉祥物。某款“雪容融”玩具的外用材料为纯羊毛,内充物为聚酯纤维。下列说法错误的是( )A、羊毛属于天然纤维 B、聚酯纤维属于合成材料 C、可用灼烧法鉴别纯羊毛和聚酯纤维 D、用洗涤剂清洗玩具上的油污是溶解作用6. 化学无处不在,使我们的生活变得多姿多彩。下列说法错误的是( )A、人体无法消化吸收纤维素,所以食物中的纤维素对人体毫无意义 B、蛋白质是构成人体细胞的基础物质,是人体生长所需要的主要营养物质 C、绿色化学有助于人类解决环境污染问题,实现人与自然和谐相处 D、磷酸二氢铵和硝酸钾是两种常用的复合肥料7. 北京冬奥会火炬采用氢气作燃料,火炬燃烧罐以碳纤维材质为主,未来世界将进入氢能源时代。固体MgH2作为一种储氢介质,遇水时可生成氢氧化镁并放出氢气。以下说法错误的是( )A、氢气是理想的清洁、高能燃料 B、碳纤维是一种新型的化合物 C、MgH2中氢元素的化合价为-1价 D、MgH2与水反应的化学方程式为MgH2+2H2O= Mg(OH)2+2H2↑8. 现有X、Y、Z三种金属,其中只有金属 X 常温下能被空气氧化;把金属Y、Z分别放入CuSO4溶液中,只有金属Y表面析出红色固体。下列推测不合理的是( )A、金属X不可能是金(Au) B、金属活动性由强至弱依次为Y、Z、X C、金属Z可能是银(Ag) D、金属Y放入金属Z的盐溶液中会有固体析出9. 下列实验方案不能达到实验目的的是( )
实验目的
实验方案
A
除去CO2中混有的少量CO
点燃混合气体
B
除去铜粉中的铁粉
加入过量的稀盐酸充分反应,过滤,洗涤,干燥
C
除去FeCl2溶液中的CuCl2杂质
加入过量的铁屑充分反应,过滤
D
除去N2中少量的O2
将混合气体通过灼热的铜丝网
A、A B、B C、C D、D10. 在学习了金属的化学性质后,某化学兴趣小组的同学对镁和稀盐酸的反应进行了探究,通过观察气泡产生的快慢,画出如图所示的图像。以下对图像分析错误的是( )
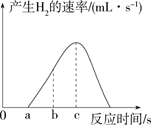 A、a时刻镁和稀盐酸开始反应 B、b→c过程中反应速率逐渐增大 C、c时刻后反应速率减小的原因是稀盐酸的浓度逐渐减小 D、c时刻溶液的温度最高
A、a时刻镁和稀盐酸开始反应 B、b→c过程中反应速率逐渐增大 C、c时刻后反应速率减小的原因是稀盐酸的浓度逐渐减小 D、c时刻溶液的温度最高二、填空及简答题(化学方程式每空2分,其余每空1分,共35分)
-
11. 工艺制造在我国具有悠久的历史。根据题意回答下列问题。(1)、传统陶瓷大多是将黏土与水混合再高温烧结而成。黏土的组成元素主要来自地壳中含量居前三位的元素,其中一种元素含量仅次于氧,它是(填元素符号)。(2)、制造水泥的主要原料是石灰石和黏土,石灰石煅烧时变成生石灰,与水混合生成的水合物逐渐硬化。生石灰与水反应的化学方程式为 , 该反应会(填“吸收”或“放出”)热量。(3)、制造玻璃的原料有纯碱、石灰石和石英砂等。实验室有许多仪器由玻璃制造,如玻璃棒,过滤时玻璃棒的作用是;如漏斗,其用于过滤时应注意的事项有(写一点)。12. 2022年10月10日上午,潍烟铁路招远高铁站主体结构封顶。(1)、铁路建设中使用大量材料:铺路基的石子、垫在石子上的钢筋水泥柱、铁轨等,其中钢筋水泥柱属于材料。(2)、施工建设中为焊接铁轨中的缝隙,可点燃铝和氧化铁(Fe2O3)的混合物,铝和氧化铁在高温下反应生成氧化铝和熔融状态下的铁。反应的化学方程式为 , 该反应的基本反应类型为
反应。若用10.8 kg铝与氧化铁反应来制取铁,理论上能生成铁 kg。
(3)、高铁列车上提供下列食品:纯净水、橙汁、牛奶、饼干、啤酒等,上述食品中含有丰富蛋白质的是。(4)、由于高铁列车车厢是密闭的空间,因此提供清洁的空气、保持车厢的卫生非常重要。①高铁上通常用高铁酸钠(Na2FeO4)来净化环境,它是一种常用的“绿色、环保、高效”消毒剂。高铁酸钠中铁元素的化合价为。
②下面是一种制备高铁酸钠的反应原理:Fe2O3+3NaNO3+4NaOH= 2Na2FeO4+3NaNO2+2X,X的化学式为。
③某品牌的空气净化剂含有过氧化钠(Na2O2),它可以使车厢里的二氧化碳转化为碳酸钠和氧气,写出其反应的化学方程式:。
13. 粮食安全是“国之大者”。(1)、守住良田沃土,保障粮食安全。①土壤酸化不利于农作物生长。要改良酸化土壤,可选用的物质为(填字母)。
A.KNO3 B.熟石灰 C.稀硫酸
②某农田改良后pH为5.4,该地区常见农作物最适宜生长的土壤pH范围如下:
农作物
茶树
油菜
水稻
萝卜
pH
5.0~5.5
5.8~6.7
6.0~7.0
7.0~7.5
该农田适合种植的农作物是。
③化肥和农药对农业增产有重要作用。下列说法不正确的是
(填字母)。
A.铵态氮肥不能与草木灰混用
B.磷酸二氢铵(NH4H2PO4)属于复合肥料
C.为增加农作物产量,大量使用化肥和农药
④碳酸氢铵(NH4HCO3)需密封保存于阴凉处,用化学方程式解释原因:。
(2)、科技创新,开辟产粮新路径。我国科学家利用CO2合成葡萄糖,该方案先用碳电还原法将CO2转化为醋酸,再利用微生物发酵获得葡萄糖。

①将CO2资源化利用,可减缓效应。
②通电条件下,装置1中CO2分解成CO和常见单质X,X的化学式为。
③利用酵母菌等微生物将醋酸转化为葡萄糖时,温度不宜过高,原因是。
④理论上合成葡萄糖所需CO2与H2O的质量比为。
14. 豆浆是中国人民喜爱的一种饮品,又是一种老少皆宜的营养食品,在欧美享有“植物奶”的美誉。下表为每百克豆浆所含部分营养成分:每100 g豆浆所含部分营养成分
糖类(克)
1.10
维生素A
(微克)
15.00
钾
(毫克)
48.00
脂肪
(克)
0.70
维生素E
(毫克)
0.80
钠
(毫克)
3.00
蛋白质
(克)
1.80
胡萝卜素
(微克)
90.00
镁
(毫克)
9.00
钙(毫克)
10.00
铁
(毫克)
0.50
锌
(毫克)
0.24
铜
(毫克)
0.07
锰
(毫克)
0.09
磷
(毫克)
30.00
硒(微克)
0.14
请回答:
(1)、 上表中属于常量元素的有(填元素符号)。(2)、表中能为人体提供能量的营养素是 , 它们在人体内分解、氧化的过程,是将能转化为能;表中虽然没有列出,但实际豆浆中含有的营养素还有。(3)、豆浆中钙含量丰富,非常适合老年人饮用,长期饮用对预防老年人的(填“骨质疏松”或“佝偻病”)很有效果;这里的“钙”是指(填“元素”“原子”或“离子”);豆浆对贫血病人的调养作用比牛奶要强,是因为(填化学符号)的含量比牛奶高。(4)、维生素A可以预防眼部疾病,维生素A包括A1和A2两种物质,其化学式分别为C20H30O和C20H28O,维生素A1和A2的相同,分子构成不同。(5)、小明同学通过化学课知道,人们误食重金属盐(如硫酸铜、氯化钡等)后可通过喝大量生豆浆的方法解毒,你认为(填序号)也可以达到同样的目的。①牛奶 ②果汁 ③蛋清 ④矿泉水 ⑤食盐水
三、实验探究题(化学方程式每空2分,其余每空1分,共22分)
-
15. 实验是科学探究的重要方式,请结合图示回答下列问题:
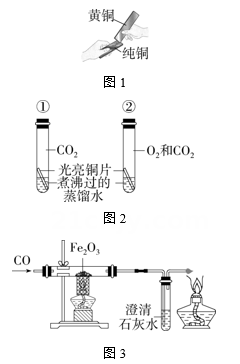 (1)、图1是某同学将外形完全相同的纯铜片和黄铜片相互刻划,该实验的目的是比较纯铜和黄铜的大小,留下明显划痕的是。(2)、图2所示装置是探究铜生锈的部分实验。铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],一段时间后,试管①中铜片保持光亮,试管②中铜片出现绿色锈渍。对比实验现象得出的结论是。(3)、图3是一氧化碳还原氧化铁的实验装置图。实验过程中玻璃管内出现的现象是 , 发生反应的化学方程式是。(4)、图4是四种金属活动性顺序的探究实验。
(1)、图1是某同学将外形完全相同的纯铜片和黄铜片相互刻划,该实验的目的是比较纯铜和黄铜的大小,留下明显划痕的是。(2)、图2所示装置是探究铜生锈的部分实验。铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3],一段时间后,试管①中铜片保持光亮,试管②中铜片出现绿色锈渍。对比实验现象得出的结论是。(3)、图3是一氧化碳还原氧化铁的实验装置图。实验过程中玻璃管内出现的现象是 , 发生反应的化学方程式是。(4)、图4是四种金属活动性顺序的探究实验。

运用控制变量法设计实验方案是化学研究的重要方法。在A、B、C三个实验中,需要控制的实验条件除了金属与稀硫酸的接触面积、稀硫酸的体积、温度以外,还需要控制的条件是;写出试管E中发生反应的化学方程式:;试管D中产生的现象为;大家认为从中选择四个实验即可验证锌、铁、铜、银的金属活动性顺序,这四个实验的两种组合是、。
16. 红枣包装中常使用的袋装防腐剂的品名为“504双吸剂”,其标签如图1所示,同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁溶液。
(1)、【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。久置固体中可能含有Ca(OH)2的原因是①(用化学方程式表示)。(2)、【实验探究1】甲同学的方案:实验操作
实验现象
实验结论
取少量固体置于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞试液
固体溶解时试管外壁发烫;试管底部有不溶物;溶液变红
固体中一定含有②和Ca(OH)2
另取少量固体置于试管中,滴加足量稀盐酸
固体逐渐消失,有大量气泡产生,得到浅绿色溶液
固体中一定含有Fe,一定不含Fe2O3
将步骤(2)中产生的气体通入澄清的石灰水中
③
固体中一定含有CaCO3
(3)、【实验质疑】乙同学认为甲同学的实验并不能得出一定含Ca(OH)2的结论,理由是④。
(4)、丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是⑤(用化学方程式表示)。(5)、【实验探究2】乙、丙同学设计如图2所示的实验方案继续验证:

通过乙、丙同学的实验能得出固体样品中一定还含有⑥。(6)、乙、丙同学经过实验测得上述滤渣C(CaCO3)的质量为1.0 g,则滤液A中含氢氧化钙的质量为⑦。(7)、【实验结论】综合上述实验分析,久置固体中一定含有⑧。
四、计算题(共13分)
-
17. 为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入92g稀硫酸,恰好完全反应,测得剩余固体的质量为2g(杂质不溶于水也不与酸反应)。(1)、样品中Fe2O3的质量为g。(2)、计算反应后所得溶液中溶质的质量分数(要求写出计算过程)。