沪教版初中化学2023-2024学年九年级上学期第5章 金属的冶炼与利用素养检测
试卷更新日期:2023-09-18 类型:单元试卷
一、选择题(每小题4分,共48分)
-
1. 下列生活用品,利用金属导电性的是( )A、铁锅 B、铜导线 C、铝箔包装纸 D、金饰品2. 常温下为紫红色固体的是( )A、锌 B、铁 C、铜 D、银3. 无人机的用途越来越广泛,可以用于航拍、喷洒农药等。制无人机框架宜选用密度小、强度高、硬度较大,化学稳定性好的金属材料,下列材料中最适合做无人机框架的是( )
 A、生铁 B、黄铜 C、铝合金 D、纯铝4. 下列反应中,属于置换反应的是( )A、CaCO3+H2O+CO2= Ca(HCO3)2 B、CuCl2 Cu+Cl2↑ C、3CO+Fe2O3 2Fe+3CO2 D、CuSO4+Fe= FeSO4+Cu5. 北斗系统的全面建成彰显了中国航天的力量。在航天科技中运用了大量金属材料,下列有关金属材料的说法正确的是( )A、合金中一定只含金属元素 B、金属单质在常温下都是固体 C、生铁和钢都是铁的合金,且生铁的含碳量更高 D、纯金属的硬度一般比它们组成的合金硬度更大6. 如图所示,两只燃烧匙里装有相同质量的镁粉与锌粉,分别在空气中加热燃烧,根据燃烧难易及剧烈程度不同,可推测镁与锌具有不同的( )
A、生铁 B、黄铜 C、铝合金 D、纯铝4. 下列反应中,属于置换反应的是( )A、CaCO3+H2O+CO2= Ca(HCO3)2 B、CuCl2 Cu+Cl2↑ C、3CO+Fe2O3 2Fe+3CO2 D、CuSO4+Fe= FeSO4+Cu5. 北斗系统的全面建成彰显了中国航天的力量。在航天科技中运用了大量金属材料,下列有关金属材料的说法正确的是( )A、合金中一定只含金属元素 B、金属单质在常温下都是固体 C、生铁和钢都是铁的合金,且生铁的含碳量更高 D、纯金属的硬度一般比它们组成的合金硬度更大6. 如图所示,两只燃烧匙里装有相同质量的镁粉与锌粉,分别在空气中加热燃烧,根据燃烧难易及剧烈程度不同,可推测镁与锌具有不同的( )
 A、颜色 B、熔点 C、金属延展性 D、金属活动性7. 春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1 000 ℃左右的温度下使Fe2O3发生一系列反应生成含较多杂质的海绵铁。其中主要化学反应为3CO+Fe2O3 2Fe+3CO2。下列说法正确的是( )A、海绵铁是一种纯净物 B、Fe2O3中铁元素的质量分数为70% C、上述反应中涉及的氧化物只有2种 D、炼铁过程中,木炭只是作为燃料使用8. 用如图所示装置进行实验,倾斜Y形管,锌粒与硫酸铜溶液接触,表面有气泡产生并析出红色物质,溶液颜色变浅,经检测产生的气体为氢气。下列说法正确的是( )
A、颜色 B、熔点 C、金属延展性 D、金属活动性7. 春秋初期,绍兴一带是南方的一个冶铁中心,其炼铁方法是在1 000 ℃左右的温度下使Fe2O3发生一系列反应生成含较多杂质的海绵铁。其中主要化学反应为3CO+Fe2O3 2Fe+3CO2。下列说法正确的是( )A、海绵铁是一种纯净物 B、Fe2O3中铁元素的质量分数为70% C、上述反应中涉及的氧化物只有2种 D、炼铁过程中,木炭只是作为燃料使用8. 用如图所示装置进行实验,倾斜Y形管,锌粒与硫酸铜溶液接触,表面有气泡产生并析出红色物质,溶液颜色变浅,经检测产生的气体为氢气。下列说法正确的是( )
 A、锌粒参加的反应均为置换反应 B、硫酸铜溶液所含阳离子只有Cu2+ C、可推知金属活动性顺序:铜>锌 D、若用银片代替锌粒,可观察到相似实验现象9. 兴趣小组同学设计图示装置进行“一氧化碳还原氧化铁”及产物检验的实验。资料:HCOOH(甲酸) CO↑+H2O。下列说法不正确的是( )
A、锌粒参加的反应均为置换反应 B、硫酸铜溶液所含阳离子只有Cu2+ C、可推知金属活动性顺序:铜>锌 D、若用银片代替锌粒,可观察到相似实验现象9. 兴趣小组同学设计图示装置进行“一氧化碳还原氧化铁”及产物检验的实验。资料:HCOOH(甲酸) CO↑+H2O。下列说法不正确的是( ) A、在制一氧化碳的过程中,浓硫酸作为催化剂,质量保持不变 B、用磁铁吸引黑色固体进入a处,可以证明铁的存在 C、d处万用瓶的作用较多,可起到安全、环保及初步判断反应的发生与结束的作用 D、实验前,在a处的左端添加注射器向装置中推入空气,通过观察万用瓶中是否有气泡来检查气密性10. 如图,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆中央且可随杠杆左右转动。杠杆两端分别悬挂等质量、等体积的铁球,此时杠杆平衡,再将铁球同时分别浸没到密度相等的稀硫酸和硫酸铜溶液中一段时间(忽略铁球体积变化)。下列说法错误的是( )
A、在制一氧化碳的过程中,浓硫酸作为催化剂,质量保持不变 B、用磁铁吸引黑色固体进入a处,可以证明铁的存在 C、d处万用瓶的作用较多,可起到安全、环保及初步判断反应的发生与结束的作用 D、实验前,在a处的左端添加注射器向装置中推入空气,通过观察万用瓶中是否有气泡来检查气密性10. 如图,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆中央且可随杠杆左右转动。杠杆两端分别悬挂等质量、等体积的铁球,此时杠杆平衡,再将铁球同时分别浸没到密度相等的稀硫酸和硫酸铜溶液中一段时间(忽略铁球体积变化)。下列说法错误的是( )
 A、用金属制作滑片利用了金属的导电性 B、左边溶液中有气泡生成 C、小灯泡L会逐渐变暗 D、两侧发生的反应所属的基本反应类型相同11. 某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是( )
A、用金属制作滑片利用了金属的导电性 B、左边溶液中有气泡生成 C、小灯泡L会逐渐变暗 D、两侧发生的反应所属的基本反应类型相同11. 某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是( )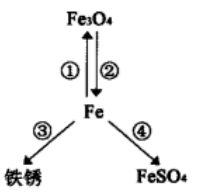 A、铁丝能在空气中剧烈燃烧实现转化① B、转化②可通过Fe3O4与CO发生置换反应实现 C、氧气和水同时存在是实现转化③的主要条件 D、通过Fe与ZnSO4溶液反应可实现转化④12. 下列说法正确的是 ( )A、
A、铁丝能在空气中剧烈燃烧实现转化① B、转化②可通过Fe3O4与CO发生置换反应实现 C、氧气和水同时存在是实现转化③的主要条件 D、通过Fe与ZnSO4溶液反应可实现转化④12. 下列说法正确的是 ( )A、 用水银体温计测量体温时,温度升高,原子变大
B、
用水银体温计测量体温时,温度升高,原子变大
B、 实验a、b可得出铁生锈需要水和氧气
C、
实验a、b可得出铁生锈需要水和氧气
C、 如图可表示分别向等质量的镁和锌中滴加相同的稀盐酸
D、
如图可表示分别向等质量的镁和锌中滴加相同的稀盐酸
D、 该流程中,化学能转化为太阳能,每18 g水可制得1 g氢气
该流程中,化学能转化为太阳能,每18 g水可制得1 g氢气
二、填空题(共24分)
-
13. 金属和金属材料在生产、生活中有广泛的用途。请回答下列问题:(1)、三星堆博物馆新馆封顶,预计于2023年底对外开放。三星堆遗址出土的文物包括青铜大立人、由金箔包裹的权杖、金面具、青铜面具、玉石器、象牙、银器等,多属稀世之珍。
①下列出土文物中属于金属材料的是(填字母)。
A.青铜大立人 B.象牙
C.金面具 D.玉石器
②根据所学知识判断,青铜的硬度比纯铜(填“大”或“小”)。
(2)、铁制品锈蚀的过程,实际上是铁跟空气中的同时接触发生化学反应的过程。(3)、工业上用铁矿石、石灰石、焦炭、空气等原料在高炉中冶炼得到铁,写出高炉中用一氧化碳冶炼赤铁矿的化学方程式:。(4)、向一定质量的AgNO3和Cu(NO3)2混合溶液中逐渐加入足量的锌粒,加入锌粒的质量与溶液中溶质的种类关系如图所示。提示:锌先与AgNO3反应,后与Cu(NO3)2反应;溶质为溶液中被溶解的物质。①a点溶液中含有的溶质的化学式为。
②b点时,滤渣的成分为。
 14. 《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧,挹其水熬之则成胆矾,烹胆矾则成铜”。在西汉时期的《淮南万毕术》中就记载:“曾青(含铜的化合物)得铁则化为铜”,成为现代湿法冶金的先驱。受上述叙述的启示,某同学取苦泉水,完成以下操作:
14. 《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧,挹其水熬之则成胆矾,烹胆矾则成铜”。在西汉时期的《淮南万毕术》中就记载:“曾青(含铜的化合物)得铁则化为铜”,成为现代湿法冶金的先驱。受上述叙述的启示,某同学取苦泉水,完成以下操作:
 (1)、写出反应②制取铜的化学方程式:。(2)、固体A的成分是 , 反应③的化学方程式是。(3)、在固体A中加入试剂X,有气体产生,则试剂X的名称是 , 操作Ⅰ的名称是 , 固体A和试剂X反应的化学方程式为。
(1)、写出反应②制取铜的化学方程式:。(2)、固体A的成分是 , 反应③的化学方程式是。(3)、在固体A中加入试剂X,有气体产生,则试剂X的名称是 , 操作Ⅰ的名称是 , 固体A和试剂X反应的化学方程式为。三、实验探究题(共16分)
-
15. 在初中化学“金属的性质”中有如下实验:将无锈铁钉浸入CuSO4溶液,观察到铁钉表面出现红色物质。研究性学习小组对其展开了进一步探究。(1)、【提出问题】Al和CuSO4溶液也能发生化学反应吗?
预测Al能和CuSO4溶液反应,理由是。 (2)、【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。
(2)、【进行实验】将一端缠绕的铝丝浸入CuSO4溶液(如图),观察现象。
铝丝表面未出现红色物质,原因是。(3)、【实验改进】用砂纸将铝丝表面打磨光亮,将其浸入CuSO4溶液,观察现象。
填写实验报告单:序号
实验现象
结论与解释
①
铝丝表面有少量气泡;
铝丝周围出现蓝绿色物质
CuSO4溶液呈酸性,与Al反应产生的气体是;
蓝绿色物质成分待探究
②
24 h后,铝丝仍光亮;
48 h后,铝丝表面出现少量红色物质
红色物质是 , 说明Al能和CuSO4溶液反应,但反应较慢
③
铝丝周围溶液逐渐变成无色,铝丝以下溶液仍为蓝色;
两层溶液界面清晰
反应生成的Al2(SO4)3溶液为无色;
Al2(SO4)3溶液的密度(填“>”或“<”)CuSO4溶液
(4)、【深入探究】为研究上述异常现象,同学们查阅了相关资料,继续开展探究。资料:①Cu2(OH)2SO4呈蓝绿色,不溶于水;②Cl-可加快铝丝和其他物质的反应速率。
取出铝丝,将试管中的混合物分离得到蓝绿色固体,加入稀硫酸,固体溶解形成蓝色溶液,该反应的化学方程式为。(5)、欲加快Al和CuSO4溶液的反应,可加入的物质是(填一种即可)。(6)、【拓展应用】通过探究,同学们提出了铝制品使用的注意事项。下列食品不能长时间用铝制炊具盛放的是____(填字母)。
A、食醋 B、食用油 C、面粉 D、咸菜四、计算题(共12分)
-
16. 某黄铜合金中含有铜和锌,小明同学利用该合金与稀硫酸反应,进行了三次实验,所得的相关实验数据记录如下(实验中误差忽略不计):
实验次序
第一次
第二次
第三次
合金的质量/g
20
20
40
稀硫酸的质量/g
140
100
100
生成氢气的质量/g
0.3
0.3
0.3
(1)、根据上表数据分析,当所取合金与所用稀硫酸的质量比为(填最简整数比)时,表明合金中的锌与硫酸恰好完全反应。(2)、计算黄铜中锌的质量分数(写出计算过程)。
-