鲁教版(五四制)初中化学2023-2024学年八年级全册专项练习(八)科学探究
试卷更新日期:2023-09-14 类型:单元试卷
一、
-
1. 某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。
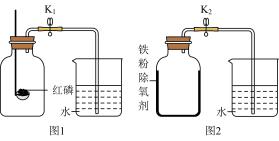
【实验1】按照图1所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
【实验2】按照图2所示装置,在集气瓶内壁均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀的原理(铁锈蚀是铁与空气中的水和氧气共同作用的结果)测定空气中氧气的体积分数。
(1)、为提高实验的准确性,以上两个实验应注意的事项是(写一点)。(2)、实验1中,红磷燃烧的化学方程式为;红磷熄灭后,集气瓶冷却至室温,打开K1 , 水能倒吸入集气瓶中的原因是。 (3)、实验前,连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图3、图4所示。依据图3、图4中的信息可知,(填“实验1”或“实验2”)的测定方法更准确,判断依据是。(4)、结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物,用图1或图2装置测定空气中氧气的体积分数,替代物应满足的条件是。2. 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,对经典实验装置进行了改进,设计出了如图1、图2所示实验装置,根据图示回答下列有关问题:
(3)、实验前,连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图3、图4所示。依据图3、图4中的信息可知,(填“实验1”或“实验2”)的测定方法更准确,判断依据是。(4)、结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物,用图1或图2装置测定空气中氧气的体积分数,替代物应满足的条件是。2. 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,对经典实验装置进行了改进,设计出了如图1、图2所示实验装置,根据图示回答下列有关问题:
【探究1】
甲同学用图1装置进行实验,操作步骤如下:
①点燃酒精灯;
②撤去酒精灯,待试管冷却后松开弹簧夹;
③将白磷装入试管中,将注射器活塞前沿置于20 mL刻度处,并按图1所示的连接方式固定好,再用弹簧夹夹紧胶皮管;
④读取注射器活塞的数据;
⑤连接仪器并检查装置的气密性。
(1)、该实验正确的实验操作顺序是(填序号)。(2)、请写出白磷燃烧的化学方程式:。(3)、已知试管的容积为50 mL,注射器前沿在20 mL处,关闭弹簧夹,对白磷进行加热,充分反应后,冷却至室温,打开弹簧夹,注射器活塞将停在mL刻度处。(4)、【探究2】乙同学按图2连接好仪器并检查装置的气密性良好后,在集气瓶中装入a体积的水,关闭弹簧夹,用预先加热的玻璃棒引燃白磷,待冷却至室温后,打开弹簧夹,量出集气瓶中水的体积为b , 整个集气瓶的容积为c。
若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系:(填序号)。
①
(5)、某同学按照图2进行“空气中氧气含量测定”的实验,下列实验操作会导致实验最后的实际值大于理论值的是(填序号)。①用碳代替白磷
②用红磷代替白磷
③没有冷却到室温就测量
④实验前弹簧夹未关闭
(6)、以上两个改进实验相比于经典实验,明显的优点在于。3. 化学兴趣小组对实验室制取氧气进行了如下探究。实验目的:探究二氧化锰在过氧化氢分解反应中的作用。
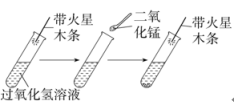
实验1:在试管中加入5 mL 5%的过氧化氢溶液,把带火星的木条伸入试管,观察现象。
实验2:向上述试管中加入少量二氧化锰粉末,把带火星的木条伸入试管,有大量气泡冒出,带火星的木条复燃。
实验3:待上述试管中没有现象发生时,重新加入过氧化氢溶液,把带火星的木条伸入试管,观察现象。(实验过程如图所示)
实验4:探究催化剂的用量对过氧化氢分解速率的影响。每次实验均用30 mL 10%的H2O2溶液,采用不同质量的MnO2粉末作催化剂,测定收集到500 mL氧气所用的时间,结果如下:
实验序号
①
②
③
④
⑤
⑥
MnO2粉末用量/g
0.1
0.2
0.3
0.4
0.5
0.6
所用时间/s
17
8
6
3
2
2
(1)、实验1中,观察到:有气泡产生,带火星的木条未复燃。原因是。(2)、写出实验2中发生反应的化学方程式:。(3)、实验3的目的是。(4)、由实验4的实验结果可得出的结论是。4. 如图是实验室气体制取和性质探究的实验装置图,回答问题:
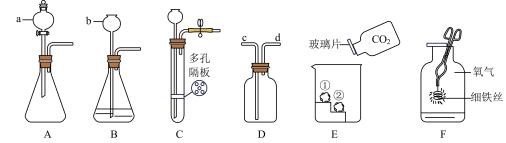 (1)、写出仪器名称:a.。(2)、实验室里常用大理石或石灰石和稀盐酸反应来制取CO2。若用装置D收集CO2 , 则CO2应从口通入(填“c”或“d”)。(3)、用装置A制取CO2 , 对比装置B的优势是;用装置C制取CO2 , 对比装置B的优势是。某同学选用装置C制取二氧化碳气体时,发现关闭弹簧夹后,固液无法分离,原因可能是(填序号)。
(1)、写出仪器名称:a.。(2)、实验室里常用大理石或石灰石和稀盐酸反应来制取CO2。若用装置D收集CO2 , 则CO2应从口通入(填“c”或“d”)。(3)、用装置A制取CO2 , 对比装置B的优势是;用装置C制取CO2 , 对比装置B的优势是。某同学选用装置C制取二氧化碳气体时,发现关闭弹簧夹后,固液无法分离,原因可能是(填序号)。A.装置气密性不好
B.盐酸已消耗完全
C.盐酸浓度偏大
D.大理石颗粒变小掉到多孔隔板下
(4)、实验室利用过氧化氢溶液和二氧化锰粉末制取O2可以用A装置,选择的依据是 , 反应的化学方程式为 , 其基本反应类型为反应,反应前后二氧化锰的和都不变。(5)、实验E中,①②为用紫色石蕊溶液润湿的小花,能说明CO2密度大于空气的现象是。(6)、完成图F实验时,夹取细铁丝的仪器是;绕成螺旋状的铁丝比直铁丝燃烧更剧烈的原因是;反应的化学方程式为。5. 空气中的CO2含量超过一定量会影响人体健康。【查阅资料】
空气中CO2的体积分数为1%时,人会有心跳加快、困乏、注意力不集中、轻度恶心等症状;体积分数为5%时,会有呼吸不畅、头晕、耳鸣、血压升高等症状;体积分数为10%时,会有严重缺氧、丧失意识、昏迷等症状。
【提出问题】
如何检验空气中CO2的含量是否达到影响人体健康的程度?
【设计实验】
依据CO2的性质,选择检验方法。
方法一:分别向二氧化碳含量不同的空气中伸入一根燃着的木条。
方法二:分别向二氧化碳含量不同的空气中加入2 mL X溶液,振荡。
方法三:分别向二氧化碳含量不同的空气中加入2 mL饱和的澄清石灰水,振荡。
【实验现象】
方法一
方法二
方法三
空气
正常
燃烧
溶液无明显变化
溶液无明显变化
1%的CO2气体样品
正常
燃烧
溶液无明显变化
澄清石灰水变浑浊
5%的CO2气体样品
正常
燃烧
溶液由紫色变成红色
澄清石灰水变浑浊
10%的CO2气体样品
燃烧
不旺
溶液由紫色变成红色
澄清石灰水变浑浊
(1)、【解释与应用】方法一依据的CO2性质是。
(2)、用化学方程式表示方法三的原理:。(3)、从灭火原理分析,方法一中均没有出现“燃着的木条熄灭”的原因是。(4)、菜窖中一般会含有较多的二氧化碳,人不能贸然进入。菜窖中的二氧化碳气体主要来源是植物的呼吸作用及腐烂。为确保人体健康不受影响,在进入菜窖前,应对其中的二氧化碳的含量进行检验,请写出检验方法及结果判定:。(5)、【拓展探究】利用如图装置,粗略测定菜窖中二氧化碳的体积分数。

连接实验装置:装置接口的连接顺序为。
(6)、用注射器收集50 mL菜窖气体进行实验,在量筒中共收集到水的体积为45 mL,该菜窖气体中二氧化碳的体积分数为。6. 某化学兴趣小组的同学设计了四个实验装置(托盘天平略)来验证质量守恒定律,如图A、B、C、D所示。A.白磷燃烧
 B.酒精与水混合
B.酒精与水混合
C.过氧化氢溶液与二氧化锰混合
 D.镁条燃烧
D.镁条燃烧 (1)、同学们经过讨论后认为(填装置字母)不能用质量守恒定律解释。(2)、白磷燃烧的过程中,没有发生变化的粒子是(填粒子符号)。(3)、质量守恒定律的微观解释是____(填序号)。A、原子种类不变 B、原子数目不变 C、元素种类不变 D、物质种类不变 E、原子质量不变 F、分子质量不变(4)、实验结束后,发现镁条燃烧除了产生大量的白色固体外,还有少量黄色固体。
(1)、同学们经过讨论后认为(填装置字母)不能用质量守恒定律解释。(2)、白磷燃烧的过程中,没有发生变化的粒子是(填粒子符号)。(3)、质量守恒定律的微观解释是____(填序号)。A、原子种类不变 B、原子数目不变 C、元素种类不变 D、物质种类不变 E、原子质量不变 F、分子质量不变(4)、实验结束后,发现镁条燃烧除了产生大量的白色固体外,还有少量黄色固体。【提出问题】
黄色固体是什么?
【查阅资料】
①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁与水反应产生氨气(NH3),该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】
黄色固体是Mg3N2。
【实验探究】
请设计实验,验证猜想。
实验操作
实验现象及结论
取少量黄色固体于试管中,加入少量水,再将放在试管口
实验现象:;实验结论:猜想正确
(5)、【反思与交流】通过镁条在空气中燃烧能产生少量黄色固体这一现象,你对燃烧条件的新认识是。