陕西省商洛市2022-2023学年高一下学期7月化学期末考试试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 文物见证了中华文明。下列文物中主要材料为有机物的是( )




A.元青花四爱图梅瓶
B.石家河玉人像
C.越王勾践剑
D.云梦睡虎地秦墓竹简
A、A B、B C、C D、D2. 化学学科在材料、健康等领域发挥越来越重要的作用,下列说法中错误的是( )A、石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 B、利用氢氟酸刻蚀玻璃制作艺术品 C、高纯硅广泛应用于太阳能电池和计算机芯片 D、高温结构陶瓷具有耐高温、抗氧化等优良性能,可用于火箭发动机3. 下列化学用语表示正确的是( )A、的空间填充模型: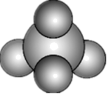 B、氯化铵的电子式:
B、氯化铵的电子式: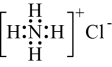 C、甲基的电子式:
C、甲基的电子式: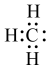 D、HClO的结构式:
4. 煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料。下列关于它们的综合利用的叙述错误的是( )A、以煤、石油和天然气为原料,可以合成高分子材料 B、煤的气化是工业上获得芳香烃的一种重要来源 C、石油的裂解和裂化都是化学变化 D、天然气是一种清洁燃料,属于不可再生资源5. 劳动创造幸福,实干成就伟业,下列劳动项目所涉及的化学知识叙述正确的是( )
D、HClO的结构式:
4. 煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料。下列关于它们的综合利用的叙述错误的是( )A、以煤、石油和天然气为原料,可以合成高分子材料 B、煤的气化是工业上获得芳香烃的一种重要来源 C、石油的裂解和裂化都是化学变化 D、天然气是一种清洁燃料,属于不可再生资源5. 劳动创造幸福,实干成就伟业,下列劳动项目所涉及的化学知识叙述正确的是( )选项
劳动项目
化学知识
A
电池研发人员研发用于汽车的氢气燃料电池
电动汽车中的能量转化是将化学能直接转化为动能
B
营养师进行膳食指导:是否需要多补充
纤维素与蔗糖互为同分异构体
C
食品采用真空包装
减慢食品氧化速率
D
面包师用奶油给糕点裱花
奶油是高分子化合物
A、A B、B C、C D、D6. 已知密闭容器中发生反应 , 在四种不同条件下测得的反应速率分别如下:① ② ③ ④。则四种条件下反度速率快慢的比较正确的是( )
A、②=③>④>① B、④>②=③>① C、③>②=④>① D、②>①>③>④7. 某有机物(M)的结构简式如图所示,下列有关M的说法正确的是( )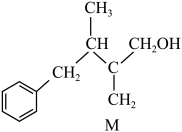 A、不能与金属钠发生反应 B、含有3种官能团 C、可自身发生加聚反应 D、分子式为8. 化学反应的能量变化如图所示,下列说法正确的是( )
A、不能与金属钠发生反应 B、含有3种官能团 C、可自身发生加聚反应 D、分子式为8. 化学反应的能量变化如图所示,下列说法正确的是( )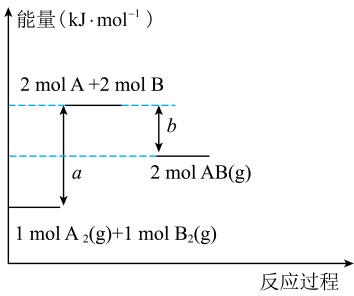 A、三种物质中的能量最高 B、该反应为放热反应 C、生成1 mol 需要吸收 kJ的能量 D、断开1 mol A-A键和1 mol B-B键时要放出a kJ能量9. 设表示阿伏加德罗常数的值,下列说法中正确的是( )A、0.1 mol苯中含有的碳碳双键数目为 B、16 g甲烷中含有的极性共价键数目为 C、11.2 L氧气中含有的氧原子数为 D、0.1 mol·L-1盐酸中含有的氢原子数为10. 从铝土矿(主要成分为)中提取铝的工艺流程如图。下列说法错误的是( )
A、三种物质中的能量最高 B、该反应为放热反应 C、生成1 mol 需要吸收 kJ的能量 D、断开1 mol A-A键和1 mol B-B键时要放出a kJ能量9. 设表示阿伏加德罗常数的值,下列说法中正确的是( )A、0.1 mol苯中含有的碳碳双键数目为 B、16 g甲烷中含有的极性共价键数目为 C、11.2 L氧气中含有的氧原子数为 D、0.1 mol·L-1盐酸中含有的氢原子数为10. 从铝土矿(主要成分为)中提取铝的工艺流程如图。下列说法错误的是( )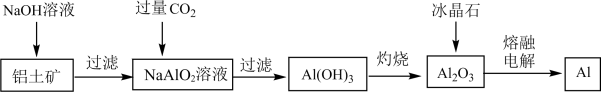 A、对于一些非常活泼的金属,工业上常用电解法冶炼 B、“熔融电解”时发生反应的化学方程式为 C、地壳中的铝元素含量丰富,大部分以游离态的形式存在 D、铝合金表面覆盖着致密的氧化铝薄膜导致其具有较强的耐腐蚀性能11. 柠檬中富含柠檬酸(
A、对于一些非常活泼的金属,工业上常用电解法冶炼 B、“熔融电解”时发生反应的化学方程式为 C、地壳中的铝元素含量丰富,大部分以游离态的形式存在 D、铝合金表面覆盖着致密的氧化铝薄膜导致其具有较强的耐腐蚀性能11. 柠檬中富含柠檬酸(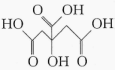 ),将锌片和石墨片按图示方式插入柠檬中,电流计指针发生偏转。下列说法正确的是( )
),将锌片和石墨片按图示方式插入柠檬中,电流计指针发生偏转。下列说法正确的是( )
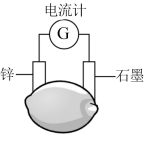 A、锌片发生了还原反应 B、柠檬酸能与小苏打反应 C、电子从锌片流出,经过柠檬汁流向石墨片 D、将锌片换成银片,电流计指针也能发生偏转12. 化学反应在硫酸工业中有重要应用。关于该反应的叙述正确的是( )A、无限延长化学反应的时间能改变化学反应的限度 B、、、的物质的量比1:2:2时达到平衡状态 C、该反应达到化学平衡状态时,正反应速率和逆反应速率相等且等于零 D、若开始加入和 , 达到化学平衡时核素存在于三种物质中13. 氮是粮食作物生长必需的元素,将空气中游离态的氮转化成氮的化合物的过程叫作氮的固定。最近科学家研究了一种在酸性介质中利用电解原理进行电化学固氮的方法,反应机理如图所示,氨气在催化剂电极表面产生。下列说法错误的是( )
A、锌片发生了还原反应 B、柠檬酸能与小苏打反应 C、电子从锌片流出,经过柠檬汁流向石墨片 D、将锌片换成银片,电流计指针也能发生偏转12. 化学反应在硫酸工业中有重要应用。关于该反应的叙述正确的是( )A、无限延长化学反应的时间能改变化学反应的限度 B、、、的物质的量比1:2:2时达到平衡状态 C、该反应达到化学平衡状态时,正反应速率和逆反应速率相等且等于零 D、若开始加入和 , 达到化学平衡时核素存在于三种物质中13. 氮是粮食作物生长必需的元素,将空气中游离态的氮转化成氮的化合物的过程叫作氮的固定。最近科学家研究了一种在酸性介质中利用电解原理进行电化学固氮的方法,反应机理如图所示,氨气在催化剂电极表面产生。下列说法错误的是( )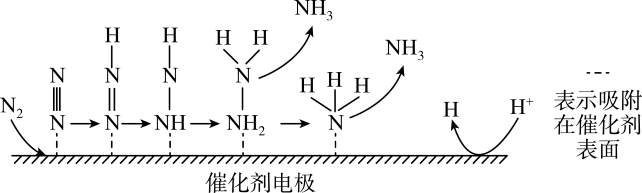 A、该过程中,氮气分子中N≡N键断裂产生N原子 B、电化学固氮法所得的氨气中可能含有少量的 C、催化剂能加快产生氨气的速率 D、该过程中有极性键的形成14. 将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成的体积和剩余金属的质量如表所示(设的还原产物只有):
A、该过程中,氮气分子中N≡N键断裂产生N原子 B、电化学固氮法所得的氨气中可能含有少量的 C、催化剂能加快产生氨气的速率 D、该过程中有极性键的形成14. 将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成的体积和剩余金属的质量如表所示(设的还原产物只有):
实验序号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
稀硝酸的体积/
50
100
150
175
剩余金属的质量/g
9.0
4.8
0
0
的体积(标准状况)/
1120
2240
3360
V
下列说法错误的是( )
A、 B、每等份混合物的质量为 C、稀硝酸的物质的量的浓度为 D、实验Ⅰ中发生反应的化学方程式为二、实验题
-
15. 某化学兴趣小组设计了如下实验装置验证浓硫酸的性质,并检验其与蔗糖反应的产物。
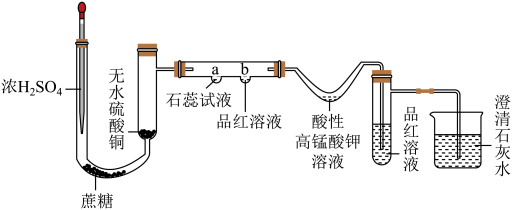
实验步骤:I.按如图所示组装好实验装置,( )。
II.在U形管内装入0.3g蔗糖 , U形管的内套管中加入无水硫酸铜,胶头滴管里盛放浓硫酸,直形玻璃管的凹槽a、b处分别加入2滴石蕊试液和品红溶液,V形管处加入适量酸性高锰酸钾溶液,具支小试管中加入1 mL品红溶液,小烧杯中加入澄清石灰水。
III.挤压胶头滴管,注入5滴浓硫酸于蔗糖中,微热U形管,开始反应时停止加热。
请根据所学知识回答问题:
(1)、步骤1的括号上应填入的内容是。(2)、微热时可以看到,蔗糖先变黄后变黑,然后膨胀并有气体产生。变黑体现了浓硫酸的性,蔗糖变黑过程中发生反应的化学方程式为。(3)、无水硫酸铜处出现的现象是。(4)、a处的现象是石蕊试液(填“褪色”或“由紫色变成红色”),可得到的结论是。(5)、酸性高锰酸钾溶液中发生反应的离子方程式为。(6)、能证明有生成的现象是。(7)、该实验设计的优点是(填一条)。三、工业流程题
-
16. 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。
Ⅰ.活性炭纤维吸附法是工业提取碘单质的方法之一,其流程如图1所示:
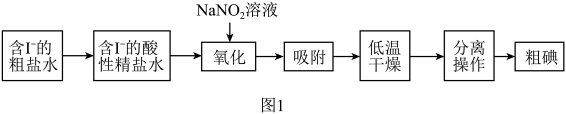
已知:a.溶液只能将氧化成 , 同时生成NO气体。
b.酸性条件下,会与反应生成和。
(1)、粗盐水中还含有、、 , 制成精盐水时所加试剂的顺序是____(填标号)。A、溶液、NaOH溶液、溶液、稀盐酸 B、NaOH溶液、溶液、溶液、稀盐酸 C、NaOH溶液、溶液、溶液、稀盐酸 D、溶液、溶液、NaOH溶液、稀盐酸(2)、“氧化”过程中发生反应的离子方程式是。(3)、酸性溶液是常用的氧化剂,但此过程中选择价格更贵的的原因是。(4)、根据碘单质的特性,分离操作是 , 冷凝得粗碘。(5)、Ⅱ.以金红石(主要成分为TiO₂)为原料制取海绵钛的工艺流程如图2所示:
高温条件下,反应1可生成一种可燃性气体,反应1的化学方程式是。
(6)、上述流程中可循环利用的物质是(填化学式),电解熔融的化学方程式是。(7)、反应2中钛的提取率在不同温度下随时间变化的曲线如图3,则反应最适宜的条件是。
四、原理综合题
-
17. 化学反应在发生物质变化的同时伴随着能量的变化,它是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。
回答下列问题:
(1)、的反应过程如图所示:

该反应为(填“放热”或“吸热”)反应,生成吸收或放出的热量为。
(2)、下列变化中属于吸热反应的是(填标号)。①液态水汽化 ②生石灰与水反应生成熟石灰 ③
④与固体混合
(3)、某化学反应中,设反应物的总能量为 , 生成物的总能量为。若 , 则该反应可用图(填“A”或“B”)表示。
 (4)、为了验证与的氧化性强弱,图中能达到实验目的的装置是(填标号),其正极的电极反应式为;若构建该原电池时两个电极的质量相等,当导线中通过电子时,两个电极的质量差为g。
(4)、为了验证与的氧化性强弱,图中能达到实验目的的装置是(填标号),其正极的电极反应式为;若构建该原电池时两个电极的质量相等,当导线中通过电子时,两个电极的质量差为g。
 (5)、用于燃料电池后,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得定向移向电极,则(填“A”或“B”)电极入口处通 , 参与的电极反应为。
(5)、用于燃料电池后,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得定向移向电极,则(填“A”或“B”)电极入口处通 , 参与的电极反应为。

五、有机推断题
-
18. A~H是常见有机物,、均为有香味的油状物质且互为同系物,E可用于催熟果实。
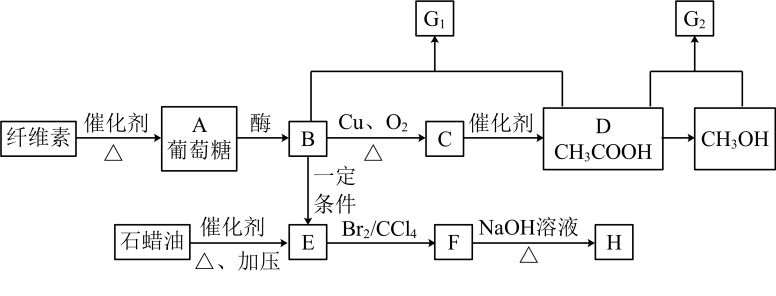
已知:(R代表烃基或H)
请回答下列问题:
(1)、纤维素的分子式是。(2)、A分子所含官能团的名称是 , 它与新制反应生成的砖红色固体是(填化学式),该反应在生活中的应用是。(3)、的同类别的同分异构体的结构简式是。(4)、有多种方法可合成G₁,请写出E与D在一定条件下通过加成反应合成的化学方程式:。(5)、H的分子式为 , 1 mol H与过量的Na反应放出1 mol , 写出1 mol H与2 mol D反应的化学方程式:。(6)、以有机物H为原料合成 的路线图(反应条件省略)如图:
的路线图(反应条件省略)如图:

则Y的结构简式是。
-
-
-