云南省大理白族自治州普通高中2022-2023学年高一下学期化学质量监测试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 下列关于常见物质的分类正确的是( )A、汽油——化合物 B、纯碱——盐 C、硫酸氢钠——酸 D、碘酒——电解质2. 化学与生产生活密切相关,下列说法正确的是( )A、在我国最早使用的合金是钢 B、石油的分馏属于化学变化 C、从海水中提取物质都要通过化学反应才能实现 D、高纯硅可用于制作光感电池3. 当光束通过下列物质时,会出现丁达尔效应的是( )A、云、雾 B、Fe(OH)3晶体 C、FeSO4溶液 D、饱和食盐水4. 下列化学用语表达正确的是( )A、O2与O3互为同系物 B、丙烷的球棍模型为
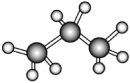 C、乙烯的结构简式是CH2CH2
D、用电子式表示氯化氢分子的形成过程:
C、乙烯的结构简式是CH2CH2
D、用电子式表示氯化氢分子的形成过程: 5. 下列仪器和用途对应错误的是( )
5. 下列仪器和用途对应错误的是( )选项
A
B
C
D
仪器
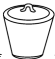

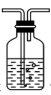
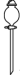
用途
蒸发溶液
过滤
除去气体中杂质
滴加溶液
A、A B、B C、C D、D6. 巴豆酸的结构简式为CH3CH=CHCOOH,下列有关该物质的说法正确的是( )A、属于乙酸的同系物 B、所有原子均处于同一平面 C、可发生加成反应不能发生取代反应 D、能使溴水和酸性高锰酸钾溶液褪色7. 下列各组离子,在无色澄清溶液中能大量共存的是( )A、Fe2+、H+、ClO-、Cl- B、NH、Ca2+、Cl-、OH- C、K+、Ca2+、MnO、NO D、NH、Mg2+、Cl-、SO8. NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温下,18 g D2O中含质子数为10NA B、标准状况下,22.4 L SO3中含有的分子数为NA C、标准状况下,22.4 L C2H6含有的共价键数目为7NA D、1 L 0.1 mol·L-1NaCl溶液中含有的NaCl分子数目为2NA9. 能正确表示下列反应的离子方程式为( )A、过量SO2溶解在NaOH溶液中:SO2+2OH-=HSO+H2O B、NaHCO3和盐酸反应:HCO+H+=H2O+CO2↑ C、Fe2O3溶于氢碘酸:4Fe3++6HI=4Fe2++3I2+3H2O D、硫酸铜溶液中滴加氨水:Cu2++2OH-=Cu(OH)2↓10. 下列说法不正确的是( )A、过度使用化肥,会造成水体富营养化,产生水华等污染 B、味精化学名称是谷氨酸钠,是化学制品,应禁止使用 C、豆腐的制备是利用盐卤等物质能使豆浆中的蛋白质聚沉 D、根据金属活泼性不同,可以采用加热分解、高温还原等不同的冶炼方法11. 配制0.1mol/L的NaOH溶液,如图所示装置和描述均正确的是( ) A、用图①装置称量一定质量的NaOH固体 B、用图②溶解NaOH固体 C、转移洗涤后用图③装置定容 D、定容完成后摇匀如图④所示12. 短周期主族元素X、Y、Z、W原子序数依次增大,X最高正价和最低负价的代数和为0,Y的简单氢化物常做制冷剂,Z被称为国防金属,W和Y同族。下列说法正确的是( )A、简单氢化物的还原性:W>Y B、最高价氧化物对应水化物的酸性:X>Y C、Z的氧化物可溶于氢氧化钠溶液 D、最简单氢化物的沸点:X>Y13. 下列说法正确的是( )A、分子式C3H6只能表示一种物质 B、CH4与少量Cl2混合光照产物中存在CCl4 C、乙醇和丙三醇互为同系物 D、C6H6与氯气反应生成C6H6Cl6属于取代反应14. 下列物质的转化关系(反应条件略去),一步反应不能实现的是( )A、Fe+Cl2→FeCl3 B、Na+O2→Na2O2 C、H2S+O2→SO3 D、NH3+O2→NO15. 下列反应属于吸热反应的是( )A、碘化氢分解 B、二氧化碳和氧化钙化合 C、氢气在氧气中燃烧 D、铝条溶于盐酸16. 工业上常用碳和水蒸气反应制水煤气。在密闭容器中加入一定量的C(s)和H2O(g),发生反应:C(s)+H2O(g)CO(g)+H2(g),下列说法错误的是( )A、用碳粉代替碳块,CO(g)的生成速率增加 B、保持容器体积不变,充入氦气,反应速率增加 C、保持容器体积不变,将CO(g)抽离出来,反应速率减慢 D、升高温度,反应的正、逆速率均增加17. 2023年5月30日,我国神舟十六号宇航员顺利到达空间站。空间站中处理宇航员排泄物的一种方法是:用微生物处理产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如图所示。下列说法正确的是( )
A、用图①装置称量一定质量的NaOH固体 B、用图②溶解NaOH固体 C、转移洗涤后用图③装置定容 D、定容完成后摇匀如图④所示12. 短周期主族元素X、Y、Z、W原子序数依次增大,X最高正价和最低负价的代数和为0,Y的简单氢化物常做制冷剂,Z被称为国防金属,W和Y同族。下列说法正确的是( )A、简单氢化物的还原性:W>Y B、最高价氧化物对应水化物的酸性:X>Y C、Z的氧化物可溶于氢氧化钠溶液 D、最简单氢化物的沸点:X>Y13. 下列说法正确的是( )A、分子式C3H6只能表示一种物质 B、CH4与少量Cl2混合光照产物中存在CCl4 C、乙醇和丙三醇互为同系物 D、C6H6与氯气反应生成C6H6Cl6属于取代反应14. 下列物质的转化关系(反应条件略去),一步反应不能实现的是( )A、Fe+Cl2→FeCl3 B、Na+O2→Na2O2 C、H2S+O2→SO3 D、NH3+O2→NO15. 下列反应属于吸热反应的是( )A、碘化氢分解 B、二氧化碳和氧化钙化合 C、氢气在氧气中燃烧 D、铝条溶于盐酸16. 工业上常用碳和水蒸气反应制水煤气。在密闭容器中加入一定量的C(s)和H2O(g),发生反应:C(s)+H2O(g)CO(g)+H2(g),下列说法错误的是( )A、用碳粉代替碳块,CO(g)的生成速率增加 B、保持容器体积不变,充入氦气,反应速率增加 C、保持容器体积不变,将CO(g)抽离出来,反应速率减慢 D、升高温度,反应的正、逆速率均增加17. 2023年5月30日,我国神舟十六号宇航员顺利到达空间站。空间站中处理宇航员排泄物的一种方法是:用微生物处理产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如图所示。下列说法正确的是( )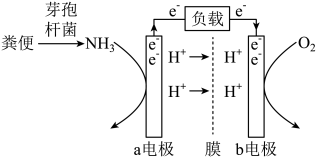 A、a电极是负极,发生还原反应 B、正极区发生的反应是O2+4e-+2H2O=4OH- C、电池工作时电子由a电极经电解质溶液流向b电极 D、每消耗标准状况下2.24L NH3转移电子数为0.3NA18. 垃圾分类回收有利于废物的进一步处理和综合利用。为研究废旧电池的再利用,实验室利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu,并制备ZnO的部分实验过程如图所示。下列叙述不正确的是( )
A、a电极是负极,发生还原反应 B、正极区发生的反应是O2+4e-+2H2O=4OH- C、电池工作时电子由a电极经电解质溶液流向b电极 D、每消耗标准状况下2.24L NH3转移电子数为0.3NA18. 垃圾分类回收有利于废物的进一步处理和综合利用。为研究废旧电池的再利用,实验室利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu,并制备ZnO的部分实验过程如图所示。下列叙述不正确的是( )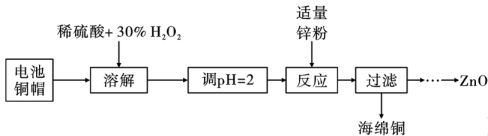 A、溶解操作可用空气替代30%H2O2 B、调节pH时可向溶液中加入Cu(OH)2 C、加入适量的锌粉目的是还原Cu2+ D、过滤后,滤液蒸发结晶、洗涤后,高温灼烧可得的ZnO19. 下列实验设计能达到实验目的的是( )
A、溶解操作可用空气替代30%H2O2 B、调节pH时可向溶液中加入Cu(OH)2 C、加入适量的锌粉目的是还原Cu2+ D、过滤后,滤液蒸发结晶、洗涤后,高温灼烧可得的ZnO19. 下列实验设计能达到实验目的的是( )选项
实验目的
实验设计
A
除去FeCl2溶液中的FeCl3
向溶液中加入KMnO4溶液
B
鉴别碳酸钠和碳酸氢钠溶液
分别滴入氢氧化钙溶液,观察是否产生沉淀
C
鉴别碳酸钡和硫酸钡固体
取样,分别向样品上滴加稀盐酸,观察固体是否溶解
D
检验溶液中存在I-
滴加淀粉溶液,观察溶液是否变蓝
A、A B、B C、C D、D20. ClO2是常见的水处理剂。实验室利用以下反应制备:2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2↑+2H2O,下列说法正确的是( )A、还原性:H2C2O4大于ClO2 B、KClO3 在反应中被氧化,失电子 C、ClO2净水利用了ClO2的还原性 D、反应中,每产生22.4 L气体,转移2 mol电子21. 利用下列装置制备气体,药品、收集方式均正确的是( )选项
气体
装置
固体药品
液体药品
收集方法
A
SO2
Cu
浓硫酸
排水
B
NH3
氢氧化钙固体
氯化铵固体
向下排空气
C
NO
铜
稀硝酸
向上排空气
D
O2
二氧化锰
双氧水
排水
A、A B、B C、C D、D22. 某温度下,在恒容密闭容器中发生可逆反应:I2(g)+H2(g)2HI(g)。下列情况中,一定能说明该反应已达到化学平衡状态的是( )A、单位时间内消耗1 mol H2 , 同时消耗2 mol HI B、混合气体的密度不再发生改变 C、H2和HI的物质的量浓度之比为1∶2 D、密闭容器中的压强保持不变二、元素或物质推断题
-
23. 如图表示中学化学中常见物质的转化关系(部分条件已略去)。其中A属于正盐,B、C、E是常见的气体,C能使湿润的红色石蕊试纸变蓝,D是一种淡黄色固体。
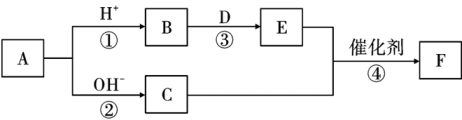
回答下列问题:
(1)、A物质的化学式是 , A中存在的化学键有。(2)、C的电子式是 , 在上述①~④反应中属于氧化还原反应的是(填编号)。(3)、写出B和D反应生成E的化学方程式,并用单线桥法表示电子的转移:。(4)、请写出反应④的化学方程式: , 写出该反应在工业上的用途:。24. 下表是元素周期表的一部分,①~⑧代表对应的元素,回答下列问题: (1)、①的一种核素的质量数为3,该核素的符号为。(2)、⑦在元素周期表中的位置是;⑧的原子结构示意图为。(3)、②③⑧的最高价氧化物对应水化物酸性最强的是(填化学式),②⑥的最高价氧化物对应水化物碱性更强的是(填化学式)。(4)、④⑤⑧的简单离子,半径最小的是(填离子),④和⑧的简单氢化物沸点更高的是(填化学式)。(5)、写出⑥的单质与⑤最高价氧化物对应水化物反应的离子方程式:。(6)、设计实验比较⑤和⑥的金属性强弱:。
(1)、①的一种核素的质量数为3,该核素的符号为。(2)、⑦在元素周期表中的位置是;⑧的原子结构示意图为。(3)、②③⑧的最高价氧化物对应水化物酸性最强的是(填化学式),②⑥的最高价氧化物对应水化物碱性更强的是(填化学式)。(4)、④⑤⑧的简单离子,半径最小的是(填离子),④和⑧的简单氢化物沸点更高的是(填化学式)。(5)、写出⑥的单质与⑤最高价氧化物对应水化物反应的离子方程式:。(6)、设计实验比较⑤和⑥的金属性强弱:。三、实验题
-
25. 习近平总书记指出“要把粮食安全主动权牢牢握在手里”。氨气在农业生产中有广泛的应用。某实验小组设计如图所示装置,制备氨气并验证其性质,回答下列问题:
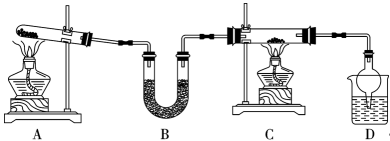 (1)、装置A是氨气发生装置,发生反应的化学方程式为。氨气的水溶液显(填“酸”或“碱”)性。(2)、装置B的名称是 , 下列盛放在B中的药品可以是(填序号)。
(1)、装置A是氨气发生装置,发生反应的化学方程式为。氨气的水溶液显(填“酸”或“碱”)性。(2)、装置B的名称是 , 下列盛放在B中的药品可以是(填序号)。a.P2O5 b.CaCl2 c.碱石灰 d.AlCl3
(3)、装置C中装有氧化铜,通入气体加热后出现光亮的红色固体同时产生的气体是空气的主要成分之一,该反应的方程式是 , 该反应体现氨气的(填“氧化”或“还原”)性。(4)、装置D中,球形管的作用是。利用如图装置完成NH3的喷泉实验,引发喷泉的操作是。
四、原理综合题
-
26. “液态阳光”即“绿色甲醇”,是指生产过程中碳排放极低或为零时制得的甲醇。我国科学家李灿院士将这一设想变成了现实,在我国实现了工业化验证。一定温度下,在体积恒为2L的密闭容器中,充入2.0 mol CO2(g)和6.0 mol H2(g),发生“液态阳光”的反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)的物质的量如下所示:
时间/min
0
2
4
6
8
n(CO2)/mol
2.0
1.5
1.2
1.0
1.0
(1)、2~4 min内,用CO2表示的化学反应速率v(CO2)=。(2)、0~2 min内与2~4 min内相比,0~2 min H2O(g)的生成速率更快,原因是。从表格数据看,min后,反应到达化学反应限度。(3)、反应达到平衡时,混合气体中H2(g)的体积分数为%。(4)、CH3OH可作燃料电池。某甲醇燃料电池以稀硫酸为电解质溶液,其正极发生反应的电极方程式为;电池工作时,每有1 mol CH3OH参加反应,转移电子的数目为(用NA表示阿伏加德罗常数)。五、有机推断题
-
27. 如图是中学化学中常见的有机物转化关系(部分相关物质和反应条件已略去)。已知A为一种植物激素,可催熟水果,回答下列问题:
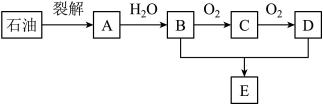 (1)、A的名称是 , A→B的反应类型为。(2)、C中官能团的名称为。(3)、写出B+D→E的化学方程式:。(4)、写出B→C的化学方程式:。(5)、符合下列条件的有机物共有种。
(1)、A的名称是 , A→B的反应类型为。(2)、C中官能团的名称为。(3)、写出B+D→E的化学方程式:。(4)、写出B→C的化学方程式:。(5)、符合下列条件的有机物共有种。①相对分子质量比D大28;②属于D的同系物。
-
-