陕西省榆林市2022-2023学年高一下学期化学期末考试试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. “摇摇冰”是一种即用即冷的饮料,吸食时将饮料罐隔离层中的化学物质和水混合后摇动即能制冷,该化学物质可能是( )A、酒精 B、浓硫酸 C、固体 D、固体2. 存在于葡萄等水果里,在加热条件下能和银氨溶液反应生成银镜的物质是( )A、葡萄糖 B、淀粉 C、纤维素 D、乙酸3. 下列物质能使紫色石蕊试液先变红后褪色的是( )A、Cl2 B、敞口瓶中的久置氯水 C、盐酸 D、活性炭4. 下列物质的用途中,不涉及氧化还原反应的是( )A、用“84”消毒液杀菌消毒 B、用熟石灰改良酸性土壤 C、用铝和氧化铁的混合物焊接铁轨 D、用过氧化钠做呼吸面具的供氧剂5. 实验室欲配制溶液 , 下列操作正确的是( )
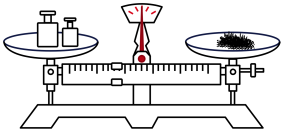
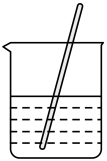
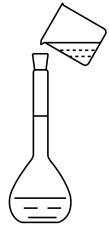

A.称取固体
B.溶解固体
C.向容量瓶内转移液体
D.用胶头滴管定容
A、A B、B C、C D、D6. 日常生活中的下列做法,与调控反应速率无关的是( )A、食品罐头抽真空包装 B、在铁制品表面镀铜 C、在奶粉中添加硫酸锌 D、将食物冷藏7. 下列装置中能组成原电池的是( )A、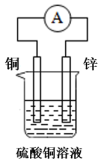 B、
B、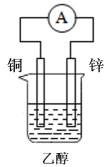 C、
C、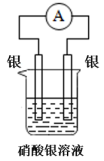 D、
D、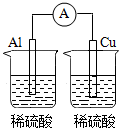 8. 在指定条件下,下列物质或离子间的转化能实现的是( )A、胶体 B、 C、 D、9. 文物是人类宝贵的历史文化遗产。下列描述不正确的是( )
8. 在指定条件下,下列物质或离子间的转化能实现的是( )A、胶体 B、 C、 D、9. 文物是人类宝贵的历史文化遗产。下列描述不正确的是( )



A.西汉彩绘陶钟的主要成分是碳酸钙()
B.泥土属于混合物
C.酸雨对莲花纹石柱有严重的破坏作用
D.常温下铁在浓硫酸中会钝化
A、A B、B C、C D、D10. 下列离子方程式书写正确的是( )A、金属钠与水的反应: B、将通入溶液中: C、向溶液中加入稀: D、用小苏打治疗胃酸过多:11. 翡翠是由四种短周期主族元素组成的矿物,可表示为的简单离子的电子层结构相同,的原子半径比的大,的单质是常见的半导体材料,是地壳中含量最多的元素。下列说法不正确的是( )A、Y在化合物中显价 B、原子序数: C、W的简单氢化物稳定性比的强 D、的单质常温下均为气体12. 部分含硫物质的分类与相应化合价的关系如图,下列说法不正确的是( )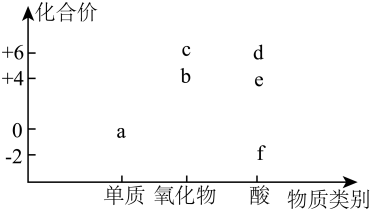 A、与在加热条件下反应生成 B、将通入溶液中,有白色沉淀产生 C、的水溶液久置在空气中酸性会变强 D、将通入的溶液中可以得到13. 实验室制备乙酸乙酯的装置如图所示,下列叙述不正确的是( )
A、与在加热条件下反应生成 B、将通入溶液中,有白色沉淀产生 C、的水溶液久置在空气中酸性会变强 D、将通入的溶液中可以得到13. 实验室制备乙酸乙酯的装置如图所示,下列叙述不正确的是( )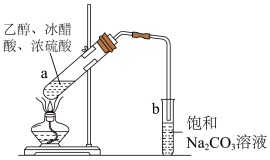 A、浓硫酸能加快酯化反应的速率 B、反应结束后试管中生成无色、有香味的油状液体 C、向试管a中先加入浓硫酸,然后边振荡试管边慢慢加入乙醇,再加入冰醋酸 D、试管中的饱和溶液可降低乙酸乙酯的溶解度,便于分层14. 下列实验过程不能达到实验目的的是( )
A、浓硫酸能加快酯化反应的速率 B、反应结束后试管中生成无色、有香味的油状液体 C、向试管a中先加入浓硫酸,然后边振荡试管边慢慢加入乙醇,再加入冰醋酸 D、试管中的饱和溶液可降低乙酸乙酯的溶解度,便于分层14. 下列实验过程不能达到实验目的的是( )选项
实验目的
实验过程
A
探究浓硫酸的脱水性和强氧化性
把浓硫酸滴入蔗糖中,并将产生的气体通入澄清石灰水中,观察实验现象
B
探究反应物浓度对反应速率的影响
向分别盛有和溶液的两支试管中同时加入溶液,振荡,记录出现浑浊的时间
C
检验乙醇中是否含有水
向乙醇中加入一小粒金属钠,观察是否有无色气体产生
D
确认二氯甲烷分子不存在同分异构体
先搭建甲烷分子球棍模型,后用2个氯原子取代任意2个氢原子,重复数次,观察所得球棍模型的结构
A、A B、B C、C D、D15. 钛铁矿( , 其中为价)在高温下经氯化得到四氯化钛,氯化过程发生的化学方程式为。制取金属钛的流程如图所示: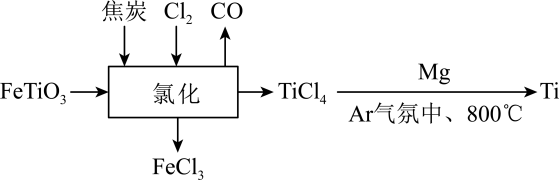
下列说法不正确的是( )
A、制取金属钛时通气的目的是隔绝空气 B、氯化过程中焦炭和都是还原剂 C、根据制取金属钛的反应可推测还原性: D、标准状况下,消耗的氯气可转移电子二、填空题
-
16. 现有几种有机物,其球棍模型如图所示,
 代表H原子,
代表H原子, 代表C原子,
代表C原子, 代表O原子,请回答下列问题:
代表O原子,请回答下列问题: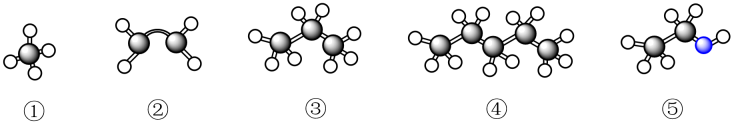 (1)、上述有机物中与①互为同系物的是(填序号)。(2)、鉴别①和②可选用下列试剂中的____(填字母)。A、稀盐酸 B、溴水 C、氢氧化钠溶液 D、四氯化碳(3)、写出④的两种同分异构体的结构简式、。(4)、从成键特点和分子结构两方面分析②、③的差异:a.;b.。(5)、⑤中所含官能团的名称为。(6)、工业上用②与水反应制取⑤,该反应的化学方程式为 , 反应类型为。(7)、写出⑤在有催化剂和加热的条件下制取乙醛的化学反应方程式。如图操作(填“能”或“不能”)制得乙醛。
(1)、上述有机物中与①互为同系物的是(填序号)。(2)、鉴别①和②可选用下列试剂中的____(填字母)。A、稀盐酸 B、溴水 C、氢氧化钠溶液 D、四氯化碳(3)、写出④的两种同分异构体的结构简式、。(4)、从成键特点和分子结构两方面分析②、③的差异:a.;b.。(5)、⑤中所含官能团的名称为。(6)、工业上用②与水反应制取⑤,该反应的化学方程式为 , 反应类型为。(7)、写出⑤在有催化剂和加热的条件下制取乙醛的化学反应方程式。如图操作(填“能”或“不能”)制得乙醛。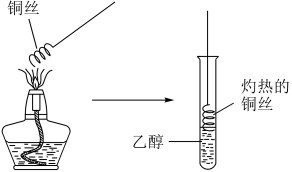
三、原理综合题
-
17. 氨是一种重要的化工原料,在工农业生产中有广泛的应用(1)、Ⅰ.工业合成氨的反应为:。
合成氨的微观历程示意图如下,过程需要(填“吸收”或“放出”)能量。 、
、 、分别表示、催化剂)
、分别表示、催化剂) (2)、工业上可用天然气来制取合成氨的原料气氢气,发生的反应为:。在一定温度下,体积为的恒容密闭容器中测得如表所示数据。
(2)、工业上可用天然气来制取合成氨的原料气氢气,发生的反应为:。在一定温度下,体积为的恒容密闭容器中测得如表所示数据。时间
0
0.40
1.00
0
0
5
0.80
0.60
7
0.20
0.80
0.20
0.60
分析表中数据,判断时反应是否处于平衡状态?(填“是”或“否”)。内,用的浓度变化表示的平均反应速率为。
(3)、Ⅱ.实验小组为探究氮与二氧化氮的反应,设计如图实验装罪:
装置A中生石灰的作用是实验室也常用氯化铵和氢氧化钙混合固体制取氨气,写出发生反应的化学方程式。
(4)、装置B和D的作用都是干燥气体,其中盛装的干燥剂选择合理的是(填字母)。a.甲、乙都是碱石灰 b.甲、乙都是无水氯化钙
c.甲是碱石灰,乙是五氧化二磷 d.甲是浓硫酸,乙是碱石灰
(5)、若氨气与二氧化氮反应生成的产物为水和氮气,则C中发生反应的化学方程式为。(6)、该实验设计中存在着一个很严重的缺陷是。(7)、取铜于装置的锥形瓶中,再加入一定浓度的浓硝酸,充分反应后铜全部溶解,收集到和的混合气体(标准状况),则。四、填空题
-
18. 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。(1)、
Ⅰ.如图是元素周期表的一部分,回答下列问题:
①~⑦号元素中原子半径最大的是(填元素符号),其最高价氧化物对应的水化物中含有的化学键是。该元素的单质与氧气在加热条件下反应生成R,用电子式表示R的形成过程。 (2)、①~⑦号元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式,下同),碱性最强的是。(3)、将锌片、铜片用导线连接后浸入⑥的最高价氧化物对应水化物的稀溶液中,构成了原电池,则负极的电极反应式是。一段时间后,若锌片的质量减少了 , 则导线中通过电子。(4)、Ⅱ.某小组为探究的氧化性强弱,设计实验如下:
(2)、①~⑦号元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式,下同),碱性最强的是。(3)、将锌片、铜片用导线连接后浸入⑥的最高价氧化物对应水化物的稀溶液中,构成了原电池,则负极的电极反应式是。一段时间后,若锌片的质量减少了 , 则导线中通过电子。(4)、Ⅱ.某小组为探究的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
序号
实验①
实验②
实验操作


现象
溶液变为黄色
实验①可得出氧化性强弱:。
(5)、实验②观察到的现象是 , 甲同学根据此现象得出结论:氧化性。乙同学认为实验②不能充分证明氧化性 , 他补做了实验③。实验③
另取实验①反应后的黄色溶液少许,先加入足量的固体,充分振荡,然后加入溶液和淀粉溶液。
补做实验③的目的是。
五、工业流程题
-
19. 海水是巨大的资源宝库,利用海水为原料可获得许多化工产品。回答下列问题:(1)、从海水提取的粗盐中含有等杂质离子,精制时一般步骤如下:
加入的试剂1、2分别是、。
(2)、海水中溴元素主要以形式存在,工业上从海水中提取溴的流程如下:
①写出“氧化”过程中发生反应的离子方程式。
②将吹出后的含空气按一定速率通入吸收塔,用和水进行吸收,吸收后的空气进行循环利用。写出吸收过程中发生反应的离子方程式;吹出时的吹出率与吸收塔中流量的关系如图所示。流量过大,吹出率反而下降的原因是。
 (3)、工业上也可用溶液代替二氧化硫水溶液吸收最终转化为和则发生反应的化学方程式为;当有个电子发生转移时理论上吸收的质量为g。(4)、第一次“氧化”后已获得游离态的溴,“吹出”又将之转变成化合态的溴,其目的是。
(3)、工业上也可用溶液代替二氧化硫水溶液吸收最终转化为和则发生反应的化学方程式为;当有个电子发生转移时理论上吸收的质量为g。(4)、第一次“氧化”后已获得游离态的溴,“吹出”又将之转变成化合态的溴,其目的是。
-
-
-