云南省昆明市2022-2023学年高一下学期化学期末质量检测试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 下列分类不正确的是( )A、碳酸氢钾——盐 B、涤纶——有机高分子材料 C、医用酒精——混合物 D、冰水混合物——胶体2. 材料是工业化生产的重要支撑。下列说法不正确的是( )A、光导纤维的主要成分是单质硅 B、钢是用量最大、用途最广的合金 C、新型陶瓷碳化硅硬度大,可用作砂轮的磨料 D、铝合金表面覆盖着致密的氧化膜,具有较强的抗腐蚀能力3. 化学与生产、生活密切相关。下列说法不正确的是( )A、蒸馏可实现海水淡化 B、石油的分馏是化学变化 C、不合理使用化肥会影响土壤的酸碱性 D、维生素C具有还原性,可用作食品的抗氧化剂4. 下列化学用语表达正确的是( )A、乙醛的结构简式:CH3COH B、镁离子的结构示意图:
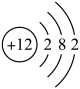 C、CH4的球棍模型:
C、CH4的球棍模型: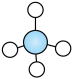 D、NH3的电子式:
D、NH3的电子式: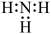 5. 配制一定物质的量浓度的溶液,下列仪器中不需要使用的是( )A、
5. 配制一定物质的量浓度的溶液,下列仪器中不需要使用的是( )A、 B、
B、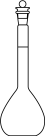 C、
C、 D、
D、 6. 下列离子方程式书写正确的是( )A、硫酸铵与氢氧化钡溶液反应:Ba2++=BaSO4↓ B、金属Na与水反应:Na+H2O=Na++OH-+H2↑ C、加热MnO2与浓盐酸:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O D、NaOH溶液中通入少量CO2:CO2+2OH-=+H2O7. 下列各组离子能在无色澄清的溶液中大量共存的是( )A、K+、Na+、、OH- B、Cu2+、K+、Cl-、 C、Na+、Mg2+、、 D、Al3+、Ba2+、、OH-8. 甲、乙、丙、丁是中学常见物质,存在如下转化关系。下列说法不正确的是( )
6. 下列离子方程式书写正确的是( )A、硫酸铵与氢氧化钡溶液反应:Ba2++=BaSO4↓ B、金属Na与水反应:Na+H2O=Na++OH-+H2↑ C、加热MnO2与浓盐酸:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O D、NaOH溶液中通入少量CO2:CO2+2OH-=+H2O7. 下列各组离子能在无色澄清的溶液中大量共存的是( )A、K+、Na+、、OH- B、Cu2+、K+、Cl-、 C、Na+、Mg2+、、 D、Al3+、Ba2+、、OH-8. 甲、乙、丙、丁是中学常见物质,存在如下转化关系。下列说法不正确的是( )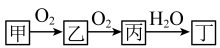 A、若甲为硫单质,则乙具有氧化性 B、若甲为CH4 , 则丙会引起酸雨 C、若丙与水反应生成丁和乙,则甲可能是NH3 D、若丙为淡黄色固体,则甲可保存在煤油中9. 淀粉在乳酸杆菌作用下可发酵转化成乳酸(
A、若甲为硫单质,则乙具有氧化性 B、若甲为CH4 , 则丙会引起酸雨 C、若丙与水反应生成丁和乙,则甲可能是NH3 D、若丙为淡黄色固体,则甲可保存在煤油中9. 淀粉在乳酸杆菌作用下可发酵转化成乳酸(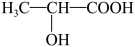 )。下列说法正确的是( ) A、淀粉与纤维素互为同分异构体 B、淀粉能发生水解,最终生成果糖 C、乳酸可通过加聚反应制得聚乳酸 D、乳酸能与NaHCO3溶液反应生成CO210. W、X、Y、Z是原子序数依次增大的短周期主族元素,W与Y位于同一主族,W、X、Z形成的一种化合物是漂白液的有效成分,该化合物灼烧时,火焰为黄色。下列说法正确的是( )A、原子半径:X<W B、简单氢化物的稳定性:W<Y C、Z的单质不能使品红溶液褪色 D、X、Y组成的化合物是离子化合物11. NA为阿伏加德罗常数的值,下列说法正确的是( )A、58.5gNaCl晶体中含有的分子数为NA B、标准状况下,22.4LC6H6中含有的分子数为NA C、标准状况下,18g18O2含有的质子数为8NA D、1L2mol/LK2SO4溶液中含有的K+数目为2NA12. 下列过程中有共价键断裂的是( )A、蔗糖固体溶于水 B、硫酸氢钠固体溶于水 C、干冰升华制冷 D、氢氧化钾固体加热熔融13. “液态阳光”能有效助力我国实现“碳达峰”和“碳中和”,其主要反应之一是CO2(g)+3H2(g)=CH3OH(g)+H2O(g)(放热反应)。下列有关说法正确的是( )A、升高温度能加快反应速率 B、减小H2浓度能加快反应速率 C、反应物的总能量低于生成物的总能量 D、使用催化剂不影响反应速率,能影响反应限度14. 在恒温、恒容条件下发生反应:N2(g)+3H2(g)⇌2NH3(g)。下列情况中能说明该反应达到化学平衡的是( )A、氨气的百分含量不再变化 B、混合气体的密度不再变化 C、c(N2):c(H2):c(NH3)=1:3:2 D、生成1molN2的同时生成3molH215. 利用原电池原理设计下图装置减缓水体中钢铁设施的腐蚀。下列有关说法不正确的是( )
)。下列说法正确的是( ) A、淀粉与纤维素互为同分异构体 B、淀粉能发生水解,最终生成果糖 C、乳酸可通过加聚反应制得聚乳酸 D、乳酸能与NaHCO3溶液反应生成CO210. W、X、Y、Z是原子序数依次增大的短周期主族元素,W与Y位于同一主族,W、X、Z形成的一种化合物是漂白液的有效成分,该化合物灼烧时,火焰为黄色。下列说法正确的是( )A、原子半径:X<W B、简单氢化物的稳定性:W<Y C、Z的单质不能使品红溶液褪色 D、X、Y组成的化合物是离子化合物11. NA为阿伏加德罗常数的值,下列说法正确的是( )A、58.5gNaCl晶体中含有的分子数为NA B、标准状况下,22.4LC6H6中含有的分子数为NA C、标准状况下,18g18O2含有的质子数为8NA D、1L2mol/LK2SO4溶液中含有的K+数目为2NA12. 下列过程中有共价键断裂的是( )A、蔗糖固体溶于水 B、硫酸氢钠固体溶于水 C、干冰升华制冷 D、氢氧化钾固体加热熔融13. “液态阳光”能有效助力我国实现“碳达峰”和“碳中和”,其主要反应之一是CO2(g)+3H2(g)=CH3OH(g)+H2O(g)(放热反应)。下列有关说法正确的是( )A、升高温度能加快反应速率 B、减小H2浓度能加快反应速率 C、反应物的总能量低于生成物的总能量 D、使用催化剂不影响反应速率,能影响反应限度14. 在恒温、恒容条件下发生反应:N2(g)+3H2(g)⇌2NH3(g)。下列情况中能说明该反应达到化学平衡的是( )A、氨气的百分含量不再变化 B、混合气体的密度不再变化 C、c(N2):c(H2):c(NH3)=1:3:2 D、生成1molN2的同时生成3molH215. 利用原电池原理设计下图装置减缓水体中钢铁设施的腐蚀。下列有关说法不正确的是( )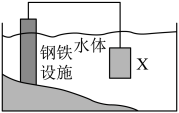 A、材料X可看作原电池的负极 B、材料X应选样金属性比Fe弱的金属 C、钢铁设施上的电极反应式为O2+4e-+2H2O=4OH- D、装置中电流从钢铁设施经导线流向材料X
A、材料X可看作原电池的负极 B、材料X应选样金属性比Fe弱的金属 C、钢铁设施上的电极反应式为O2+4e-+2H2O=4OH- D、装置中电流从钢铁设施经导线流向材料X二、填空题
-
16. 下表是元素周期表的一部分,①~⑦代表对应的元素,回答下列问题:
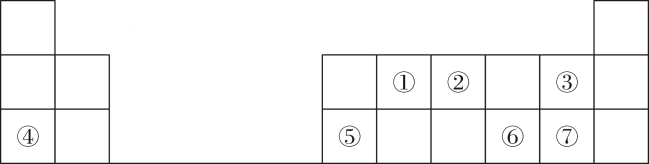 (1)、①的一种核素常用于文物考古,该核素的符号为(以形式表示)。(2)、⑥在元素周期表中的位置是第周期第族。(3)、③④⑦的简单离子半径由大到小的顺序为(填离子符号)。(4)、①②的最高价氧化物对应水化物酸性较强的是(填化学式,下同);③⑦的氢化物稳定性更高的是。(5)、⑤的单质与④的最高价氧化物对应水化物的溶液反应的离子方程式为。(6)、⑥的简单氢化物与⑦的单质反应的化学方程式为。
(1)、①的一种核素常用于文物考古,该核素的符号为(以形式表示)。(2)、⑥在元素周期表中的位置是第周期第族。(3)、③④⑦的简单离子半径由大到小的顺序为(填离子符号)。(4)、①②的最高价氧化物对应水化物酸性较强的是(填化学式,下同);③⑦的氢化物稳定性更高的是。(5)、⑤的单质与④的最高价氧化物对应水化物的溶液反应的离子方程式为。(6)、⑥的简单氢化物与⑦的单质反应的化学方程式为。三、工业流程题
-
17. 从刻蚀印刷电路板的废液(主要成分为FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体的一种工业流程如图:
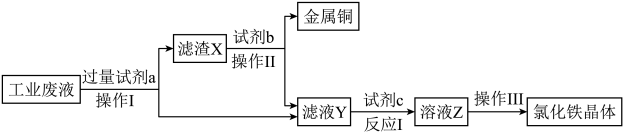
回答下列问题:
(1)、操作I的名称是 , 试剂a的化学式为。(2)、用FeCl3溶液刻蚀铜电路板的化学方程式为。(3)、试剂c可选用(填标号)。若选择上述试剂,反应I中氧化剂与还原剂的物质的量之比为。A.Zn B.H2O2 C.NaOH D.稀H2SO4
(4)、为检验氯化铁晶体中是否混有FeCl2 , 某同学设计方案为:取少许样品于试管中,滴加稀硝酸。若观察到产生气泡,试管口附近有色气体产生,则混有FeCl2.从环保角度考虑,该实验方案存在的不足之处是。(5)、取1.000g产物溶于水中,加入足量NaOH溶液,经过滤、洗涤、灼烧后,所得红棕色固体的质量为0.320g,则该产物中铁元素的质量分数为%。四、实验题
-
18. Mg3N2是一种黄绿色粉末,能溶于酸,微溶于乙醇,易与水反应。某实验小组设计如下装置利用Mg和N2反应制备Mg3N2:
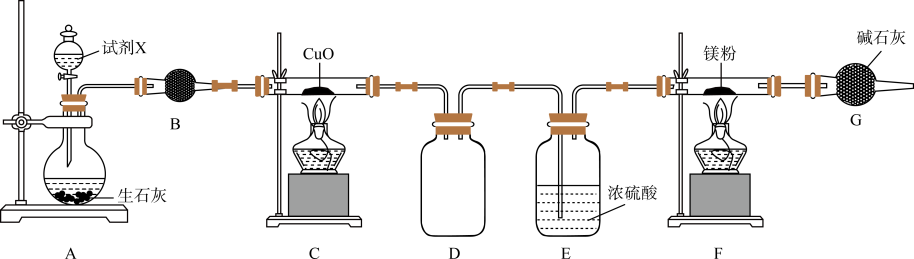
已知:NH3具有还原性,在加热时可将CuO还原成Cu。回答下列问题:
(1)、试剂X的化学名称为 , 装置B中所装试剂可选择(填标号)。a.五氧化二磷 b.无水氯化钙 c.碱石灰 d.活性炭
(2)、写出装置C中发生反应的化学方程式。(3)、实验开始时应先点燃处酒精灯(填“C”或“F"),目的是。(4)、装置G的作用是 , 其中盛装石灰的仪器的名称为。(5)、将制得的Mg3N2放入水中,产生刺激性气味的气体和一种白色沉淀,发生反应的化学方程式为。五、有机推断题
-
19. 聚醋酸乙烯酯(
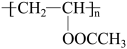 )广泛应用于黏合剂、涂料等领域,其一种合成路线如下(部分反应条件略去):
)广泛应用于黏合剂、涂料等领域,其一种合成路线如下(部分反应条件略去): 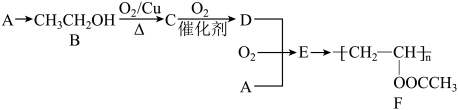
已知:烃A是石油裂解气的主要成分之一,相同状况下,烃A相对于H2的密度为14。
回答下列问题:
(1)、写出A的结构简式 , D中官能团的名称是。(2)、A→B的反应类型为。(3)、E→F的化学方程式为。(4)、符合下列条件的有机物共有种结构(不考虑立体异构)。①与B互为同系物
②相对分子质量比B大28
其中一种的结构简式为。
(5)、下列说法不正确的是(填标号)。a.F为纯净物
b.A、B都能使酸性KMnO4溶液褪色
c.可用大理石鉴别B、D两种物质的水溶液
d.向装有B的试管中投入一小粒钠,钠浮于液面上
-
-
-