陕西省汉中市2022-2023学年高二下学期化学期末联考试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 化学与生活密切相关。下列物质的用途错误的是( )A、95%酒精常用于杀菌消毒 B、氯仿常用作有机溶剂 C、苯甲酸可用作食品防腐剂 D、丙烯可用于制备聚丙烯塑料2. 下列物质间的转化能一步完成的是( )A、 B、 C、 D、3. 下列各组离子在指定溶液中能大量共存的是( )A、0.1 mol·L−1 NaHCO3溶液中:H+、Mg2+ 、Cl-、 B、0. 1 mol·L−1 FeCl3溶液中:Fe2+、、I-、 C、0. 1 mol·L−1 HCl溶液中:Fe2+、、Br-、 D、0.1 mol·L−1 NaOH溶液中:K+、Ba2+、、Br-4. 从日常生活到科技前沿,化学无处不在。下列说法正确的是( )A、分离液态空气制氮气、合成氨、闪电时,氮气转化为NO,都属于氮的固定 B、稀土元素被称为“冶金工业的维生素”,其加入钢中后可增加钢的韧性、抗氧化性 C、我国科学家制备的具有高选择性的催化剂中,金属元素均属于第Ⅷ族 D、用于制造山东舰上舰载机降落拦阻索的特种钢,属于新型无机非金属材料5. 设为阿伏加德罗常数的值,下列说法错误的是( )A、由与组成的混合气体中含有的氮原子数为 B、标准状况下,11.2LHF中含有的分子数为 C、完全溶于一定量的浓硝酸中,转移的电子数一定为 D、时,为12的溶液中含有的数目为6. 科学家采用化学氧化和生物降解两步法工艺,无需分类就可以降解混合废塑料,将混合塑料垃圾转化为有价值的小分子中间体,实现塑料垃圾的高效循环利用。下列叙述错误的是( )
 A、乙烯发生加聚反应合成X B、G和W互为同系物 C、Z中的含氧官能团为酯基、羧基、羟基 D、P的链节为
A、乙烯发生加聚反应合成X B、G和W互为同系物 C、Z中的含氧官能团为酯基、羧基、羟基 D、P的链节为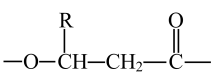 7. 制备二氧化硫并验证其性质的装置如图所示,下列说法错误的是(已知亚硫酸钠溶液呈碱性,亚硫酸氢钠溶液呈酸性)( )
7. 制备二氧化硫并验证其性质的装置如图所示,下列说法错误的是(已知亚硫酸钠溶液呈碱性,亚硫酸氢钠溶液呈酸性)( ) A、通过分液漏斗滴加硫酸可控制反应速率 B、反应一段时间后,乙中溶液可能显中性 C、丙、丁中溶液褪色均体现了的还原性 D、戊中反应的离子方程式可能为8. 通过理论计算发现,与HBr发生加成反应时,通过不同的路径都可以生成有机物④,其反应过程及相对能量变化如图所示。下列说法正确的是( )
A、通过分液漏斗滴加硫酸可控制反应速率 B、反应一段时间后,乙中溶液可能显中性 C、丙、丁中溶液褪色均体现了的还原性 D、戊中反应的离子方程式可能为8. 通过理论计算发现,与HBr发生加成反应时,通过不同的路径都可以生成有机物④,其反应过程及相对能量变化如图所示。下列说法正确的是( )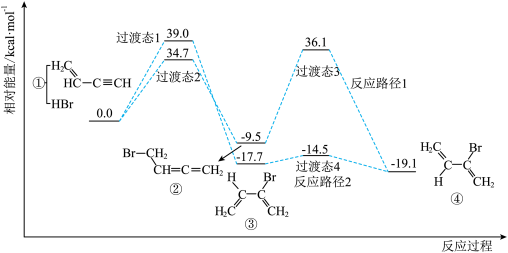 A、反应物经过渡态2生成中间体发生取代反应 B、推测物质的稳定性顺序为④>③>② C、反应路径1中最大能垒为 D、催化剂不仅能改变路径还能改变焓变9. 一定条件下热解制取:。已知其他条件不变时,温度对的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是( )
A、反应物经过渡态2生成中间体发生取代反应 B、推测物质的稳定性顺序为④>③>② C、反应路径1中最大能垒为 D、催化剂不仅能改变路径还能改变焓变9. 一定条件下热解制取:。已知其他条件不变时,温度对的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是( )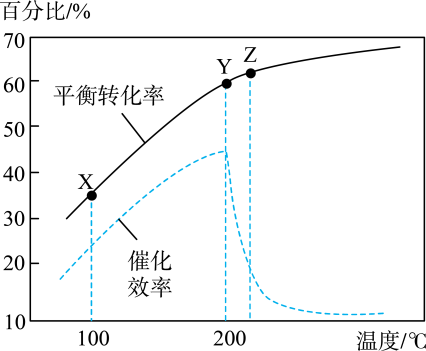 A、平衡常数: B、达到平衡所需时间: C、总能量: D、单位时间的转化率。:10. 用甲醇燃料电池作电源、铁作电极电解含的酸性废水,处理过程发生反应 , 最终转化成沉淀而除去,装置如图,下列说法正确的是( )
A、平衡常数: B、达到平衡所需时间: C、总能量: D、单位时间的转化率。:10. 用甲醇燃料电池作电源、铁作电极电解含的酸性废水,处理过程发生反应 , 最终转化成沉淀而除去,装置如图,下列说法正确的是( )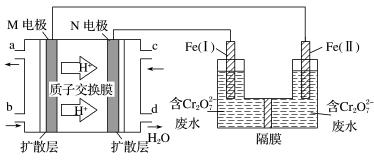 A、b口通入甲醇,Fe(Ⅱ)作阳极 B、电解一段时间后,在Fe(Ⅰ)附近溶液pH变大 C、M电极的电极反应式为 D、电路中每转移1mol电子时,最多可处理11. X、Y、Z、W为原子半径依次减小的短周期主族元素。常温下Y的单质为可用于处理洒落的水银的黄色固体,X、Y的最外层电子数之和等于W的最外层电子数,Z的核外电子总数等于Y的最外层电子数。下列说法正确的是( )A、简单离子半径:X>Y B、最简单氢化物的沸点:Y>W C、Z的最高价氧化物对应的水化物为强酸 D、仅由X、Y形成的化合物中含有离子键12. 根据下列实验操作和现象能推出相应结论或目的的是( )
A、b口通入甲醇,Fe(Ⅱ)作阳极 B、电解一段时间后,在Fe(Ⅰ)附近溶液pH变大 C、M电极的电极反应式为 D、电路中每转移1mol电子时,最多可处理11. X、Y、Z、W为原子半径依次减小的短周期主族元素。常温下Y的单质为可用于处理洒落的水银的黄色固体,X、Y的最外层电子数之和等于W的最外层电子数,Z的核外电子总数等于Y的最外层电子数。下列说法正确的是( )A、简单离子半径:X>Y B、最简单氢化物的沸点:Y>W C、Z的最高价氧化物对应的水化物为强酸 D、仅由X、Y形成的化合物中含有离子键12. 根据下列实验操作和现象能推出相应结论或目的的是( )选项
实验操作和现象
实验目的或结论
A
向溶液中滴加溶液,产生白色沉淀
和发生了相互促进的水解反应
B
向溶液中加入溶液,出现白色沉淀,再加入几滴的溶液,有黑色沉淀生成
证明的溶解度大于的溶解度
C
向溶液中滴加饱和溶液,有红褐色物质产生
制备胶体
D
向溶液中通入气体,产生黑色沉淀
氢硫酸为强酸
A、A B、B C、C D、D13. 常温下,微溶于水,、难溶于水。 。常温下,将一定量加入蒸馏水中得到含大量的浊液,仅改变一个条件,下列对应图像不符合事实的是( )A.升温
B.加少量
C.加少量水
D.加过量
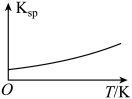
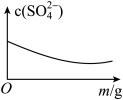
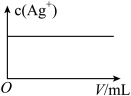
 A、A B、B C、C D、D14. 氯化磷酸三钠具有良好的灭菌、消毒、漂白作用,亦能除去墨迹、血迹、油迹和茶迹等多种污垢,广泛地用于医院、餐馆、食品加工行业。氯化磷酸三钠的熔点为67℃,常温下较稳定,受热易分解。在水溶液中可直接与钙、镁及重金属离子形成不溶性磷酸盐。某小组设计如图流程制备氯化磷酸三钠。下列叙述错误的是( )
A、A B、B C、C D、D14. 氯化磷酸三钠具有良好的灭菌、消毒、漂白作用,亦能除去墨迹、血迹、油迹和茶迹等多种污垢,广泛地用于医院、餐馆、食品加工行业。氯化磷酸三钠的熔点为67℃,常温下较稳定,受热易分解。在水溶液中可直接与钙、镁及重金属离子形成不溶性磷酸盐。某小组设计如图流程制备氯化磷酸三钠。下列叙述错误的是( )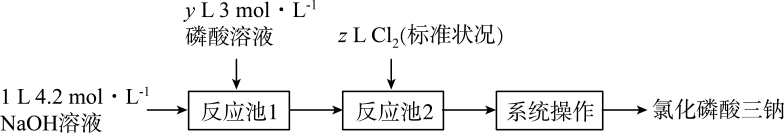 A、理论上制得的氯化磷酸三钠不超过 B、“反应池1”中最少应加入磷酸溶液 C、“系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤和高温烘干 D、氯化磷酸三钠因含而具有漂白、杀菌和消毒作用
A、理论上制得的氯化磷酸三钠不超过 B、“反应池1”中最少应加入磷酸溶液 C、“系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤和高温烘干 D、氯化磷酸三钠因含而具有漂白、杀菌和消毒作用二、填空题
-
15. 钛白粉(纳米级TiO2)广泛用作功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料,是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉,同时得到绿矾的工艺流程如图1。
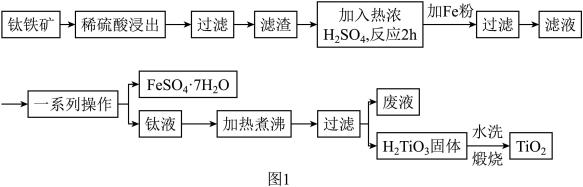
已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)、稀硫酸浸出的目的是。(2)、图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是和 , 原因为。 (3)、若用浓硫酸浸出后Ti元素的存在形式为 , 则浓硫酸与FeTiO3反应的化学方程式为。(4)、“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是 , 过滤时用到的玻璃仪器有玻璃棒、。(5)、将钛液加热煮沸的目的是。(6)、若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为kg。
(3)、若用浓硫酸浸出后Ti元素的存在形式为 , 则浓硫酸与FeTiO3反应的化学方程式为。(4)、“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是 , 过滤时用到的玻璃仪器有玻璃棒、。(5)、将钛液加热煮沸的目的是。(6)、若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为kg。三、实验题
-
16. 肉桂酸是无公害的环保防腐剂,可直接添加于食品中。某小组设计实验制备肉桂酸并探究其性质:
【原理】
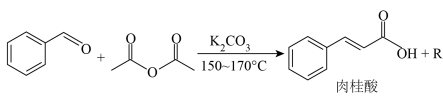
【性质】
物质
苯甲醛
肉桂酸
乙酸酐
沸点
179℃
300℃
140℃
水溶性
微溶于水、无色油状液体
难溶于冷水、易溶于热水
与水反应生成乙酸
【步骤】
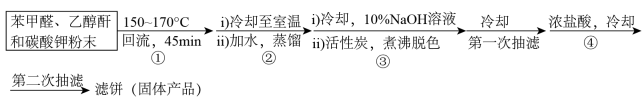
【装置】利用图1装置完成步骤①,利用图2装置完成步骤②,抽滤操作用图3装置。
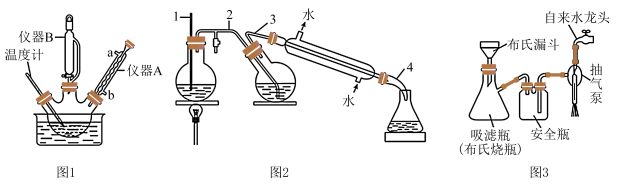
回答下列问题:
(1)、R是(填结构简式)。(2)、图1中,仪器B的名称是 , 仪器A的作用是。实验前,要烘干三颈烧瓶,目的是。(3)、完成步骤②,蒸馏的主要目的是分离出过量的苯甲醛,毛细管1与空气相通,其作用是(答一条即可)。(4)、相比于普通过滤,图3抽滤的主要优点有(答一条即可)。(5)、步骤③加入溶液的作用是 , 第二次抽滤得到滤饼的主要成分是(填名称)。(6)、设计简单实验证明肉桂酸中含有碳碳双键:。四、原理综合题
-
17. “绿水青山就是金山银山”是重要的发展理念,研究、、等大气污染物的处理方法具有重要意义。(1)、钙基固硫技术可减少排放,但煤炭燃烧过程中产生的又会与发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应①:
反应②:
反应③:(填含、的代数式)。
(2)、的排放主要来自汽车尾气。①有人利用尿素水溶液热解产生的去除尾气中的 , 流程如图1;

a.尿素中氮元素的化合价为。
b.若氧化处理后的尾气中混有 , 此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低的去除率。试分析硫酸盐的产生过程:。
②某种脱硝反应机理如图2所示,参与的反应的方程式为。
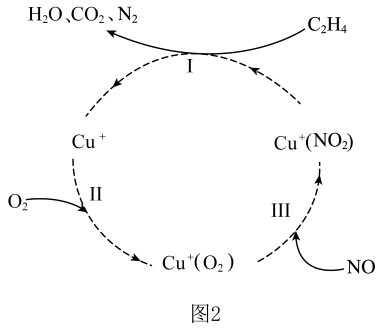
③实验室模拟汽车尾气转化器中的反应。在2L的恒容密闭容器中,投入和 , 一段时间后反应达到平衡状态,测得的转化率为。该温度下,反应的平衡常数为。
④一定条件下,反应的反应历程如图3所示,该历程分三步进行,其中第步是决速步骤。在恒温恒容密闭容器中进行上述反应,原料组成 , 体系达到平衡时的体积分数为 , 则的平衡转化率为。

五、结构与性质
-
18. 研究表明,芳香性可以在含有更多电子的体系里表现出来,近日Nature上发表了这方面最新的研究成果,科学家合成出来的一些具有代表性的芳香化合物(Ar代表芳香烃基)如图。回答下列问题:
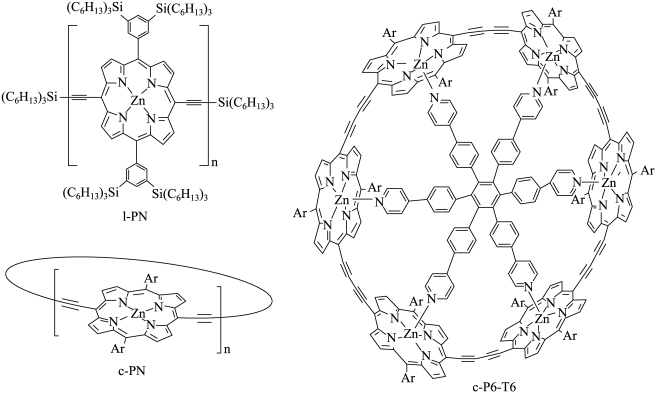 (1)、基态Zn原子的价电子排布式为。(2)、l-PN中C原子的杂化类型有种,l-PN中位于第二、三周期元素的第一电离能由大到小的顺序为(填元素符号)。(3)、c-PN中,所有元素电负性由小到大排序为(填元素符号)。(4)、c-P6-T6中,锌的配位数为 , c-PN中锌的配位数为。(5)、l-PN的熔点(填“高于”或“低于”)c-P6-T6,理由是。(6)、已知欧拉定理:顶点数-棱边数+面数=2.具有类似足球烯结构的分子的结构如图所示。它与足球烯()互为。1个由个正五边形和个正六边形构成。
(1)、基态Zn原子的价电子排布式为。(2)、l-PN中C原子的杂化类型有种,l-PN中位于第二、三周期元素的第一电离能由大到小的顺序为(填元素符号)。(3)、c-PN中,所有元素电负性由小到大排序为(填元素符号)。(4)、c-P6-T6中,锌的配位数为 , c-PN中锌的配位数为。(5)、l-PN的熔点(填“高于”或“低于”)c-P6-T6,理由是。(6)、已知欧拉定理:顶点数-棱边数+面数=2.具有类似足球烯结构的分子的结构如图所示。它与足球烯()互为。1个由个正五边形和个正六边形构成。
六、有机推断题
-
19. K是合成抗胆碱药物奥昔布宁的中间体。以芳香族化合物为起始原料合成K的路线如图:

已知:
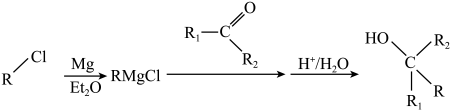
回答下列问题:
(1)、B→C的反应试剂和条件是 , 试剂E是(填结构简式)。(2)、K中官能团的名称为。(3)、H→I的反应类型是。(4)、L是D的同分异构体,同时具备下列条件的L的结构有种。(不考虑立体异构)①属于芳香族化合物 ②与足量银氨溶液反应,最多生成
其中,在核磁共振氢谱上有4组峰且峰的面积比为的结构简式为(写一种)。
(5)、以甲苯、丙酮为原料合成 ,设计合成路线(有机溶剂和无机试剂任选)。
,设计合成路线(有机溶剂和无机试剂任选)。
-
-
-
-