广西壮族自治区河池市2022-2023学年高二下学期化学期末考试试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 化学与生产、生活和科技密切相关。下列有关说法错误的是( )A、推广乙醇汽油可减少空气污染 B、《本草纲目》中记载“凡酸坏之酒,皆可蒸烧”,对应的实验方法是蒸馏 C、聚氯乙烯塑料常用作食品包装袋 D、乙二胺(H2NCHCHNH2)具有扩张血管的作用,是制备药物、杀虫剂的原料2. 下列化学用语表示正确的是( )A、乙烯的结构简式:CH2CH2 B、乙醇的实验式:C2H6O C、氨基的电子式:
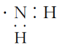 D、甲醛的球棍模型:
D、甲醛的球棍模型: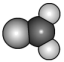 3. 下列有机物的命名正确的是( )A、
3. 下列有机物的命名正确的是( )A、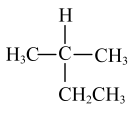 2-乙基丙烷
B、
2-乙基丙烷
B、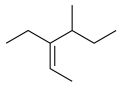 3-乙基-4-甲基-2-己烯
C、
3-乙基-4-甲基-2-己烯
C、 1,5-二溴戊烷
D、
1,5-二溴戊烷
D、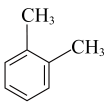 1,2-二甲苯
4. 下列说法不正确的是( )A、甲烷在光照条件下可与氯气发生取代反应 B、苯酚晶体在空气中易被氧化变为紫色 C、酚醛树脂可由甲醛和苯酚通过缩聚反应生成 D、甲醛的水溶液可用于动物标本的保存5. 已知两种元素的基态原子价层电子排布式分别为 X:2s22p4 , Y:4s24p4下列有关比较中正确的是( )A、第一电离能:X<Y B、原子半径:X>Y C、非金属性:X>Y D、最高正化合价:X=Y6. 实验室通过如图所示装置制取乙烯并验证其性质。下列说法正确的是( )
1,2-二甲苯
4. 下列说法不正确的是( )A、甲烷在光照条件下可与氯气发生取代反应 B、苯酚晶体在空气中易被氧化变为紫色 C、酚醛树脂可由甲醛和苯酚通过缩聚反应生成 D、甲醛的水溶液可用于动物标本的保存5. 已知两种元素的基态原子价层电子排布式分别为 X:2s22p4 , Y:4s24p4下列有关比较中正确的是( )A、第一电离能:X<Y B、原子半径:X>Y C、非金属性:X>Y D、最高正化合价:X=Y6. 实验室通过如图所示装置制取乙烯并验证其性质。下列说法正确的是( )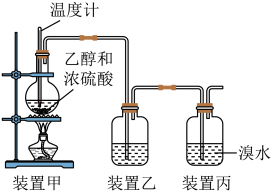 A、装置甲加热时应缓慢升高温度到170℃ B、装置甲中浓硫酸的作用是作催化剂和吸水剂 C、为除去乙烯中混有的少量SO2 , 装置乙中可加入NaOH溶液 D、装置丙中溶液褪色时有CH3CHBr2生成7. 下列说法正确的是( )A、配合物 K4[Fe(CN)6] 中配位原子是氮原子 B、共价晶体中,共价键越强,熔点越高 C、离子晶体中只含有离子键不含有共价键 D、分子晶体中,分子间作用力越大,对应的物质越稳定8. “中国芯”的主要原材料是高纯单晶硅,可通过反应制备高纯硅。下列有关说法正确的是( )A、基态氯原子的价层电子排布式为3s23p5 B、是由极性键形成的极性分子 C、单晶硅为分子晶体 D、芯片、太阳能电池、光导纤维的主要成分均为晶体Si9. 肉桂酸用途广泛,可用作食品添加剂,其结构简式如图所示。下列说法错误的是( )
A、装置甲加热时应缓慢升高温度到170℃ B、装置甲中浓硫酸的作用是作催化剂和吸水剂 C、为除去乙烯中混有的少量SO2 , 装置乙中可加入NaOH溶液 D、装置丙中溶液褪色时有CH3CHBr2生成7. 下列说法正确的是( )A、配合物 K4[Fe(CN)6] 中配位原子是氮原子 B、共价晶体中,共价键越强,熔点越高 C、离子晶体中只含有离子键不含有共价键 D、分子晶体中,分子间作用力越大,对应的物质越稳定8. “中国芯”的主要原材料是高纯单晶硅,可通过反应制备高纯硅。下列有关说法正确的是( )A、基态氯原子的价层电子排布式为3s23p5 B、是由极性键形成的极性分子 C、单晶硅为分子晶体 D、芯片、太阳能电池、光导纤维的主要成分均为晶体Si9. 肉桂酸用途广泛,可用作食品添加剂,其结构简式如图所示。下列说法错误的是( ) A、能与NaOH溶液发生中和反应 B、1mol该分子最多能与5molH2发生加成反应 C、分子中所有原子可能共平面 D、适当条件下与氯气既可发生取代反应又可发生加成反应10. 下列有关糖类、油脂、蛋白质的说法正确的是( )A、葡萄糖、果糖、麦芽糖为还原性糖,而蔗糖、淀粉、纤维素为非还原性糖 B、淀粉、油脂、蛋白质都属于高分子化合物 C、糖类、油脂、蛋白质都能发生水解 D、向蛋白质溶液中加入CuSO4溶液,可使蛋白质发生盐析11. 丙烯醛(CH2=CH—CHO) 可发生的化学反应有( )
A、能与NaOH溶液发生中和反应 B、1mol该分子最多能与5molH2发生加成反应 C、分子中所有原子可能共平面 D、适当条件下与氯气既可发生取代反应又可发生加成反应10. 下列有关糖类、油脂、蛋白质的说法正确的是( )A、葡萄糖、果糖、麦芽糖为还原性糖,而蔗糖、淀粉、纤维素为非还原性糖 B、淀粉、油脂、蛋白质都属于高分子化合物 C、糖类、油脂、蛋白质都能发生水解 D、向蛋白质溶液中加入CuSO4溶液,可使蛋白质发生盐析11. 丙烯醛(CH2=CH—CHO) 可发生的化学反应有( )①与HCN发生加成反应 ②与酸性高锰酸钾溶液发生氧化反应 ③银镜反应 ④加聚反应 ⑤与Br2的CCl4溶液发生加成反应
A、①②③ B、②④⑤ C、①②③④⑤ D、①③④12. 用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间结构,也能用来推测键角大小,下列判断正确的是( )A、SO2、CS2、HCN分子的键角都是180° B、H2O的键角为120°,CO的键角为180° C、PCl3、NH3、SO的空间构型都是三角锥形 D、HCHO(甲醛)、BCl3、SO3的空间结构都是平面三角形13. 2022年3月,中科院首创二氧化碳加氢制汽油技术在山东正式投产。转化过程示意图如下: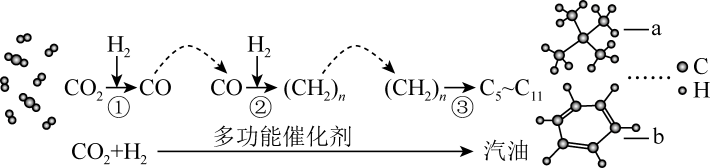
下列说法错误的是( )
A、反应①既存在键的断裂又存在键的断裂 B、反应②既存在键的形成又存在键的形成 C、有机物a是新戊烷,除a之外,戊烷还有两种同分异构体 D、 和
和 互为同分异构体
14. 某种有机物分子的球棍模型如图所示,图中的“棍”代表单键或双键或三键,不同大小的“球”代表不同元素的原子,且三种元素位于不同的短周期。下列有关该有机物的叙述错误的是( )
互为同分异构体
14. 某种有机物分子的球棍模型如图所示,图中的“棍”代表单键或双键或三键,不同大小的“球”代表不同元素的原子,且三种元素位于不同的短周期。下列有关该有机物的叙述错误的是( ) A、分子式为C2HCl3 B、该有机物能发生加聚反应 C、通入AgNO3溶液能产生白色沉淀 D、该有机物中σ键与π键的数目之比为5:115. 化合物Z 是合成某种抗结核候选药物的重要中间体,可由下列反应制得。下列有关说法错误的是( )
A、分子式为C2HCl3 B、该有机物能发生加聚反应 C、通入AgNO3溶液能产生白色沉淀 D、该有机物中σ键与π键的数目之比为5:115. 化合物Z 是合成某种抗结核候选药物的重要中间体,可由下列反应制得。下列有关说法错误的是( )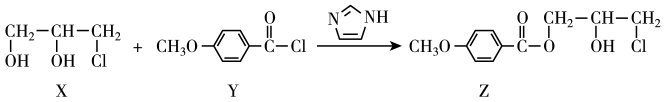 A、X可溶于水 B、Y分子的核磁共振氢谱有三组峰,且峰面积之比为1:1:3 C、
A、X可溶于水 B、Y分子的核磁共振氢谱有三组峰,且峰面积之比为1:1:3 C、 能与酸反应
D、X、Z分别与NaOH溶液反应,可得到一种相同的产物
16. 某立方晶系的锑钾(Sb—K) 合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知NA为阿伏加德罗常数。下列说法正确的是( )
能与酸反应
D、X、Z分别与NaOH溶液反应,可得到一种相同的产物
16. 某立方晶系的锑钾(Sb—K) 合金可作为钾离子电池的电极材料,其晶胞如图1所示(图2为晶胞中的一部分),已知NA为阿伏加德罗常数。下列说法正确的是( )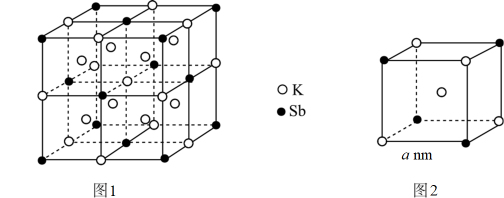 A、该合金的组成可表示为 K2Sb B、该晶体是离子晶体 C、两个 Sb 之间最近的距离为2anm D、该晶体的密度为
A、该合金的组成可表示为 K2Sb B、该晶体是离子晶体 C、两个 Sb 之间最近的距离为2anm D、该晶体的密度为二、填空题
-
17. 氰化钾是一种剧毒的物质,贮存和使用时必须注意安全。已知:。回答下列问题:(1)、KCN的电子式为(2)、KOCN中 K、O、C、N 的电负性由大到小的顺序为(用元素符号表 示) ,C 元素的化合价为价,1molOCN-中含有的σ键数目为 , OCN-的空间结构为。(3)、H2S2与H2O2相似,分子中的共价键类型为(填 “σ键”或“π键”),其中S原子的杂化轨道类型为;分子中4个原子(填“在”或“不在”)同一条直线上;H2S2在水中的溶解度比H2O2的小,其主要原因为
三、实验题
-
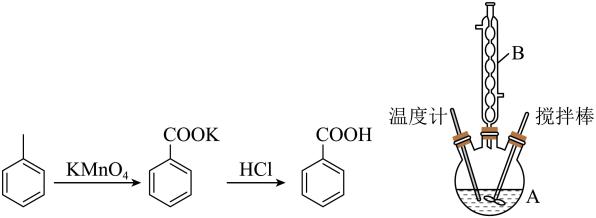
18. 苯甲酸可用作食品防腐剂。实验室可通过甲苯(密度为0.87g·mL-1) 氧化制苯甲酸,其反应原理、制备装置如下:
名称
相对分子质量
熔点/℃
沸点/℃
溶解性
甲苯
92
-95
110.6
不溶于水,易溶于乙醇
苯甲酸
122
122.4
248
微溶于冷水,易溶于乙醇、热水
实验步骤:
I.向仪器A 中加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾(被还原为MnO2),慢慢搅拌,并加热回流约30min后停止加热并继续搅拌1 min。
Ⅱ.将反应液与适量饱和亚硫酸氢钠溶液混合振荡,过滤、洗涤,将滤液、洗涤液合并放在置于冰水浴中的烧杯内,再用浓盐酸酸化至苯甲酸完全析出。将析出的苯甲酸过滤,用适量X洗涤、然后干燥,称量,得到1.0g粗产品。
Ⅲ.纯度测定:称取0.150g 粗产品(杂质不与NaOH反应),配成乙醇溶液并置于100 mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol·L-¹的NaOH标准溶液滴定,三次滴定平均消耗22.50mL的NaOH标准溶液。
回答下列问题:
(1)、仪器 A 的名称是 , 其最适宜规格为(填字母)。a.100mL b.250mL c.500mL d.1000mL
(2)、步骤Ⅱ中的适量饱和亚硫酸氢钠溶液的作用是。使用冰水浴的目的是 ,X是。(3)、装置中仪器B的作用是(4)、本实验制备的苯甲酸的纯度为%(保留1位小数)。(5)、若要得到纯度更高的苯甲酸,可通过的方法提纯。四、结构与性质
-
19. Cu2O广泛应用于太阳能电池、传感器和芯片等领域。以Cu2O等半导体材料制作 的传感器和芯片具有能耗低、效率高的优势。用CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。回答下列问题:(1)、Na、Cu等金属具有良好的导电性,从金属键的理论看,原因是。(2)、基态Cu原子的电子排布式为 , Cu 属于区元素。(3)、Cu 可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4 , 若要确定该物质是晶体还是非 晶体,最科学的方法是对它进行实验,其阴离子的空间结构是。加热该物质时,首先失去的是 H2O分子,原因是(4)、抗坏血酸的分子结构如图1所示,分子中碳原子的杂化轨道类型为 , 1个抗坏血酸分子中含有个手性碳原子。
 (5)、Cu₂O的晶胞结构如图2所示,图中表示Cu的是(填“黑球”或“白球”),若该晶体的密度为ρg·cm⁻³, 晶胞参数为apm, 则阿伏加德罗常数NA=(用含ρ和a的代数式表示)。
(5)、Cu₂O的晶胞结构如图2所示,图中表示Cu的是(填“黑球”或“白球”),若该晶体的密度为ρg·cm⁻³, 晶胞参数为apm, 则阿伏加德罗常数NA=(用含ρ和a的代数式表示)。
五、有机推断题
-
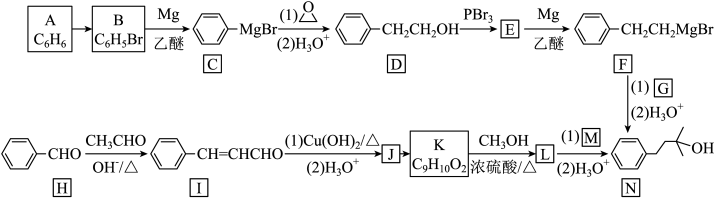
20. 化合物 N可用作化妆品和食品的添加剂。实验室制备 N的两种合成路线如下:
回答下列问题:
已知:ⅰ:
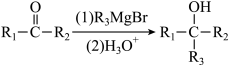 (为烃基,为H或烃基);
(为烃基,为H或烃基);ⅱ:
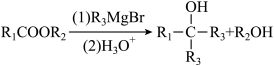 (为烃基)。(1)、A→B反应所需的条件是;J的结构简式是。可利用(填字母)检验J中的含氧官能团。
(为烃基)。(1)、A→B反应所需的条件是;J的结构简式是。可利用(填字母)检验J中的含氧官能团。a.酸性KMnO₄溶液 b.碱性Cu(OH)₂溶液 c.NaHCO₃溶液
(2)、D→E的反应类型是;G中的官能团名称为。(3)、写出满足下列条件的K的同分异构体的结构简式;(写出一种即可)。①能发生银镜反应;
②能使 FeCl₃ 溶液能发生显色反应;
③核磁共振氢谱有4组峰,峰面积比为6:2:1:1。
(4)、写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干):
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干):
-
-
-