云南省玉溪市2022-2023学年高二下学期化学期末考试试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 《厉害了,我的国》展示了中国五年来探索太空,开发深海,建设世界一流的高铁、桥梁,5G技术联通世界等举世瞩目的成就。它们都与化学有着密切联系。下列说法正确的是( )A、港珠澳大桥采用超高分子量聚乙烯纤维吊绳,聚乙烯可以使溴水褪色 B、“中国天眼”的镜片材料为SiC,属于新型无机非金属材料 C、我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 D、为建设生态文明,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源2. 下列化学用语使用错误的是( )A、的VSEPR模型:
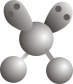 B、次氯酸的电子式:
B、次氯酸的电子式: C、的结构示意图:
C、的结构示意图: D、2-丁烯的键线式:
D、2-丁烯的键线式: 3. 氨硼烷()的分子结构和乙烷相似,是一种固体储氢材料。下列关于氨硼烷的说法,错误的是( )A、第一电离能: B、N和B元素都位于周期表的P区 C、氨硼烷是极性分子 D、氨硼烷中N原子和B原子之间形成了配位键4. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中所含数目为0.01NA B、和充分反应后,所含分子数目等于2NA C、0.1 mol环氧乙烷(
3. 氨硼烷()的分子结构和乙烷相似,是一种固体储氢材料。下列关于氨硼烷的说法,错误的是( )A、第一电离能: B、N和B元素都位于周期表的P区 C、氨硼烷是极性分子 D、氨硼烷中N原子和B原子之间形成了配位键4. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、溶液中所含数目为0.01NA B、和充分反应后,所含分子数目等于2NA C、0.1 mol环氧乙烷( )中所含键数目为0.3 NA
D、1 mol羟基(—OH)与17 g氢氧根()所含的电子数均为10 NA
5. 曾经一种“福禄双全”的有机物刷爆朋友圈,其结构简式如图所示,下列关于该有机物的说法,正确的是( )
)中所含键数目为0.3 NA
D、1 mol羟基(—OH)与17 g氢氧根()所含的电子数均为10 NA
5. 曾经一种“福禄双全”的有机物刷爆朋友圈,其结构简式如图所示,下列关于该有机物的说法,正确的是( )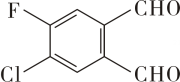 A、该有机物的分子式为 B、苯环上的一取代物只有1种 C、能使酸性高锰酸钾溶液褪色 D、此有机物所有原子一定处于同一平面内6. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色溶液中:、、、 B、由水电离的的溶液中:、、、 C、的溶液中:、、、Mg2+ D、能使酚酞变红的溶液中:、、、7. 2021年6月11日国家航天局公布了“祝融号”火星车拍摄的首批科学影像图。火星气体及岩石中富含X、Y、Z、W四种元素,已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与冷水剧烈反应后的溶液能使酚酞试液变为红色,X、W为同一主族元素,Y为地壳中含量最高的元素,火星岩石含有W的最高价化合物 , 下列判断正确的是( )A、原子半径: B、X、Y、Z三种元素组成的化合物只含共价键 C、简单氢化物的沸点: D、最高价氧化物对应水化物的酸性:8. 神舟十三号载人航天飞船的天线是用钛镍形状记忆合金制造的。工业上用钛酸亚铁()冶炼钛(Ti)的过程是:
A、该有机物的分子式为 B、苯环上的一取代物只有1种 C、能使酸性高锰酸钾溶液褪色 D、此有机物所有原子一定处于同一平面内6. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色溶液中:、、、 B、由水电离的的溶液中:、、、 C、的溶液中:、、、Mg2+ D、能使酚酞变红的溶液中:、、、7. 2021年6月11日国家航天局公布了“祝融号”火星车拍摄的首批科学影像图。火星气体及岩石中富含X、Y、Z、W四种元素,已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与冷水剧烈反应后的溶液能使酚酞试液变为红色,X、W为同一主族元素,Y为地壳中含量最高的元素,火星岩石含有W的最高价化合物 , 下列判断正确的是( )A、原子半径: B、X、Y、Z三种元素组成的化合物只含共价键 C、简单氢化物的沸点: D、最高价氧化物对应水化物的酸性:8. 神舟十三号载人航天飞船的天线是用钛镍形状记忆合金制造的。工业上用钛酸亚铁()冶炼钛(Ti)的过程是:反应①
反应②
下列有关说法错误的是( )
A、反应①中氧化剂是 , 还原剂只有C B、反应①若生成标准状况下6.72 L CO,则转移0.7 mol电子 C、根据反应②可知还原性: D、钛镍形状记忆合金是一种特殊的金属材料9. 下列实验操作、现象及结论均正确的是( )选项
实验操作
现象
结论
A
向溴水中通入 , 观察溶液颜色变化
溴水褪色
有漂白性
B
向蛋白质溶液中加入浓溶液
出现浑浊
溶液使蛋白质变性
C
用pH试纸分别测浓度均为的和溶液的pH
后者大于前者
水解平衡常数
D
向溶液中滴加溶液
产生白色沉淀
白色沉淀为
A、A B、B C、C D、D10. 下列方程式与所描述的事实不相符的是( )A、工人将模具干燥后再注入熔融钢水,防止反应: B、向溶液中滴加足量的氨水: C、硫酸酸化的KI淀粉溶液久置后变蓝: D、等物质的量浓度的和溶液以体积比1∶2混合:11. 中含有、分别表示为Fe(Ⅱ)、Fe(Ⅲ),以为催化材料,可实现用消除酸性废水中的致癌物 , 其反应过程示意图如图所示,下列说法错误的是( )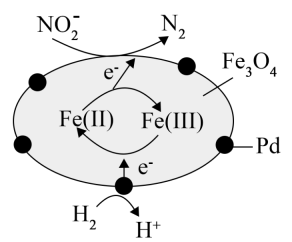 A、Pd上发生的反应为 B、Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用 C、反应过程中被氧化为 D、该反应的总方程式为12. 一种将催化转化为的电化学装置如图所示。下列说法错误的是( )
A、Pd上发生的反应为 B、Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用 C、反应过程中被氧化为 D、该反应的总方程式为12. 一种将催化转化为的电化学装置如图所示。下列说法错误的是( )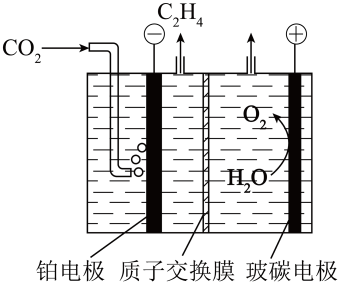 A、该装置工作过程中电能转化为化学能 B、铂电极发生的反应为 C、工作过程中玻碳电极区生成的通过质子交换膜向铂电极移动 D、每产生时,理论上有通过质子交换膜13. 用如图所示装置进行实验,能达到实验目的的是( )
A、该装置工作过程中电能转化为化学能 B、铂电极发生的反应为 C、工作过程中玻碳电极区生成的通过质子交换膜向铂电极移动 D、每产生时,理论上有通过质子交换膜13. 用如图所示装置进行实验,能达到实验目的的是( )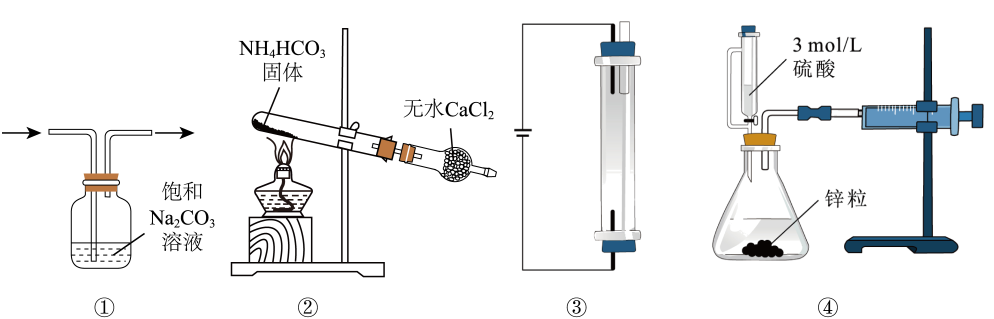 A、图①除去中的少量HCl B、图②实验室制取干燥的氨气 C、图③用石墨作电极电解饱和食盐水生产大量NaClO D、图④测量生成氢气的体积14. 常温下,溶液中、、三者所占物质的量分数(分布系数)随pH变化的关系如图所示,下列说法错误的是( )
A、图①除去中的少量HCl B、图②实验室制取干燥的氨气 C、图③用石墨作电极电解饱和食盐水生产大量NaClO D、图④测量生成氢气的体积14. 常温下,溶液中、、三者所占物质的量分数(分布系数)随pH变化的关系如图所示,下列说法错误的是( ) A、图中2代表随pH的变化曲线 B、常温下,0.1 mol/L的NaHR溶液中, C、的电离平衡常数的数量级为 D、图中M点对应的
A、图中2代表随pH的变化曲线 B、常温下,0.1 mol/L的NaHR溶液中, C、的电离平衡常数的数量级为 D、图中M点对应的二、工业流程题
-
15. 刚玉在工业上有广泛的用途.其主要成分为氧化铝。利用铝灰(主要成分为 , 含少量、、杂质),制备刚玉的工艺流程如图所示:

回答下列问题:
(1)、“浸取”步骤中发生反应的离子方程式为。(2)、滤渣1的主要成分为。(3)、“氧化”步骤中发生反应的离子方程式为 , 此步骤需控制温度低于40℃的原因是。(4)、试剂a为。(5)、已知:生成氢氧化物沉淀的pH如下表所示,则“调pH”的范围是。氢氧化物
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
(6)、Cu-Mn-Al合金的晶胞如图甲所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图乙是沿立方格子对角面取得的截图。基态锰原子的价电子排布图为 , 该晶体的化学式为。

三、实验题
-
16. 次磷酸钠()在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。请回答下列问题:(1)、次磷酸是一元弱酸(),则次磷酸钠()属于(填“正盐”“酸式盐”或“碱式盐”)。(2)、将待镀零件浸泡在和的混合溶液中,可达到化学镀镍的目的,该过程中被氧化为二元弱酸 , 写出该反应的离子方程式:。(3)、次磷酸钠的制备
将白磷()和过量烧碱溶液混合加热,生成和气体,气体与NaClO溶液反应可生成次磷酸。实验装置如图所示(部分装置省略):

①装置A中盛放白磷的仪器名称为 , 1 mol白磷中含有的共价键数目为。
②装置B的作用为。
③装置C中发生反应的化学方程式为。
④已知相关物质的溶解度如下表:
溶解度/g
物质
25℃
100℃
NaCl
37
39
100
667
充分反应后,将A、C中溶液混合,将混合液(含极少量NaOH)蒸发浓缩,有大量杂质晶体析出,然后 , 得到含的粗产品溶液,进一步处理得到粗产品。
(4)、产品纯度的计算取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入碘水,充分反应,然后以淀粉溶液作指示剂,用溶液滴定至终点,消耗溶液24.00mL,相关反应的方程式为、 , 则产品纯度为。
四、原理综合题
-
17. 2022年11月15日,二十国集团领导人第十七次峰会上.习近平主席发表题为《共迎时代挑战共建美好未来》的重要讲话,其中提及应对气候变化挑战、向绿色低碳发展转型等话题。请回答下列问题:(1)、一定条件下,与反应可转化为、 , 该反应不仅可以应用于温室气体的消除,实现低碳发展,还可以应用于空间站中与的循环,实现的再生。已知:
反应Ⅰ.
反应Ⅱ.
反应Ⅲ.
则。
(2)、一定条件下,利用甲烷可将还原为CO。在一容器中充入、气体各1.0 mol,发生反应 , 测得的平衡转化率随着温度、压强的变化曲线如图所示,则(填“”“”或“”),理由是;Q点的压强平衡常数(用平衡分压代替平衡浓度计算,气体的分压气体总压强该气体的物质的量分数)。 (3)、工业生产的烟气中常含有气态硫化物、氮化物等污染物,需经过除硫、除氮才能排放。
(3)、工业生产的烟气中常含有气态硫化物、氮化物等污染物,需经过除硫、除氮才能排放。①利用溶液可除去烟气中的气体,除硫原理如图所示:

实验室测得脱硫率与溶液pH、浓度()的关系如图所示,浓度大于时,脱硫率逐渐降低,原因是。

②利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂尾气净化工艺探索中,利用NaClO溶液为氧化剂,控制 , 将烟气中价硫的氧化物和价氮的氧化物转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
温度/℃
10
20
40
50
60
80
脱除率/%
91.6
97.5
98.9
99.9
99.1
97.2
NO
76.5
77.2
78.9
80.1
79.9
78.8
温度高于50℃时,脱除率逐渐降低,原因是;的脱除率比NO的高,原因是。(答出一点即可)
五、有机推断题
-
18. 药物M可用于治疗动脉硬化,其合成路线如图所示:
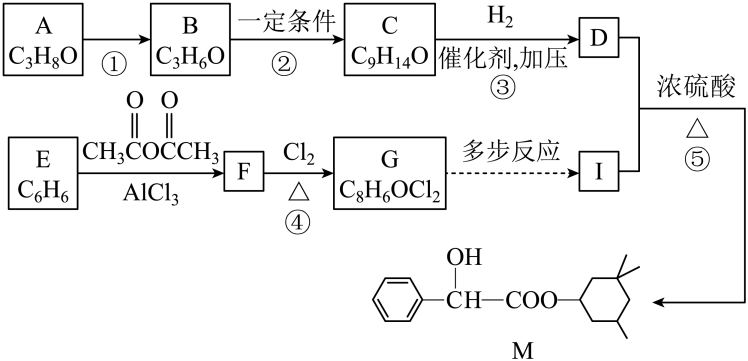
已知:①B的核磁共振氢谱只有1个峰;
②
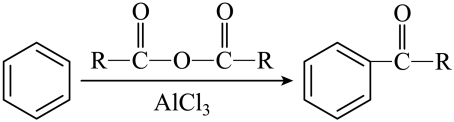 。
。回答下列问题:
(1)、有机物A的结构简式为 , B中官能团的名称为。(2)、有机物D的结构简式为。(3)、有机物E→F的反应类型为。(4)、反应④的化学方程式为。(5)、有机物M中碳原子的杂化方式为。(6)、G的同分异构体有多种,写出满足下列条件的同分异构体的结构简式:。①不存在顺反异构 ②结构中含有酚羟基 ③苯环上有两个取代基且位于间位
(7)、已知:
 +H2O ,请以G为原料,选择必要的无机试剂合成I,设计合成路线。
+H2O ,请以G为原料,选择必要的无机试剂合成I,设计合成路线。
-
-
-