广西壮族自治区钦州市2022-2023学年高二下学期期末化学试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 化学与生活密切相关。下列说法错误的是( )A、用活性炭除汽车里异味的过程为化学变化 B、可用、对饮用水进行消毒杀菌 C、二氧化硫具有还原性,可适量添加在葡萄酒中作抗氧化剂 D、液化石油气和天然气均属于清洁燃料,其主要成分均属于烃类2. 下列物质的化学用语表达正确的是( )A、甲烷的球棍模型:
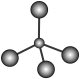 B、H2O分子间的氢键:
B、H2O分子间的氢键: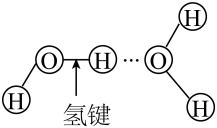 C、的结构式:
C、的结构式: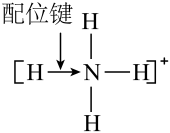 D、
D、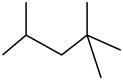 的名称:2,2,4−三甲基戊烷
3. 我国科学家首次在实验室实现了到淀粉的全合成。下列有关说法错误的是( )A、淀粉和纤维素都是天然高分子化合物 B、淀粉不能发生酯化反应 C、葡萄糖分子中含有4个手性碳原子 D、利用二氧化碳制备淀粉有利于实现“碳达峰”和“碳中和”4. 下列物质结构或性质比较中,前者大于后者的是( )A、熔点: B、键角: C、沸点:
的名称:2,2,4−三甲基戊烷
3. 我国科学家首次在实验室实现了到淀粉的全合成。下列有关说法错误的是( )A、淀粉和纤维素都是天然高分子化合物 B、淀粉不能发生酯化反应 C、葡萄糖分子中含有4个手性碳原子 D、利用二氧化碳制备淀粉有利于实现“碳达峰”和“碳中和”4. 下列物质结构或性质比较中,前者大于后者的是( )A、熔点: B、键角: C、沸点: 、
、 D、酸性:
5. 下列合成高分子化合物的反应及反应类型均正确的是( )A、有机玻璃{
D、酸性:
5. 下列合成高分子化合物的反应及反应类型均正确的是( )A、有机玻璃{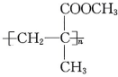 }由甲基丙烯酸甲酯发生缩聚反应制得
B、合成材料
}由甲基丙烯酸甲酯发生缩聚反应制得
B、合成材料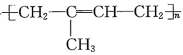 由丙烯和乙烯发生加聚反应制得
C、酚醛树脂{
由丙烯和乙烯发生加聚反应制得
C、酚醛树脂{ }由苯酚和甲醛发生缩聚反应制得
D、纤维
}由苯酚和甲醛发生缩聚反应制得
D、纤维 由己胺和己酸发生缩聚反应制得
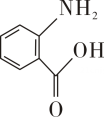
6. 下列有关有机化合物的研究方法、结构特点及性质的说法正确的是( )A、利用红外光谱可以确定有机物的相对分子质量 B、向蛋白质溶液中加入硫酸铵溶液,蛋白质的性质和生理功能会发生改变 C、研究有机物的基本步骤:分离、提纯→确定实验式→确定分子式→确定分子结构 D、实验室通常利用电石和水制备乙炔,并用氯化钠溶液除去乙炔中混有的等杂质气体7. 苹果中含有邻苯二酚(
由己胺和己酸发生缩聚反应制得
6. 下列有关有机化合物的研究方法、结构特点及性质的说法正确的是( )A、利用红外光谱可以确定有机物的相对分子质量 B、向蛋白质溶液中加入硫酸铵溶液,蛋白质的性质和生理功能会发生改变 C、研究有机物的基本步骤:分离、提纯→确定实验式→确定分子式→确定分子结构 D、实验室通常利用电石和水制备乙炔,并用氯化钠溶液除去乙炔中混有的等杂质气体7. 苹果中含有邻苯二酚(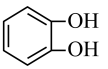 )等酚类化合物,苹果削过皮后在空气中放置过程中表面易变为黄褐色。下列说法错误的是( ) A、
)等酚类化合物,苹果削过皮后在空气中放置过程中表面易变为黄褐色。下列说法错误的是( ) A、 具有还原性,易被氧气氧化
B、1mol邻苯二酚最多可与4mol溴发生取代反应
C、邻苯二酚分子中的所有碳原子杂化方式相同
D、邻苯二酚自身可以发生加聚反应,生成聚合物
8. 下列关于原子结构及元素周期表的说法错误的是( )A、所含元素种类最多的族是第ⅢB族 B、同一原子中,2p、3p、4p能级的能量依次升高 C、在元素周期表中,ds区只有6种自然形成的元素,且均为金属元素 D、基态原子价层电子排布式为ns2的元素一定是第IIA族元素(n为周期数)9. 南开大学某团队报道了一种有机合成新方法,如图所示。下列叙述错误的是( )
具有还原性,易被氧气氧化
B、1mol邻苯二酚最多可与4mol溴发生取代反应
C、邻苯二酚分子中的所有碳原子杂化方式相同
D、邻苯二酚自身可以发生加聚反应,生成聚合物
8. 下列关于原子结构及元素周期表的说法错误的是( )A、所含元素种类最多的族是第ⅢB族 B、同一原子中,2p、3p、4p能级的能量依次升高 C、在元素周期表中,ds区只有6种自然形成的元素,且均为金属元素 D、基态原子价层电子排布式为ns2的元素一定是第IIA族元素(n为周期数)9. 南开大学某团队报道了一种有机合成新方法,如图所示。下列叙述错误的是( )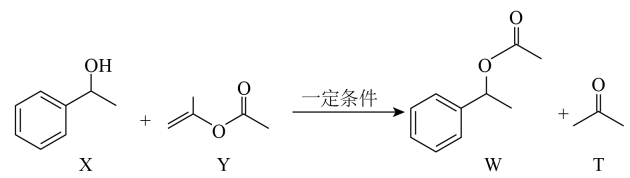 A、X、Y、W和T均能发生加成反应 B、X、Y、W和T均为烃的衍生物 C、T与2-己酮互为同系物 D、X的芳香族同分异构体有4种10. 乙酸异戊酯天然存在于香蕉、苹果等水果和浆果中,具有香蕉香味。某化学兴趣小组在实验室中利用乙酸和异戊醇(
A、X、Y、W和T均能发生加成反应 B、X、Y、W和T均为烃的衍生物 C、T与2-己酮互为同系物 D、X的芳香族同分异构体有4种10. 乙酸异戊酯天然存在于香蕉、苹果等水果和浆果中,具有香蕉香味。某化学兴趣小组在实验室中利用乙酸和异戊醇(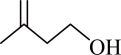 )制备乙酸异戊酯,实验装置如图1所示(加热及夹持仪器略),相关物质的部分性质如表所示。
)制备乙酸异戊酯,实验装置如图1所示(加热及夹持仪器略),相关物质的部分性质如表所示。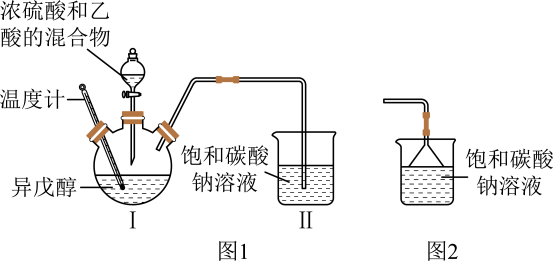
物质
密度/()
沸点/℃
水中溶解度
异戊醇
0.809
132
微溶
乙酸
l.049
118
易溶
乙酸异戊酯
0.876
142.5
微溶
下列说法错误的是( )
A、异戊醇的同分异构体中,与其含有相同官能团的结构有7种 B、实验中浓硫酸只起到催化作用和脱水作用 C、图1中的装置可用图2所示装置代替 D、实验中加入过量的异戊醇可提高乙酸的转化率11. X、Y、Z、M为原子序数依次增大的短周期主族元素。Y元素的最高正价与最低负价绝对值相等,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18。下列说法错误的是( )A、第一电离能:Z>Y>M B、Y、Z分别与X形成的最简单化合物的键角:Z<Y C、仅由X、Y、Z形成的化合物可能为离子晶体 D、1molMY晶体中含有1molM—Y键12. 设为阿伏加德罗常数的值。一种抗癌新药的活性成分MI-888的结构如图所示。下列叙述正确的是( )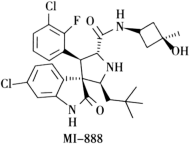 A、1molMI-888中卤素原子数为 B、1molMI-888中碳碳双键数为 C、MI-888中共有3种官能团 D、MI—888分子中,苯环上的一溴代物有3种13. 化学是以实验为基础的科学,下列实验操作或做法能达到实验目的的是( )
A、1molMI-888中卤素原子数为 B、1molMI-888中碳碳双键数为 C、MI-888中共有3种官能团 D、MI—888分子中,苯环上的一溴代物有3种13. 化学是以实验为基础的科学,下列实验操作或做法能达到实验目的的是( )选项
实验操作或做法
目的
A
将稀盐酸与碳酸钙反应产生的气体直接通入
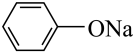 溶液中
溶液中验证酸性:
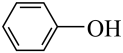
B
向洁净的试管中滴入10~15滴溴乙烷和5mL5%的溶液,振荡后加热,静置。待溶液分层后,取少量上层溶液,滴加2滴溶液,观察现象
检验溴乙烷中的溴
C
在洁净的试管中加入1mL2%的溶液,然后边振荡试管边逐滴滴入2%的氨水,使最初产生的沉淀溶解,再滴入3滴乙醛,振荡后将试管放在热水浴中温热
检验醛基
D
在试管中加入1mL淀粉溶液和2mL10%的溶液,加热煮沸,加入新制 , 加热并煮沸
检验淀粉水解产物
A、A B、B C、C D、D14. 我国科学家开发了一种新型手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物()作为G—quadruplexDNA稳定剂和端粒酶抑制剂。手性Ru(Ⅱ)—Pt(Ⅱ)双核配合物的化学结构∆/A—RuPt和相关的单一核配合物(Pt和)的结构如图所示。已知:在等价轨道上的电子排布采取全充满和半充满时,能量会较低,体系有更大的稳定性。下列说法正确的是( )
已知:Ru(Ⅱ)表示+2价Ru,Pt(Ⅱ)的配位数为4。
A、与位于同一周期,基态Pd的价层电子排布式为 B、单一核配合物Pt中的配位原子只有N原子 C、中Ru原子与Pt原子的配位数相同 D、中Ru提供空轨道形成配位键15. 的配位化合物较稳定且应用广泛。可与、、等配体形成使溶液呈浅紫色的、红色的、无色的等配离子。某同学按如下步骤进行实验:
已知:大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为。下列说法正确的是( )
A、的第一电离能大于的第一电离能 B、与均为直线形结构,中存在大π键,可表示为 C、基态和基态的核外电子排布中,未成对电子数之比 D、中的键角小于分子中的键角16. 在无机氟化物制备中有广泛的应用,其晶体属于四方晶系,晶胞参数如图所示,其中O点原子和①号原子的分数坐标依次为、。已知:Xe—F键长为下列说法正确的是( )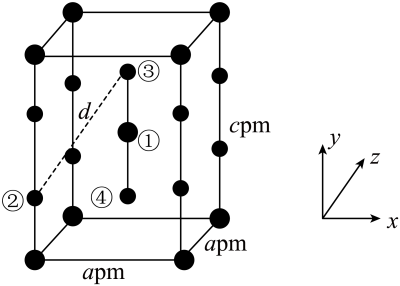 A、中心原子上的孤电子对数为2 B、④号原子的分数坐标为 C、沿x、y、z任意一个方向投影,位于面中心的都只有原子 D、晶胞中②③号原子间的距离
A、中心原子上的孤电子对数为2 B、④号原子的分数坐标为 C、沿x、y、z任意一个方向投影,位于面中心的都只有原子 D、晶胞中②③号原子间的距离二、结构与性质
-
17. 第三周期几种氧化物(不包括过氧化物和超氧化物)的离子键成分的百分数如图所示。回答下列问题:
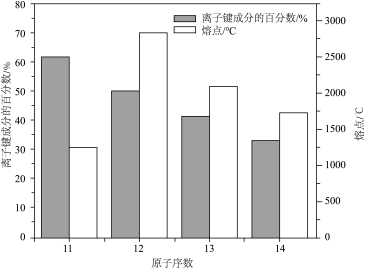 (1)、离子键成分的百分数最高的是(填化学式)。(2)、的熔点(填“高于”或“低于”)Na2O,原因是。(3)、根据图示推知,第三周期主族元素最高价氧化物中离子键成分的百分数最低的是(填化学式)。(4)、晶胞结构如图所示,设晶胞的边长为 , 为阿伏加德罗常数的值。
(1)、离子键成分的百分数最高的是(填化学式)。(2)、的熔点(填“高于”或“低于”)Na2O,原因是。(3)、根据图示推知,第三周期主族元素最高价氧化物中离子键成分的百分数最低的是(填化学式)。(4)、晶胞结构如图所示,设晶胞的边长为 , 为阿伏加德罗常数的值。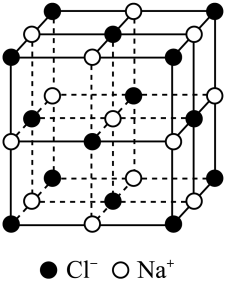
①1个晶胞的质量为g。
②与最近且等距离的数为。
③阳离子填充在阴离子构成的(填标号)空隙中。
A.正八面体 B.正四边形 C.正四面体 D.正三角锥形
④该晶胞的密度为。
三、实验题
-
18. 肉桂酸是无公害的环保防腐剂,可直接添加于食品中。某小组设计实验制备肉桂酸并探究其性质:
【原理】
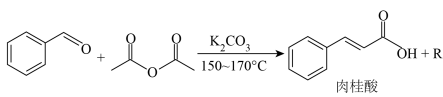
【性质】
物质
苯甲醛
肉桂酸
乙酸酐
沸点
水溶性
微溶于水、无色油状液体
难溶于冷水、易溶于热水
与水反应生成乙酸
【步骤】

【装置】利用图1装置完成步骤①,利用图2装置完成步骤②,抽滤操作用图3装置。
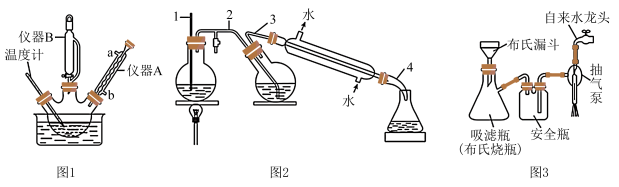
回答下列问题:
(1)、R是(填结构简式)。(2)、图1中,仪器B的名称是 , 仪器A的作用是。实验前,要烘干三颈烧瓶,目的是。(3)、相比于普通过滤,图3抽滤的主要优点有(答一条即可)。(4)、步骤③加入溶液的作用是 , 第二次抽滤得到滤饼的主要成分是(填名称)。(5)、设计简单实验证明肉桂酸中含有碳碳双键:。四、工业流程题
-
19. 将废旧锌锰电池进行回收处理以实现资源的再生利用,初步处理后的废料中含、、及等,用该废料制备和的一种工艺流程如图:

已知:①Mn的金属活动性强于Fe,在酸性条件下比较稳定,pH大于5.5时易被氧化。
②相关物质的数据如表所示。
化合物
回答下列问题:
(1)、为加快“还原焙烧”时的反应速率,可采取的措施有(填一条),该过程中生成的气体产物有、和(填化学式);“酸浸”后分离出滤渣1的操作名称为。(2)、已知,“净化”时溶液中、的物质的量浓度均约为 , 当金属离子的浓度小于时可认为该离子完全沉淀,则“净化”时调节的合理范围是。(3)、通过“电解”滤液2制备和 , 若电路中转移电子,溶液的将(填“增大”或“减小”)。(4)、为两性氢氧化物,可溶于溶液,反应为 , 其平衡常数{已知:的平衡常数称为稳定平衡常数,。(5)、在条件下,和按4:1的物质的量比发生反应制得 , 同时产物还有和 , 则该反应中n(氧化产物):n(还原产物)=;以石墨和为电极材料可制作可充电电池,该电池的总反应为 , 充电时电极上发生的电极反应为 , 若此时电路中转移 , 则石墨电极将增重g。五、有机推断题
-
20. 一种荧光探针(E)的合成路线如图:
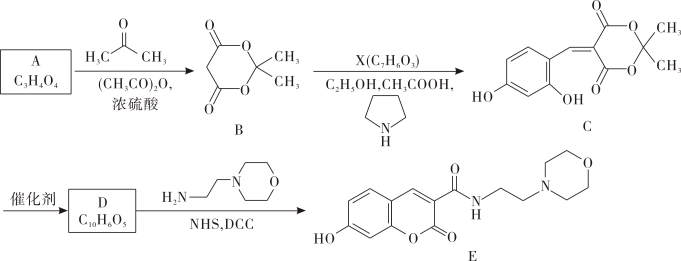
已知:
 (1)、A的名称为;C中的含氧官能团的名称为。(2)、B→C反应的化学方程式为。(3)、D→E反应的反应类型为 , D的结构简式为 , 1molD与足量溶液充分反应,最多可消耗mol。(4)、W与X互为同系物且W的碳原子数比X多1,H与W互为同分异构体,则满足下列条件的H的结构有种(不考虑立体异构)。
(1)、A的名称为;C中的含氧官能团的名称为。(2)、B→C反应的化学方程式为。(3)、D→E反应的反应类型为 , D的结构简式为 , 1molD与足量溶液充分反应,最多可消耗mol。(4)、W与X互为同系物且W的碳原子数比X多1,H与W互为同分异构体,则满足下列条件的H的结构有种(不考虑立体异构)。①能与溶液发生显色反应
②可与溶液反应
(5)、根据以上信息,写出以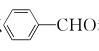 和为原料制备
和为原料制备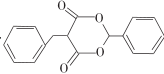
的合成路线流程图。(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)
-
-
-