云南省昆明市2022-2023学年高二下学期7月化学期末试题
试卷更新日期:2023-09-11 类型:期末考试
一、单选题
-
1. 下列关于化学品合理使用的说法错误的是( )A、石膏的主要成分是 , 可用于制豆腐 B、除虫菊中含有的除虫菊酯是一种天然杀虫剂 C、味精能增加食品的鲜味,是一种常用增味剂 D、包装上有“OTC”标识的药物不需要医生处方,可直接从药店购买2. 下列说法正确的是( )


A.基态锂原子最高能级的电子云轮廓图
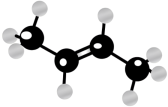
B.分子的空间填充模型
C.顺-2-丁烯的分子结构模型
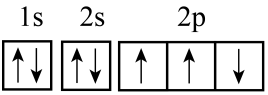
D.基态氮原子的电子排布图
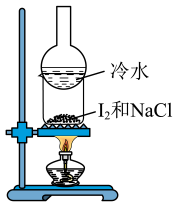
A、A B、B C、C D、D3. 用下列实验装置进行相应实验,其中不能达到实验目的的是( )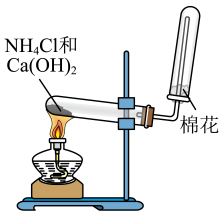
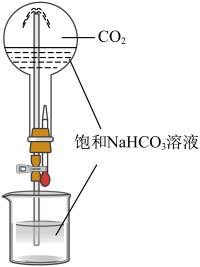
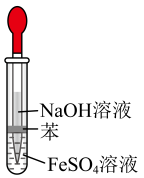
A.实验室制备
B.分离和
C.喷泉实验
D.制备
A、A B、B C、C D、D4. 下列说法正确的是( )A、糖类、氨基酸、蛋白质均是两性化合物 B、高分子材料能以石油、煤等化石燃料为原料进行生产 C、淀粉和纤维素在人体内的最终水解产物都是葡萄糖 D、棉花、羊毛、植物油、天然橡胶均属于天然有机高分子5. 氮、硫元素的单质和化合物在工农生产中有重要应用。部分含氮、硫元素物质的价类二维图如图所示。下列有关说法错误的是( )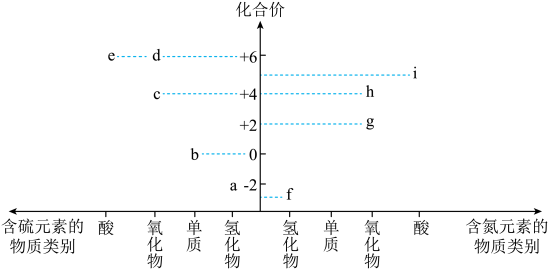 A、f可作制冷剂 B、溶液可鉴别c和d C、f与氧气反应可以一步转化为h D、i的浓溶液一般保存在棕色试剂瓶中6. 下列离子方程式正确的是( )A、电解饱和食盐水: B、溶液刻蚀电路铜板: C、泡沫灭火器原理: D、溶液中通入少量氯气:7. 双氯芬酸具有解热镇痛的作用,其结构简式如图。下列关于双氯芬酸的说法正确的是( )
A、f可作制冷剂 B、溶液可鉴别c和d C、f与氧气反应可以一步转化为h D、i的浓溶液一般保存在棕色试剂瓶中6. 下列离子方程式正确的是( )A、电解饱和食盐水: B、溶液刻蚀电路铜板: C、泡沫灭火器原理: D、溶液中通入少量氯气:7. 双氯芬酸具有解热镇痛的作用,其结构简式如图。下列关于双氯芬酸的说法正确的是( )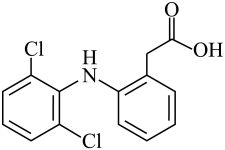 A、分子式为 B、分子中所有原子可能共平面 C、分子中苯环上的一溴取代物有4种 D、双氯芬酸能发生加成反应、取代反应8. 短周期主族元素X、Y、Z、W原子序数依次增大,X的简单气态氢化物溶于水呈碱性,基态Y原子无未成对电子,Z的某种氧化物具有漂白性。下列说法正确的是( )A、电负性:W<Z<X B、原子半径: C、最高价氧化物对应水化物的酸性:W<Z D、Y的单质与X、Z、W的单质均能发生反应9. 实验室常用标定 , 同时使再生,其反应原理如图所示。下列说法错误的是( )
A、分子式为 B、分子中所有原子可能共平面 C、分子中苯环上的一溴取代物有4种 D、双氯芬酸能发生加成反应、取代反应8. 短周期主族元素X、Y、Z、W原子序数依次增大,X的简单气态氢化物溶于水呈碱性,基态Y原子无未成对电子,Z的某种氧化物具有漂白性。下列说法正确的是( )A、电负性:W<Z<X B、原子半径: C、最高价氧化物对应水化物的酸性:W<Z D、Y的单质与X、Z、W的单质均能发生反应9. 实验室常用标定 , 同时使再生,其反应原理如图所示。下列说法错误的是( )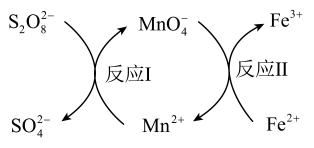 A、属于盐类 B、发生反应I后溶液酸性增强 C、和在水溶液中能大量共存 D、发生反应I和反应Ⅱ时,溶液颜色均发生了变化10. 的结构如图所示。下列说法正确的是( )
A、属于盐类 B、发生反应I后溶液酸性增强 C、和在水溶液中能大量共存 D、发生反应I和反应Ⅱ时,溶液颜色均发生了变化10. 的结构如图所示。下列说法正确的是( )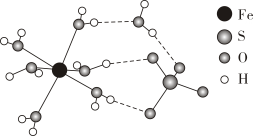 A、O的第一电离能低于S B、相同条件下,的稳定性比强 C、基态的价层电子排布式为 D、该物质中存在的化学键类型有:离子键、共价键、氢键11. 下列实验操作和现象得出的实验结论正确的是( )
A、O的第一电离能低于S B、相同条件下,的稳定性比强 C、基态的价层电子排布式为 D、该物质中存在的化学键类型有:离子键、共价键、氢键11. 下列实验操作和现象得出的实验结论正确的是( )选项
实验操作
实验现象
实验结论
A
将镀层破损的镀锌铁片放入溶液中,一段时间后,加入溶液
未出现蓝色沉淀
镀层破损后锌对铁仍有保护作用
B
常温下,将铁片、铜片分别插入浓硝酸中
铁无明显变化、铜片剧烈反应
金属活动性:Cu>Fe
C
取少量待测液于试管中,加入少量稀溶液,将湿润的红色石蕊试纸放在试管口
试纸不变蓝
溶液中不含
D
向含有和的悬浊液中滴加溶液
生成黑色沉淀
A、A B、B C、C D、D12. 工业上广泛采用二氟一氯甲烷热解制四氟乙烯: , 其他条件不变时,温度对的平衡转化率、催化剂的催化效率的影响如图所示,下列说法正确的是( ) A、平衡常数: B、该反应的逆反应活化能高于正反应活化能 C、反应过程中涉及极性键的断裂和非极性键的形成 D、单位时间内的转化率:13. 锂二氧化碳电池可在常温下同时实现二氧化碳的锚定与转化,可以在深海作业、火星探测等高二氧化碳的环境中得到应用,电池总反应为:。下列说法错误的是( )
A、平衡常数: B、该反应的逆反应活化能高于正反应活化能 C、反应过程中涉及极性键的断裂和非极性键的形成 D、单位时间内的转化率:13. 锂二氧化碳电池可在常温下同时实现二氧化碳的锚定与转化,可以在深海作业、火星探测等高二氧化碳的环境中得到应用,电池总反应为:。下列说法错误的是( ) A、该电池不能用水溶液作为电解液 B、放电时,正极的电极反应为: C、充电时,锂电极与外接电源负极相连 D、充电时,当生成(标准状况下) , 通过隔膜迁移的数目为14. 常温时,用溶液滴定二元酸溶液,溶液中含A微粒的分布系数随pH的变化关系如图所示,[如的分布系数:]。下列说法错误的是( )
A、该电池不能用水溶液作为电解液 B、放电时,正极的电极反应为: C、充电时,锂电极与外接电源负极相连 D、充电时,当生成(标准状况下) , 通过隔膜迁移的数目为14. 常温时,用溶液滴定二元酸溶液,溶液中含A微粒的分布系数随pH的变化关系如图所示,[如的分布系数:]。下列说法错误的是( )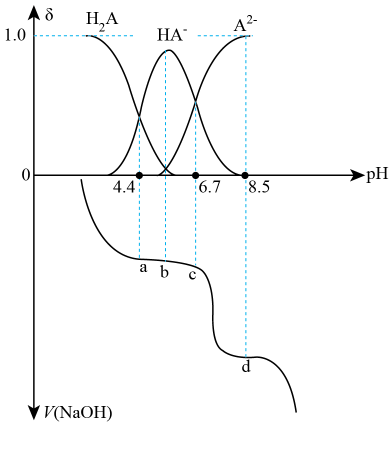 A、第二次突变时,可选用酚酞作指示剂 B、溶液中存在: C、c点存在: D、的平衡常数
A、第二次突变时,可选用酚酞作指示剂 B、溶液中存在: C、c点存在: D、的平衡常数二、元素或物质推断题
-
15. X、Y、Z、W是由四种常见短周期元素形成的化合物,灼烧时火焰均呈黄色,X常用于呼吸面具中氧气的来源,W具有漂白作用。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
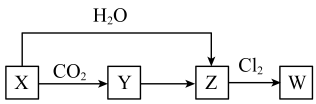
回答下列问题:
(1)、X的化学式为 , 含有的化学键有。(2)、X→Y的化学方程式为。(3)、Z→W的离子方程式为。三、填空题
-
16. 游离态的硫存在于火山口附近或地壳的岩层中,火山喷发会释放、、等气体。回答下列问题:(1)、上述气体中(填化学式)是形成酸雨的主要物质。(2)、的结构与类似,其电子式为。(3)、S与Cu反应的化学方程式为。(4)、能与反应,产物中氧化产物与还原产物的物质的量之比为。
四、原理综合题
-
17. 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。
主反应:
副反应:
回答下列问题:
(1)、相关化学键的键能数据如下:化学键
C=O
H—H
C—H
C—O
O—H
键能
803
436
414
X
464
则x= , 主反应在(填“高温”“低温”或“任意温度”)条件下能自发进行。
(2)、主反应在铜催化下的反应历程如下:序号
基元反应
(活化能/eV)
(反应能/eV)
①
0.20
②
1.27
0.55
③
0.76
④
0.42
0.35
⑤
0.11
⑥
0.89
0.37
⑦
1.01
0.32
决定主反应速率的基元反应为(填标号),原因是。
(3)、和按物质的量之比 , 在压强为 , 催化下进行反应,测得转化率和选择性[选择性=%]随温度的变化如图所示:
①温度高于℃,转化率增大的原因可能是。
②某温度时,若测得转化率为25%,的选择性为20%,副反应的压力商(以分压代替浓度进行计算,分压=总压×物质的量分数,保留一位有效数字)。
③若想要提高的产率,除改变温度外,还可采取的措施有。
五、工业流程题
-
18. 以某混合氧化物(由、、、组成)为原料制备和的工艺流程如下:
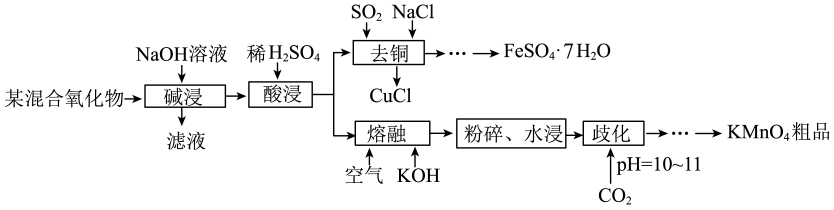
回答下列问题:
(1)、基态Mn原子核外电子排布式为。(2)、“碱浸”时,发生反应的化学方程式为。(3)、“去铜”时,发生反应的离子方程式为。(4)、已知“歧化”时反应为。常温下,相关物质的溶解度数据如下:物质
溶解度(水)
111
33.7
6.34
通入至溶液pH达10~11时,应停止通 , 依据上表数据说明不能继续通入的原因是。
(5)、的纯度测定:已知酸性条件下与反应,生成和 , 杂质不参与反应。称取粗品于烧杯中,加入蒸馏水和稀硫酸溶解,再用的溶液平行滴定3次,平均消耗溶液。样品的纯度为%(用含m的代数式表示)。六、实验题
-
19. 在无水的催化作用下,利用乙醇制备乙烯的反应温度为120℃。某同学据此原理制备收集乙烯并验证乙烯的性质,反应装置如下图所示:
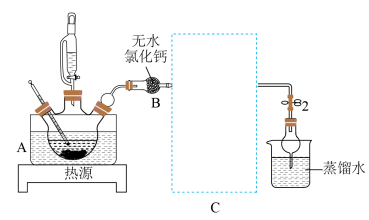
回答下列问题:
(1)、容器A中应加入(填“水”或“油”)作为热传导介质,该加热方式相较直接加热的优势是。(2)、装置B的名称为。(3)、为收集较纯净的乙烯气体,装置C最适宜选择的是(如下图,填标号)。
反应开始应先关闭止水夹1打开止水夹2,待出现现象时,打开止水夹1关闭止水夹2,开始收集乙烯气体。
(4)、若将装置C连接如图装置,观察到澄清石灰水变浑浊,写出乙烯与酸性反应的离子方程式。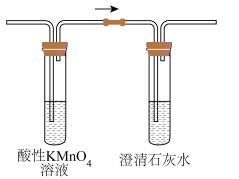 (5)、该催化机理如下图所示,中间产物生成的反应方程式为。
(5)、该催化机理如下图所示,中间产物生成的反应方程式为。
七、有机推断题
-
20. 利伐沙班是一种抗凝血药物。E(
 )是合成利伐沙班的重要中间体,该中间体的一种合成路线如下:
)是合成利伐沙班的重要中间体,该中间体的一种合成路线如下: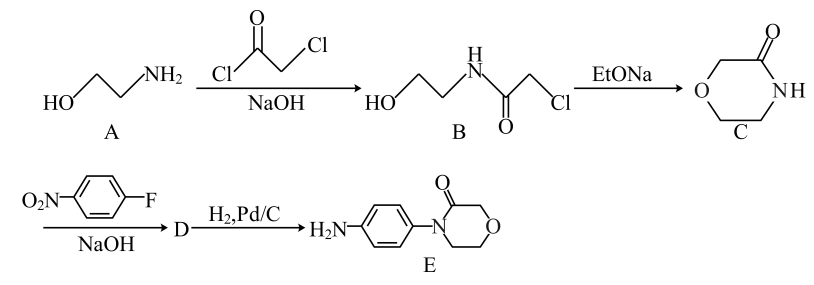
已知:

回答下列问题:
(1)、A中官能团名称为、。(2)、D的结构简式为。(3)、写出A生成B的化学方程式。(4)、D生成E的反应类型为。(5)、B的同分异构体中属于α-氨基酸的有种(不考虑立体异构),其中有2个手性碳原子的同分异构体的结构简式为。
-
-
-
-
-