北京市东城区2023年中考二模化学试题
试卷更新日期:2023-08-31 类型:中考模拟
一、单选题
-
1. 地壳中含量最多的元素是( )A、Si B、Al C、O D、Fe2. 下列人体所必需的元素中,缺乏会引起骨质疏松的是( )A、Zn B、Fe C、Ca D、K3. 铝片能压成铝箔,说明铝具有良好的( )A、导电性 B、导热性 C、延展性 D、抗腐蚀性4. 下列属于混合物的是( )A、蒸馏水 B、食盐水 C、纯碱 D、乙醇5. 下列属于金属元素的是( )A、N B、S C、Cl D、Mg6. 下列符号中,表示2个氢分子的是( )A、H2 B、2H C、2H2 D、2H2O7. 下列物质在空气中燃烧产生大量白烟的是( )A、铁丝 B、甲烷 C、红磷 D、木炭8. 属于有机物的是( )A、CO2 B、CaCO3 C、H2CO3 D、CH49. 镓作为半导体材料在现代电子及通信技术领域应用广泛。镓在元素周期表中的信息如下图所示,下列有关镓元素的说法不正确的是( )
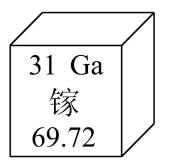 A、原子序数是31 B、元素符号是Ga C、原子中的质子数是31 D、相对原子质量为69.72g10. 下列氧气的性质中,属于化学性质的是( )A、不易溶于水 B、能支持燃烧 C、密度比空气的大 D、无色无味11. 下列物质具有挥发性的是( )A、浓盐酸 B、浓硫酸 C、氢氧化钠溶液 D、氯化钠溶液12. 下列实验操作不正确的是( )A、
A、原子序数是31 B、元素符号是Ga C、原子中的质子数是31 D、相对原子质量为69.72g10. 下列氧气的性质中,属于化学性质的是( )A、不易溶于水 B、能支持燃烧 C、密度比空气的大 D、无色无味11. 下列物质具有挥发性的是( )A、浓盐酸 B、浓硫酸 C、氢氧化钠溶液 D、氯化钠溶液12. 下列实验操作不正确的是( )A、 点燃酒精灯
B、
点燃酒精灯
B、 倾倒液体
C、
倾倒液体
C、 滴加液体
D、
滴加液体
D、 检查气密性
13. 下列物质中,可用于除铁锈的是( )A、水 B、盐酸 C、NaOH溶液 D、食盐水14. 下列物质的化学式不正确的是( )A、生石灰 CaO B、熟石灰 CaCO3 C、硫酸钠 Na2SO4 D、氯化铜 CuCl215. 氯化胆碱(C5H14ClNO)可作为植物光合作用的促进剂,帮助提高作物的产量。组成C5H14ClNO的元素种类为( )A、3种 B、4种 C、5种 D、6种16. 下列做法不正确的是( )A、炒菜时油锅着火,立即盖上锅盖 B、天然气泄漏,立即关闭阀门并开窗通风 C、燃着的酒精灯不慎碰倒,立即用湿布盖灭 D、正在使用的家用电器着火,立即用水浇灭17. 下列方法能区分二氧化碳和空气两瓶气体的是( )
检查气密性
13. 下列物质中,可用于除铁锈的是( )A、水 B、盐酸 C、NaOH溶液 D、食盐水14. 下列物质的化学式不正确的是( )A、生石灰 CaO B、熟石灰 CaCO3 C、硫酸钠 Na2SO4 D、氯化铜 CuCl215. 氯化胆碱(C5H14ClNO)可作为植物光合作用的促进剂,帮助提高作物的产量。组成C5H14ClNO的元素种类为( )A、3种 B、4种 C、5种 D、6种16. 下列做法不正确的是( )A、炒菜时油锅着火,立即盖上锅盖 B、天然气泄漏,立即关闭阀门并开窗通风 C、燃着的酒精灯不慎碰倒,立即用湿布盖灭 D、正在使用的家用电器着火,立即用水浇灭17. 下列方法能区分二氧化碳和空气两瓶气体的是( ) A、闻气味 B、观察颜色 C、将燃着的木条伸入瓶中 D、倒入相同体积的水18. 下列化学方程式书写正确的是( )A、3Fe+2O2=Fe3O4 B、CO2+NaOH=Na2CO3+H2O C、C+O2CO2 D、2Fe+6HCl=2FeCl3+3H2↑19. 土壤的酸碱度会影响植物的生长。下列植物适宜在微碱性土壤中种植的是( )
A、闻气味 B、观察颜色 C、将燃着的木条伸入瓶中 D、倒入相同体积的水18. 下列化学方程式书写正确的是( )A、3Fe+2O2=Fe3O4 B、CO2+NaOH=Na2CO3+H2O C、C+O2CO2 D、2Fe+6HCl=2FeCl3+3H2↑19. 土壤的酸碱度会影响植物的生长。下列植物适宜在微碱性土壤中种植的是( )植物
杜鹃
文竹
百合
仙人掌
适宜的pH范围
5.0~6.8
6.0~7.0
5.0~6.0
7.0~8.0
A、杜鹃 B、文竹 C、百合 D、仙人掌20. 下列化肥中,属于钾肥的是( )A、K2SO4 B、NH4HCO3 C、NH4NO3 D、Ca3(PO4)221. 不同温度下KCl的溶解度如下表所示。下列说法正确的是( )温度/℃
20
30
40
50
60
溶解度/g
34.0
37.0
40.0
42.6
45.5
A、40℃时,100gKCl饱和溶液中溶质的质量为40g B、将20℃的KCl饱和溶液升温至50℃,溶液仍为饱和溶液 C、将50℃的KCl饱和溶液降温至30℃,溶液变为不饱和溶液 D、60℃时,向100g水中加入50gKCl,充分溶解,所得溶液为饱和溶液22. 下列有关能量变化的描述不正确的是( )A、氢氧化钠溶于水吸收热量 B、氧化钙与水反应放出热量 C、浓硫酸稀释放出热量 D、酒精燃烧放出热量23. 下列两个关于水的实验,有关说法不正确的是( )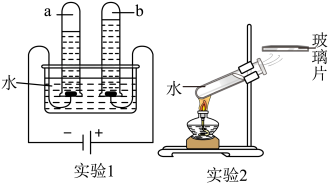 A、实验1,变化前后分子种类改变 B、实验1,变化前后分子总数不变 C、实验1,变化前后原子种类、个数均不变 D、实验2,变化前后分子种类、个数均不变24. 将二氧化碳转化为乙醇,反应前后分子种类变化的微观示意图如下。
A、实验1,变化前后分子种类改变 B、实验1,变化前后分子总数不变 C、实验1,变化前后原子种类、个数均不变 D、实验2,变化前后分子种类、个数均不变24. 将二氧化碳转化为乙醇,反应前后分子种类变化的微观示意图如下。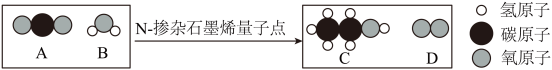
下列说法正确的是( )
A、B是H2O2 B、C中的碳、氧元素质量比为2:1 C、两种生成物均为单质 D、参加反应的A与B的分子个数比为2:325. 利用铁在空气中生锈的原理测定空气中氧气含量,实验装置如下。下列说法不正确的是( )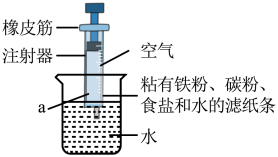 A、实验所用注射器气密性应良好 B、最终注射器内水面高度接近a C、该实验铁粉用量不影响实验结果
A、实验所用注射器气密性应良好 B、最终注射器内水面高度接近a C、该实验铁粉用量不影响实验结果二、填空题
-
26. 爆竹中火药的主要成分有硫粉(S)、木炭粉(C)、硝酸钾(KNO3)等。(1)、下列为“禁止燃放鞭炮”标志的是____(填序号)。A、
 B、
B、 C、
C、 (2)、火药的主要成分中属于化合物的是。27. 我国新版《生活饮用水卫生标准》于2023年4月1日正式实施。(1)、某水样检测出含氮、磷等,这里的氮、磷是指____(填序号)。A、单质 B、分子 C、原子 D、元素(2)、为使水澄清透明,净化水时可加入絮凝剂,使杂质沉降,然后通过(填操作名称)而实现。(3)、新标准明确规定生活饮用水的pH范围,测定水样酸碱度—pH,可选用。28. 如图是电子节能灯的结构图。
(2)、火药的主要成分中属于化合物的是。27. 我国新版《生活饮用水卫生标准》于2023年4月1日正式实施。(1)、某水样检测出含氮、磷等,这里的氮、磷是指____(填序号)。A、单质 B、分子 C、原子 D、元素(2)、为使水澄清透明,净化水时可加入絮凝剂,使杂质沉降,然后通过(填操作名称)而实现。(3)、新标准明确规定生活饮用水的pH范围,测定水样酸碱度—pH,可选用。28. 如图是电子节能灯的结构图。 (1)、节能灯各部件所用材料中属于金属材料的是(任写一种)。(2)、灯管内充入氩气作保护气,利用了氩气的性质是。(3)、铁是重要的金属。用一氧化碳还原氧化铁炼铁的化学方程式为。
(1)、节能灯各部件所用材料中属于金属材料的是(任写一种)。(2)、灯管内充入氩气作保护气,利用了氩气的性质是。(3)、铁是重要的金属。用一氧化碳还原氧化铁炼铁的化学方程式为。三、科普阅读题
-
29. 阅读下面科普短文。
春季是呼吸道传染病的高发季节,佩戴口罩是预防呼吸道传染病的重要方法。口罩具有阻挡有害气体、粉尘、飞沫、病毒等物质的作用。
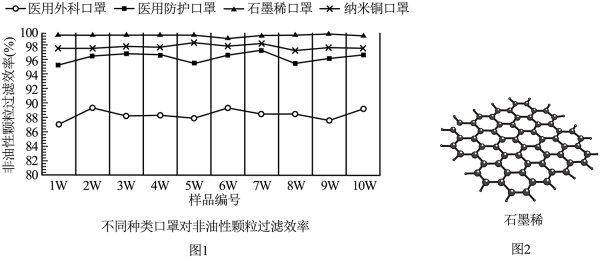
制作口罩的材料主要包括织物、熔喷布、无纺布等传统材料,以及石墨烯、纳米铜等新型材料。对非油性颗粒的过滤效率是衡量口罩防护性能的重要指标。针对不同种类的口罩(由同一厂家提供同生产批次各10个口罩作为样品),检测其对非油性颗粒的过滤效率,检测结果如图1。对每种口罩的10个样品的过滤效率进行方差计算,数值越小则过滤效率越稳定,实验结果见表1。
表1 不同种类口罩过滤效率方差计算结果
口罩
类型
外科
口罩
医用防护
口罩
石墨烯
口罩
纳米铜
口罩
方差
0.007245
0.006827
0.001744
0.003072
结果表明,不同种类的口罩对非油性颗粒的过滤效率均符合国家标准。
石墨烯是一种由单层碳原子组成的二维多功能纳米材料,其结构如图2。石墨烯制成的口罩抗菌性更强、透气性更好、使用时间更长,被广泛关注。
人们应根据场合、用途选择适宜的口罩,在合理防护的同时避免过度防护。
依据文章内容问答下列问题:
(1)、制作口罩的新型材料有。(2)、对比图1中不同种类口罩的结果,可得出的结论是。(3)、由表1数据可知,____(填序号)对非油性颗粒的过滤效率最不稳定。A、医用外科口罩 B、医用防护口罩 C、石墨烯口罩 D、纳米铜口罩(4)、判断下列说法是否正确(填“对”或“错”)。①石墨烯充分燃烧的产物是CO2。
②抗菌性强是石墨烯口罩的优点之一。
四、流程题
-
30. 利用富氧燃烧捕捉技术生产高纯度CO2 , 处理煤电厂排放的烟气,其主要流程如下图。
 (1)、为了使煤在富氧锅炉中充分燃烧,采取的措施是。(2)、能推断出煤中含有硫元素的证据是。(3)、液化精馏系统中,通过先液化再精馏实现CO2与其他气体的分离,该过程发生的是(填“物理”或“化学”)变化。31. 利用废旧电池铜帽(含Cu、Zn)制取海绵铜的主要流程如下图。
(1)、为了使煤在富氧锅炉中充分燃烧,采取的措施是。(2)、能推断出煤中含有硫元素的证据是。(3)、液化精馏系统中,通过先液化再精馏实现CO2与其他气体的分离,该过程发生的是(填“物理”或“化学”)变化。31. 利用废旧电池铜帽(含Cu、Zn)制取海绵铜的主要流程如下图。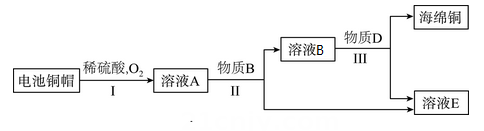
已知:①2Cu + 2H2SO4 + O22CuSO4 + 2H2O;②流程中各步反应所加试剂均过量。
(1)、反应池I中,Zn能与稀H2SO4发生置换反应而Cu不能的原因是。(2)、反应池II中发生反应的化学方程式为:Zn + CuSO4 = ZnSO4 + Cu,。(3)、反应池III中加入稀H2SO4的目的是。五、实验题
-
32. 实验室配制50 g 溶质质量分数为6%的氯化钠溶液。
 (1)、需要称量氯化钠的质量为g。(2)、实验操作的正确顺序为。(3)、配制好的溶液要装在试剂瓶中,并贴好标签。在图示的标签中填上相应的内容。
(1)、需要称量氯化钠的质量为g。(2)、实验操作的正确顺序为。(3)、配制好的溶液要装在试剂瓶中,并贴好标签。在图示的标签中填上相应的内容。 33. 用如图所示实验验证可燃物的燃烧条件。
33. 用如图所示实验验证可燃物的燃烧条件。
已知:白磷和红磷的着火点分别为40℃、240℃。
(1)、a处白磷燃烧,b处红磷不燃烧,说明可燃物燃烧的条件之一是。(2)、能验证可燃物燃烧需要与O2接触的现象是。34. 验证质量守恒定律,设计如下实验。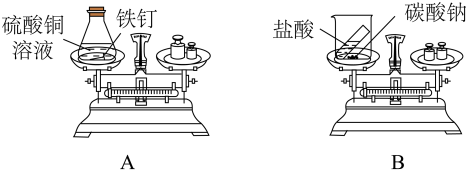 (1)、A中反应的化学方程式为。(2)、A实验可以验证质量守恒定律的现象为:铁钉表面附着红色物质,溶液颜色变为浅绿色,。(3)、B实验无法验证质量守恒定律的原因是。35. 实验小组同学做了如下实验。
(1)、A中反应的化学方程式为。(2)、A实验可以验证质量守恒定律的现象为:铁钉表面附着红色物质,溶液颜色变为浅绿色,。(3)、B实验无法验证质量守恒定律的原因是。35. 实验小组同学做了如下实验。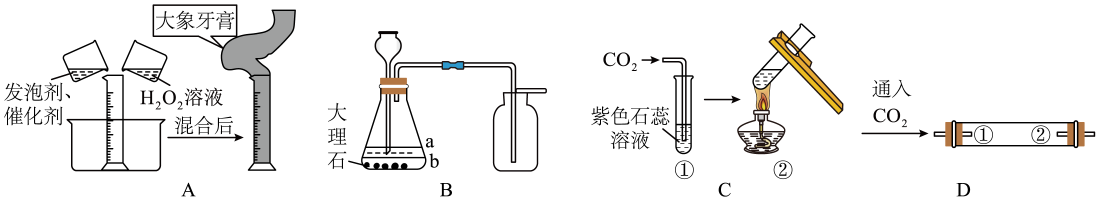 (1)、A是“大象牙膏”趣味实验,现象为迅速涌出柱状的泡沫,其原理主要是H2O2在某些催化剂作用下迅速分解产生水和氧气,反应的化学方程式为。(2)、B实验用于制取CO2 , 向锥形瓶中加入适量稀盐酸,盐酸液面应位于(填“a”或“b”)处。(3)、C实验②中的现象是。(4)、D实验,为了验证CO2能与H2O反应,①、②处可分别放置。36. 用如图装置验证Al、Cu、Ag三种金属的活动性顺序。
(1)、A是“大象牙膏”趣味实验,现象为迅速涌出柱状的泡沫,其原理主要是H2O2在某些催化剂作用下迅速分解产生水和氧气,反应的化学方程式为。(2)、B实验用于制取CO2 , 向锥形瓶中加入适量稀盐酸,盐酸液面应位于(填“a”或“b”)处。(3)、C实验②中的现象是。(4)、D实验,为了验证CO2能与H2O反应,①、②处可分别放置。36. 用如图装置验证Al、Cu、Ag三种金属的活动性顺序。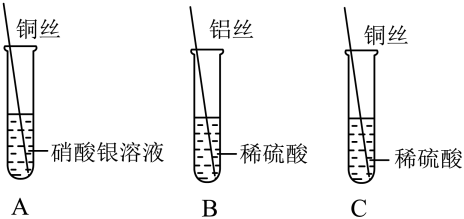 (1)、实验A可得出Cu的金属活动性比Ag强,反应的化学方程式为。(2)、能证明Al的金属活动性比Cu强的实验现象是 。
(1)、实验A可得出Cu的金属活动性比Ag强,反应的化学方程式为。(2)、能证明Al的金属活动性比Cu强的实验现象是 。六、填空题
-
37. 化学小组进行如下实验。
 (1)、A中反应的化学方程式为。(2)、B中产生白色沉淀,该沉淀为;该反应属于(填基本反应类型)。
(1)、A中反应的化学方程式为。(2)、B中产生白色沉淀,该沉淀为;该反应属于(填基本反应类型)。七、科学探究题
-
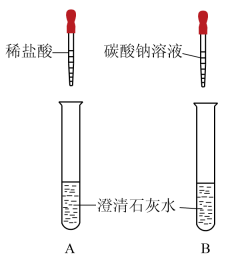
38. 碳酸钠和碳酸氢钠是生活中常见的盐,小组同学实验探究它们的化学性质。
【进行实验】
实验1:用如图装置(夹持仪器已略去)完成实验,记录如下:
序号
①
②
装置
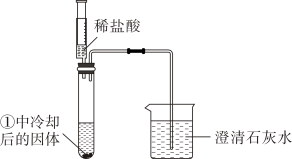
现象
试管内壁有水雾
注入稀盐酸后,有气泡产生,澄清石灰水变浑浊
实验2:用下图装置进行实验。该装置能实现将盐酸极其缓慢地加入到Na2CO3溶液、NaHCO3溶液中,并通过磁力搅拌,使溶液迅速扩散。Na2CO3溶液、NaHCO3溶液中预先滴加2滴酚酞溶液。
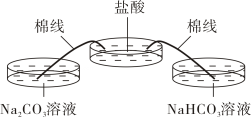
用延时摄影技术将1h的实验过程压缩到34s,使短时间内看到快速连续的变化,按时间顺序连续记录不同时间阶段的实验现象,结果如下:
Na2CO3溶液
NaHCO3溶液
起始
呈红色
呈浅粉色
阶段①
溶液颜色逐渐变浅,变为浅粉色,无气泡产生
溶液颜色逐渐变浅,直至褪色,逐渐产生气泡
阶段②
溶液颜色继续变浅,直至褪色,逐渐产生气泡
不断产生气泡
阶段③
不断产生气泡
没有新气泡产生
阶段④
没有新的气泡产生
——
(1)、【解释与结论】实验1中②的现象说明有CO2产生。CO2与石灰水反应的化学方程式为。
(2)、实验2中,由起始现象可知,Na2CO3溶液显性。(3)、实验2中,NaHCO3与稀盐酸反应的化学方程式为。(4)、对比实验2中的现象可知,阶段①中Na2CO3与稀盐酸反应的化学方程式为。(5)、【反思与评价】实验1能否得出NaHCO3加热后生成了Na2CO3。回答“能”或“不能”,并说明理由:。
(6)、通过本实验,你对Na2CO3与稀盐酸反应的新的认识是。八、计算题
-
39. 硼(B)是制造火箭耐热合金的材料。镁还原法生产硼的主要反应原理为:3Mg + B2O32B + 3MgO。若制得22 kg B,计算参加反应的B2O3的质量(写出计算过程及结果)。
-
-
-