北京市朝阳区2023年中考二模化学试题
试卷更新日期:2023-08-31 类型:中考模拟
一、单选题
-
1. 下列不属于化石燃料的是( )A、石油 B、煤 C、乙醇 D、天然气2. 化学元素与人体健康密切相关。为了防止骨质疏松应适当摄入的元素是( )A、钙 B、铁 C、锌 D、硒3. 下列物质的主要成分属于氧化物的是( )A、
 钻石(C)
B、
钻石(C)
B、 水晶(SiO2)
C、
水晶(SiO2)
C、 食盐(NaCl)
D、
食盐(NaCl)
D、 钟乳石(CaCO3)
4. “垃圾是放错位置的资源”,垃圾分类人人有责。矿泉水瓶、易拉罐属于( )A、
钟乳石(CaCO3)
4. “垃圾是放错位置的资源”,垃圾分类人人有责。矿泉水瓶、易拉罐属于( )A、 B、
B、 C、
C、 D、
D、 5. 蔬菜为人体提供的主要营养素是( )A、糖类 B、油脂 C、蛋白质 D、维生素6. 下列净水方法中,净化程度最高的是( )A、蒸馏 B、消毒 C、吸附 D、沉淀7. 切洋葱时可闻到刺激性气味,这说明( )A、分子在不停地运动 B、分子体积很小 C、分子间有间隔 D、分子质量很小8. 下列物质的用途不正确的是( )A、用CO2作气体肥料 B、用碳酸钙作补钙剂 C、用浓硫酸作食品干燥剂 D、用稀有气体作电光源9. 空气中各组分气体体积分数最大的是( )A、二氧化碳 B、稀有气体 C、氧气 D、氮气10. 下列氧气的性质中,属于化学性质的是( )A、无色无味 B、沸点低 C、能支持燃烧 D、不易溶于水11. 下列有关加热高锰酸钾制取氧气的实验操作正确的是( )A、组装仪器
5. 蔬菜为人体提供的主要营养素是( )A、糖类 B、油脂 C、蛋白质 D、维生素6. 下列净水方法中,净化程度最高的是( )A、蒸馏 B、消毒 C、吸附 D、沉淀7. 切洋葱时可闻到刺激性气味,这说明( )A、分子在不停地运动 B、分子体积很小 C、分子间有间隔 D、分子质量很小8. 下列物质的用途不正确的是( )A、用CO2作气体肥料 B、用碳酸钙作补钙剂 C、用浓硫酸作食品干燥剂 D、用稀有气体作电光源9. 空气中各组分气体体积分数最大的是( )A、二氧化碳 B、稀有气体 C、氧气 D、氮气10. 下列氧气的性质中,属于化学性质的是( )A、无色无味 B、沸点低 C、能支持燃烧 D、不易溶于水11. 下列有关加热高锰酸钾制取氧气的实验操作正确的是( )A、组装仪器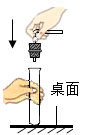 B、检查气密性
B、检查气密性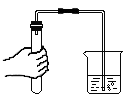 C、加热固体
C、加热固体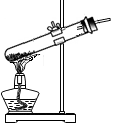 D、氧气验满
D、氧气验满 12. 地壳中含量最高的元素是( )A、氧 B、硅 C、铝 D、铁13. 下列符号中,表示2个氯原子的是( )
12. 地壳中含量最高的元素是( )A、氧 B、硅 C、铝 D、铁13. 下列符号中,表示2个氯原子的是( )
A、Cl2 B、2Cl2 C、2Cl D、2Cl-14. 氢元素与氧元素的本质区别是( )A、质子数不同 B、中子数不同 C、核外电子数不同 D、最外层电子数不同15. 下列标签中化学式与名称不符的是( )A、 B、
B、 C、
C、 D、
D、 16. 我国科学家成功研制用于外太空核反应堆的高强韧钼合金。钼元素在元素周期表中的信息如图所示。下列有关钼元素的说法不正确的是( )
16. 我国科学家成功研制用于外太空核反应堆的高强韧钼合金。钼元素在元素周期表中的信息如图所示。下列有关钼元素的说法不正确的是( ) A、属于金属元素 B、原子序数为42 C、相对原子质量为95.96g D、原子中核外电子数为4217. 我国科学家以二氧化碳为原料人工合成葡萄糖(C6H12O6)。下列有关葡萄糖的说法正确的是( )A、由24个原子构成 B、碳元素的质量分数最大 C、由三种元素组成 D、碳、氢元素质量比为1:218. 从海水中提取镁的反应之一:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,该反应属于( )A、化合反应 B、复分解反应 C、置换反应 D、分解反应19. 电解水实验如图。下列说法不正确的是( )
A、属于金属元素 B、原子序数为42 C、相对原子质量为95.96g D、原子中核外电子数为4217. 我国科学家以二氧化碳为原料人工合成葡萄糖(C6H12O6)。下列有关葡萄糖的说法正确的是( )A、由24个原子构成 B、碳元素的质量分数最大 C、由三种元素组成 D、碳、氢元素质量比为1:218. 从海水中提取镁的反应之一:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,该反应属于( )A、化合反应 B、复分解反应 C、置换反应 D、分解反应19. 电解水实验如图。下列说法不正确的是( ) A、试管1中得到H2 B、水由H2、O2组成 C、产生H2和O2的体积比为2:1 D、实验说明水分子是可分的20. 下列各组气体中,不能用燃着的木条区分的是()A、氧气和空气 B、二氧化碳和氮气 C、氢气和空气 D、一氧化碳和二氧化碳21. 下列物质中,不需密封保存的是()A、浓硫酸 B、氢氧化钠 C、大理石 D、浓盐酸22. 用如图装置可验证空气中O2的含量。下列说法不正确的是( )
A、试管1中得到H2 B、水由H2、O2组成 C、产生H2和O2的体积比为2:1 D、实验说明水分子是可分的20. 下列各组气体中,不能用燃着的木条区分的是()A、氧气和空气 B、二氧化碳和氮气 C、氢气和空气 D、一氧化碳和二氧化碳21. 下列物质中,不需密封保存的是()A、浓硫酸 B、氢氧化钠 C、大理石 D、浓盐酸22. 用如图装置可验证空气中O2的含量。下列说法不正确的是( ) A、实验前需检查装置气密性 B、红磷燃烧产生大量白烟 C、红磷熄灭后应立即打开止水夹 D、集气瓶中水面最终上升至2处23. 下列关于“粗盐中难溶性杂质的去除”实验的叙述不正确的是( )A、该实验利用了NaCl溶于水的性质 B、溶解时,用玻璃棒搅拌的目的是加速溶解 C、过滤时,使用的玻璃仪器有烧杯、漏斗、玻璃棒 D、蒸发时,必须蒸干蒸发皿中的水分才能停止加热24. 如图是硼酸的溶解度曲线,下列说法正确的是( )
A、实验前需检查装置气密性 B、红磷燃烧产生大量白烟 C、红磷熄灭后应立即打开止水夹 D、集气瓶中水面最终上升至2处23. 下列关于“粗盐中难溶性杂质的去除”实验的叙述不正确的是( )A、该实验利用了NaCl溶于水的性质 B、溶解时,用玻璃棒搅拌的目的是加速溶解 C、过滤时,使用的玻璃仪器有烧杯、漏斗、玻璃棒 D、蒸发时,必须蒸干蒸发皿中的水分才能停止加热24. 如图是硼酸的溶解度曲线,下列说法正确的是( ) A、a点的硼酸溶液中溶质的质量分数为10% B、将a点的硼酸溶液升温至t2℃时,仍是饱和溶液 C、将b点的硼酸溶液降温至t1℃时,有晶体析出 D、t2℃时,向50g水中加入20g硼酸后充分搅拌,可得70g溶液25. 中国芯片蚀刻技术国际领先。NF3进行硅芯片蚀刻时反应的微观示意图如下:
A、a点的硼酸溶液中溶质的质量分数为10% B、将a点的硼酸溶液升温至t2℃时,仍是饱和溶液 C、将b点的硼酸溶液降温至t1℃时,有晶体析出 D、t2℃时,向50g水中加入20g硼酸后充分搅拌,可得70g溶液25. 中国芯片蚀刻技术国际领先。NF3进行硅芯片蚀刻时反应的微观示意图如下:
下列说法正确的是( )
A、从微观构成看:四种物质均由分子构成 B、从守恒关系看:反应前后原子的种类、数目不变 C、从价态变化看:反应前后各元素的化合价不变 D、从表示方法看:反应的化学方程式为NF3+SiSiF4+N2二、填空题
-
26. 厨房中蕴含着许多化学知识。(1)、小苏打常用于焙制糕点,其化学式为。(2)、天然气的主要成分为CH4 , CH4充分燃烧的化学方程式为。27. 通常,金属活动性越强,冶炼难度越大,人类使用该金属的时间越晚。(1)、下图为四种金属的最早冶炼历史年代。甲代表的金属是____。
 A、铁 B、铜 C、钠 D、锌(2)、将鱼用铝箔包好进行烤制,鱼很快被烤熟,在烤制过程中体现了铝箔具有良好的性;使用后的铝箔依然光亮如新,说明铝具有很好的抗腐蚀性,用化学方程式解释其原因。28. 洁厕灵(主要成分稀盐酸)和管道疏通剂(主要成分NaOH)是生活中常用的清洁剂。(1)、洁厕灵与铁锈接触时发生反应的化学方程式为。(2)、管道疏通剂使用时不能与皮肤接触的原因是。
A、铁 B、铜 C、钠 D、锌(2)、将鱼用铝箔包好进行烤制,鱼很快被烤熟,在烤制过程中体现了铝箔具有良好的性;使用后的铝箔依然光亮如新,说明铝具有很好的抗腐蚀性,用化学方程式解释其原因。28. 洁厕灵(主要成分稀盐酸)和管道疏通剂(主要成分NaOH)是生活中常用的清洁剂。(1)、洁厕灵与铁锈接触时发生反应的化学方程式为。(2)、管道疏通剂使用时不能与皮肤接触的原因是。三、科普阅读题
-
29. 阅读下面科普短文。
谈到二氧化硫,人们可能会想到它对人体健康和环境的危害。其实在食品行业,SO2是一种国内外允许使用的食品添加剂,通常以焦亚硫酸钠、亚硫酸钠等形式添加在食品中,起到护色、漂白、防腐和抗氧化的作用。
SO2常用于葡萄酒的生产加工。SO2作为保鲜剂,在低温环境下可有效减缓酿酒葡萄的腐烂。研究人员在4℃时,采用不同浓度的SO2对酿酒葡萄进行预处理,经过四周的储藏,测得酿酒葡萄的腐烂率如图所示。葡萄酒的生产过程包括葡萄除梗、榨汁和葡萄汁发酵等步骤。葡萄汁的发酵过程是在酵母的作用下将多糖转化为酒精(C2H5OH),此过程需添加SO2抑制杂菌的滋生。
为保证SO2安全使用,我国《食品添加剂使用标准(GB2760-2014)》明确了各种食品中SO2最大残留量:
食品
蜜饯
葡萄酒
食糖
水果干
巧克力
果蔬汁
最大残留量
0.35g/kg
0.25g/L
0.1g/kg
0.1g/kg
0.1g/kg
0.05g/kg
世界卫生组织也规定,每人每天摄入的SO2(比体重)应控制在0.7mg/kg以内,否则人体会产生中毒现象。

依据文章内容回答下列问题。
(1)、酒精属于(填“无机化合物”或“有机化合物”)。(2)、葡萄汁发酵过程中添加SO2的作用是。(3)、由图可知,酿酒葡萄在4℃时储存一周,腐烂率最高的是____。A、未添加SO2 B、低浓度SO2 C、高浓度SO2(4)、一个体重为60kg的成年人,每天SO2安全摄入量是mg以内。(5)、判断下列说法是否正确(填“对”或“错”)。①按照国家标准,巧克力中的SO2最大残留量为0.1g/kg。
②生产葡萄酒的步骤中,所涉及的变化均属于化学变化。
四、流程题
-
30. 某化工厂用石灰乳对工业烟气进行脱硫,同时生产石膏(CaSO4)的工艺流程如下:
 (1)、步骤①中常将NaOH溶液喷成雾状,其目的是。(2)、Na2SO3中S元素的化合价为。(3)、步骤③中发生化合反应的化学方程式为。31. 高炉炼铁的工艺流程如下:
(1)、步骤①中常将NaOH溶液喷成雾状,其目的是。(2)、Na2SO3中S元素的化合价为。(3)、步骤③中发生化合反应的化学方程式为。31. 高炉炼铁的工艺流程如下: (1)、赤铁矿属于(填“纯净物”或“混合物”)。(2)、催化反应室中发生的反应之一是:CH4+X2CO+2H2 , 则X的化学式为。(3)、还原反应室中共发生两个化学反应,化学方程式分别为Fe2O3+3H22Fe+3H2O和。
(1)、赤铁矿属于(填“纯净物”或“混合物”)。(2)、催化反应室中发生的反应之一是:CH4+X2CO+2H2 , 则X的化学式为。(3)、还原反应室中共发生两个化学反应,化学方程式分别为Fe2O3+3H22Fe+3H2O和。五、实验题
-
32. 用下图装置进行实验。
 (1)、实验1,反应的化学方程式为。(2)、实验2,观察到蜡烛由下到上依次熄灭,由此得出CO2的性质是。(3)、实验3,证明二氧化碳能与水反应,需在B处放置。33. 用下图实验研究金属的性质。
(1)、实验1,反应的化学方程式为。(2)、实验2,观察到蜡烛由下到上依次熄灭,由此得出CO2的性质是。(3)、实验3,证明二氧化碳能与水反应,需在B处放置。33. 用下图实验研究金属的性质。 (1)、实验1,铁丝燃烧生成的黑色固体是;集气瓶中水的作用是。(2)、实验2,能证明铁生锈与水有关的现象是。(3)、实验3,先向甲中加入过量 , 充分反应后打开K,使甲中溶液全部进入乙中,铜片表面没有变化,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu。34. 取一定量碳酸钠溶液于三支试管中,进行如图所示实验。
(1)、实验1,铁丝燃烧生成的黑色固体是;集气瓶中水的作用是。(2)、实验2,能证明铁生锈与水有关的现象是。(3)、实验3,先向甲中加入过量 , 充分反应后打开K,使甲中溶液全部进入乙中,铜片表面没有变化,由此可证明铁、铜的金属活动性顺序以及与氢的位置关系为Fe>H>Cu。34. 取一定量碳酸钠溶液于三支试管中,进行如图所示实验。 (1)、①实验的目的是。(2)、②中发生反应的化学方程式为。(3)、③中观察到的现象是 , 向所得溶液中滴入2滴紫色石蕊溶液,观察到溶液变为红色,则溶液中含有的溶质是。35. 根据下图所示实验回答问题。
(1)、①实验的目的是。(2)、②中发生反应的化学方程式为。(3)、③中观察到的现象是 , 向所得溶液中滴入2滴紫色石蕊溶液,观察到溶液变为红色,则溶液中含有的溶质是。35. 根据下图所示实验回答问题。已知:白磷、红磷的着火点分别为40℃、240℃。
 (1)、实验1,影响物质溶解性的因素是。(2)、实验2,观察到①中白磷燃烧,②中红磷不燃烧,可得出可燃物燃烧的条件之一是。若验证可燃物燃烧的另一个条件,应将②中的药品替换为。
(1)、实验1,影响物质溶解性的因素是。(2)、实验2,观察到①中白磷燃烧,②中红磷不燃烧,可得出可燃物燃烧的条件之一是。若验证可燃物燃烧的另一个条件,应将②中的药品替换为。六、填空题
-
36. 用下图实验证明无明显现象反应的发生。
 (1)、实验1,能证明NaOH与CO2发生反应的现象是 , NaOH与CO2反应的化学方程式为。(2)、实验2,观察到溶液由红色变为无色,从物质性质的角度解释产生上述现象的原因。
(1)、实验1,能证明NaOH与CO2发生反应的现象是 , NaOH与CO2反应的化学方程式为。(2)、实验2,观察到溶液由红色变为无色,从物质性质的角度解释产生上述现象的原因。七、科普阅读题
-
37. 茶作为中国的传统饮品,历史悠久。泡茶过程如下图所示,某兴趣小组对泡茶效果的影响因素进行探究。

【查阅资料】
①茶多酚是一种白色粉末,略有吸水性,易溶于温水、乙醇等,在碱性环境中不稳定。
②茶汤的滋味取决于茶多酚与氨基酸的协调程度(即酚氨比),酚氨比越小,滋味越好。
【进行实验】
实验1:称取3.0g龙井茶放入瓷质盖碗中,用150mL100℃不同种类的水冲泡,5min后测定茶汤中酚氨比,实验数据如下:
水的种类
桶装纯净水
天然饮用水
自来水
井水
水的pH
7.6
7.05
7.7
7.02
硬度(煮沸)
0
3.08
3.44
6.43
酚氨比
6.28
6.82
6.13
6.32
实验2:用龙井茶与桶装纯净水配制茶水比为1:100的茶汤,测定不同水温及浸泡时间下的茶多酚溶解率,数据如下图所示。
 (1)、【解释与结论】
(1)、【解释与结论】茶树适宜生长在pH为4.5~6.5的土壤中,该土壤呈(填“酸性”或“碱性”)。
(2)、茶多酚的物理性质有(写一条即可)。(3)、实验1,泡出滋味最好的茶汤,对应水的pH和硬度的数据是:。(4)、根据实验2的数据分析,“洗茶”应采用低温水(50℃左右)短时间快速冲洗的方法,目的是。(5)、实验2,得出的结论是:在图示的实验研究范围内,茶水比为1:100的条件下,。(6)、继续实验,比较用瓷质盖碗和玻璃杯泡茶时所得茶汤的滋味,其实验操作是: , 5min后测定茶汤中的酚氨比。八、计算题
-
38. 氧烛是一种供氧发生器,通过催化分解氯酸钠来产生氧气。主要反应原理是:2NaClO32NaCl+3O2↑。计算106.5g氯酸钠分解生成氧气的质量。
-
-
-