2024年高考化学一轮复习:专题16实验设计与评价
试卷更新日期:2023-08-31 类型:一轮复习
一、选择题
-
1. 根据实验操作和和现象得出的结论正确的是( )
选项
实验操作和和现象
结论
A
取足量和浓盐酸反应后的溶液于试管中,依次加入稀硝酸、溶液,产生大量白色沉淀
则说明盐酸有剩余
B
某溶液中滴加过量的氨水产生白色沉淀
则说明溶液中含
C
向某溶液中加入少量溶液,并将湿润的红色石蕊试纸放在试管口,试纸未变色
则说明溶液中不含
D
将两支盛有等体积、等浓度的溶液的试管分别置于冷水、热水中,同时加入等体积、等浓度的稀硫酸。置于热水中的试管比冷水中的试管先出现沉淀
则说明其他条件相同时,升高温度能加快反应速率
A、A B、B C、C D、D2. 下列实验探究方案能达到探究目的的是( )选项
探究方案
探究目的
A
向试管中滴入几滴1-溴丁烷,再加入溶液,振荡后加热,反应一段时间后停止加热,静置。取数滴水层溶液于试管中,加入几滴溶液,观察现象
检验1-溴丁烷中的溴元素
B
与浓硫酸加热至170℃,产生的气体用NaOH溶液充分洗气后,通入溴水,溴水褪色
乙醇发生了消去反应
C
取2%硫酸铜溶液2mL再加入2%NaOH溶液1mL,再加入少量乙醛加热至沸腾,产生砖红色沉淀
醛基能被新制的氧化
D
向苯和少量苯酚的混合溶液中加入足量的浓溴水,充分反应后,过滤
除去苯中少量的苯酚杂质
A、A B、B C、C D、D3. 根据下列实验及现象所得结论正确的是( )选项
实验及现象
结论
A
将2-溴丙烷与NaOH的乙醇溶液共热,产生的气体通入酸性高锰酸钾溶液,溶液褪色
2-溴丙烷发生了消去反应
B
向电石中逐滴加入饱和食盐水,将产生的气体通入溴水中,溴水褪色
乙炔与Br2发生了加成反应
C
将铜丝烧至表面变黑,伸入盛有某有机物的试管中,铜丝恢复亮红色
该有机物中一定含有醇羟基
D
将石蜡油加强热,产生的气体通入Br2的四氯化碳溶液,溶液褪色
产生的气体中含有不饱和烃
A、A B、B C、C D、D4. 下列有关SO2的实验原理或方案能达到目的的是( )A、 制SO2
B、
制SO2
B、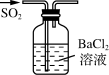 制BaSO3沉淀
C、
制BaSO3沉淀
C、 验证SO2的还原性
D、
验证SO2的还原性
D、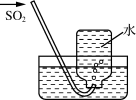 收集SO2
5. 根据下列实验操作和现象所得结论正确的是( )
收集SO2
5. 根据下列实验操作和现象所得结论正确的是( )选项
实验操作和实验现象
结论
A
在一块除去铁锈的铁片上滴1滴含有酚酞的食盐水静置2~3min,溶液边缘出现红色
铁片上发生了吸氧腐蚀
B
将足量H2O2溶液滴入少量的酸性高锰酸钾溶液溶液紫色褪去
H2O2具有漂白性
C
向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口,试纸颜色无明显变化
原溶液中无
D
向Na2CO3、Na2S的混合溶液中滴入少量AgNO3溶液,有黑色沉淀生成
Ksp(Ag2S)<Ksp(Ag2CO3)
A、A B、B C、C D、D6. 实验室可用如图所示的装置制备SO2并探究其性质。下列说法错误的是( ) A、A装置中的药品可替换成铜片和浓硫酸 B、B装置可作储气瓶和安全瓶 C、C装置中溶液变浑浊,说明SO2具有氧化性 D、E中可选用NaOH溶液除去尾气7. 下列实验操作、现象及结论均正确的是( )
A、A装置中的药品可替换成铜片和浓硫酸 B、B装置可作储气瓶和安全瓶 C、C装置中溶液变浑浊,说明SO2具有氧化性 D、E中可选用NaOH溶液除去尾气7. 下列实验操作、现象及结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向淀粉KI溶液中滴入适量稀硫酸
溶液变蓝
稀硫酸将I-氧化为I2
B
向AgCl悬浊液中滴入适量氨水
悬浊液变澄清
AgCl(s)Ag+(aq)+Cl-(aq)平衡正向移动
C
加热NH4Cl固体
产生刺激性气味的气体
加热NH4Cl可制备NH3
D
向酸性KMnO4溶液中滴入H2C2O4溶液
酸性KMnO4溶液褪色
H2C2O4具有漂白性
A、A B、B C、C D、D8. 室温下,根据下列实验操作和现象所得到的结论不正确的是( )选项
实验操作和现象
实验结论
A
卤代烃Y与NaOH水溶液共热后,再滴入溶液,产生黑色沉淀
说明卤代烃未水解
B
取溶液于试管中,加入溶液,充分反应后滴入几滴KSCN溶液,溶液变成红色
则KI与溶液的反应有一定限度
C
向溶有的溶液中通入气体X,出现白色沉淀
X可能是
D
测得溶液pH约为9,溶液pH约为8
结合的能力比强
A、A B、B C、C D、D二、多选题
-
9. 碲被誉为“现代工业的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某科研小组从粗铜精炼的阳极泥(主要含有)中提取粗碲设计工艺流程如图所示。下列有关说法正确的是( )

已知:①“焙烧”后,碲主要以形式存在;“氧化”过程,Te被氧化为+6价
②微溶于水,易溶于强酸和强碱,与强碱生成
A、“焙烧”用到的主要硅酸盐产品仪器:蒸发皿、酒精灯、玻璃棒 B、“还原”时氧化剂与还原剂的物质的量之比为1∶3 C、为加快“氧化”速率,温度越高越好 D、是两性氧化物,碱浸时反应的离子方程式为10. 一种制备的工艺路线如图所示,反应Ⅱ所得溶液在3~4之间,反应Ⅲ需及时补加以保持反应在条件下进行。常温下,的电离平衡常数。下列说法正确的是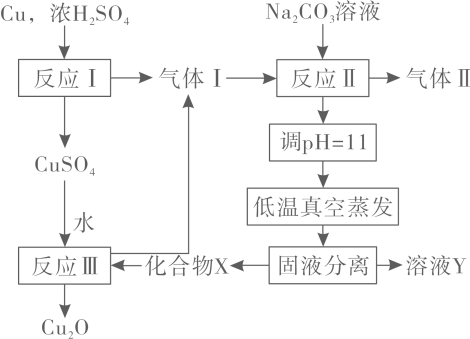 A、反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 B、低温真空蒸发主要目的是防止被氧化 C、溶液Y可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ D、若产量不变,参与反应Ⅲ的与物质的量之比增大时,需补加的量减少11. 下列根据实验操作和现象所得出的结论正确的是( )
A、反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 B、低温真空蒸发主要目的是防止被氧化 C、溶液Y可循环用于反应Ⅱ所在操作单元吸收气体Ⅰ D、若产量不变,参与反应Ⅲ的与物质的量之比增大时,需补加的量减少11. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作
实验现象
结论
A
将NaOH溶液逐滴滴加到溶液中至过量
先产生白色胶状沉淀,后沉淀溶解
是两性氢氧化物
B
测定等浓度的和的溶液的pH
前者pH比后者大
非金属性:S>C
C
向2.0mL浓度均为的KCl、KI混合溶液中滴加1~2滴溶液,振荡
沉淀呈黄色
D
分别向两支盛有醋酸和饱和硼酸溶液的试管中滴加等浓度溶液
前者产生无色气泡,后者无明显现象
酸性:醋酸>碳酸>硼酸
A、A B、B C、C D、D三、非选择题
-
12. 为对比和的性质,某同学进行如下实验,补全下表。
实验装置及操作



实验现象
盛有 (填化学式)试管中温度计示数升高
盛有的试管中固体完全溶解;盛有的试管中固体有剩余
实验结论或解释
相同温度下,溶解度:(填“>”、“<”或“=”)
很稳定,受热不易分解;不稳定,受热容易分解
13.(1)、中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。(2)、量取反应物时,取50mL 0.50mol•L﹣1的盐酸,还需加入的试剂是 (填序号)。A、50mL 0.50mol•L﹣1 NaOH溶液 B、50mL 0.55mol•L﹣1 NaOH溶液 C、1.0g NaOH固体(3)、由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。反应物
起始温度t1/℃
终了温度t2/℃
中和热/kJ•mol﹣1
A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL
13.0
△H1
B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL
13.0
△H2
①甲在实验之前预计△H1=△H2 . 他的根据是;乙在实验之前预计△H1≠△H2 , 他的根据是。
②实验测得的温度是:A的起始温度为13.0℃、终了温度为19.8℃;B的起始温度为13.0℃、终了温度为19.3℃.设充分反应后溶液的比热容c=4.184J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=;△H2=。(已知溶液密度均为1g/cm3)
14. 由于氯气会与自来水中的有机物发生反应,生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取 NaClO2。 (1)、图中装置有一明显错误,请指出并纠正:。(2)、打开B的活塞,A中有ClO2生成,写出其反应的离子方程式:。(3)、D中吸收ClO2后生成NaClO2和 NaHCO3 , 写出D中所发生反应的离子方程式:。(4)、E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:。(5)、另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3。则每生成0.5 mol ClO2 , 转移mol e-。15. 以镁铝复合氧化物()为载体的负载型镍铜双金属催化剂(Ni-Cu/)是一种新型的高效加氢或脱氢催化剂,其制备流程如下:
(1)、图中装置有一明显错误,请指出并纠正:。(2)、打开B的活塞,A中有ClO2生成,写出其反应的离子方程式:。(3)、D中吸收ClO2后生成NaClO2和 NaHCO3 , 写出D中所发生反应的离子方程式:。(4)、E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:。(5)、另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3。则每生成0.5 mol ClO2 , 转移mol e-。15. 以镁铝复合氧化物()为载体的负载型镍铜双金属催化剂(Ni-Cu/)是一种新型的高效加氢或脱氢催化剂,其制备流程如下: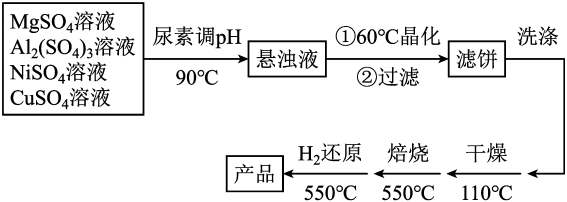
已知:常温下, , 。回答下列问题:
(1)、在元素周期表中,Ni在(填“s”“p”“d”“f”或“ds”)区,基态铜原子的价电子排布式为。(2)、在加热条件下,尿素在水中发生水解反应,放出和(填化学式)两种气体。(3)、“晶化”过程中,需保持恒温60℃,可采用的加热方式为。(4)、常温下,若“悬浊液”中 , 则溶液的。(5)、在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理(用离子方程式表示)。16. 某课题组对含钴高炉渣(主要成分有Co2O3、Al2O3、Fe3O4、SiO2、CaO、Fe2O3)资源化综合处理的流程如图:
回答下列问题:
(1)、“研磨”的目的为;物质A是(填化学式)。(2)、Co2O3参与“酸浸”的化学方程式为 , “酸浸”过程实际消耗双氧水的量大于理论值,可能的原因是(写出一条即可)。滤渣I的主要成分是(填化学式)。(3)、“中和沉淀”中,Fe3+生成高效净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]存在于滤渣II中。该过程的离子方程式为。在实验室中,向Fe(OH)3固体中加入等体积的0.75mol·L-1H2SO4溶液和 mol·L-1Na2SO4溶液,使其恰好完全反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到黄钠铁矾。(4)、滤液③中的铝元素恰好完全转化为沉淀的pH为。{通常认为溶液中离子浓度小于10-5mol·L-1为沉淀完全;[Al(OH)4]-+H+Al(OH)3+H2O,K=1013.38;Ksp[Al(OH)3]=10-33}(5)、CoC2O4经充分焙烧质量减少2t,则获得Co3O4的质量为t。17. 纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。(1)、工业上“侯氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
请回答下列问题:
①操作A 的方法是 , 得到的NaHCO3晶体中可能含有少量NaCl、NH4Cl等杂质,检验该晶体中是否含有氯离子杂质的操作方法是。
②该工艺流程中可回收再利用的物质是。
(2)、若称取10.5 g纯净的NaHCO3固体,加热一段时间后,剩余固体的质量为8.02 g。如果把剩余的固体全部加入到100 mL 2 mol·L-1的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度(设溶液的体积变化及盐酸的挥发忽略不计)(写出计算过程)。18. 某研究小组探究金属Na与反应。 (1)、用如图所示装置及药品制取打开弹簧夹制取。为了得到干燥纯净的 , 产生的气流应依次通过盛有、的洗气瓶。收集满后关闭弹簧夹,可观察到的现象是。(2)、将一小块Na在燃烧匙中点燃,迅速伸入充满的集气瓶中。发现Na继续燃烧产生大量白烟,集气瓶底部有黑色固体产生瓶壁上有白色物质。取该白色物质溶于水滴加澄清石灰水,出现浑浊。据此写出Na与反应的化学方程式 , 该反应体现了钠的性。(3)、用如图所示装置进一步检验黑色固体与浓硫酸反应的产物装置②中无水硫酸铜的作用是 , 装置⑤中品红溶液的作用是。
(1)、用如图所示装置及药品制取打开弹簧夹制取。为了得到干燥纯净的 , 产生的气流应依次通过盛有、的洗气瓶。收集满后关闭弹簧夹,可观察到的现象是。(2)、将一小块Na在燃烧匙中点燃,迅速伸入充满的集气瓶中。发现Na继续燃烧产生大量白烟,集气瓶底部有黑色固体产生瓶壁上有白色物质。取该白色物质溶于水滴加澄清石灰水,出现浑浊。据此写出Na与反应的化学方程式 , 该反应体现了钠的性。(3)、用如图所示装置进一步检验黑色固体与浓硫酸反应的产物装置②中无水硫酸铜的作用是 , 装置⑤中品红溶液的作用是。 19. 溶液与KI溶液混合时,按照复分解反应原理分析,可得到AgI黄色沉淀。查阅资料可知:①溶液呈酸性;②具有较强的氧化性;③单质碘遇淀粉溶液会变蓝。根据所得信息,甲学生对溶液与KI溶液混合时发生的反应做出了如下猜测:
19. 溶液与KI溶液混合时,按照复分解反应原理分析,可得到AgI黄色沉淀。查阅资料可知:①溶液呈酸性;②具有较强的氧化性;③单质碘遇淀粉溶液会变蓝。根据所得信息,甲学生对溶液与KI溶液混合时发生的反应做出了如下猜测:猜测1:发生复分解反应。
猜测2:与发生氧化还原反应。
(1)、①如果猜测2成立,则发生反应的化学方程式为;为了验证该猜测,甲同学往反应后的溶液中加入淀粉,观察到溶液变蓝,证明猜测2成立。②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是溶液中的在酸性条件下具有较强的氧化性,也可能氧化 , 反应的离子方程式为;该反应中的氧化剂和还原剂的物质的量之比为。
(2)、乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量),一段时间后,电流计指针发生偏转,溶液无气泡产生,石墨2表面有银白色金属析出。
①该装置的负极为石墨(填“1”或“2”)。
②若石墨2增重5.4g(不考虑其他反应),则电路中转移电子数为。
③根据实验现象,证明猜测2成立。若将盐桥中的溶液换成溶液,一段时间后,电流计指针不发生偏转,可能原因是。
(3)、原电池在生产生活和学习中有着广泛的应用,下列关于原电池的说法正确的是____(填标号)。A、原电池是化学能转化为电能的装置 B、原电池内发生的反应为氧化还原反应 C、所有的化学反应均可设计成原电池 D、电子从负极流出,经电解质溶液流入正极20. 为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置: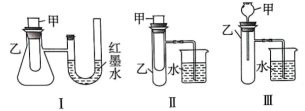 (1)、上述 3 个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是;(2)、某同学选用装置I 进行实验(实验前U 型管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 型管中可观察到的现象是 , 说明该反应属于(选填“吸热” 或“放热”)反应。(3)、为探究固体M 溶于水的热效应,选择装置 II 进行实验(反应在甲中进行)。
(1)、上述 3 个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是;(2)、某同学选用装置I 进行实验(实验前U 型管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U 型管中可观察到的现象是 , 说明该反应属于(选填“吸热” 或“放热”)反应。(3)、为探究固体M 溶于水的热效应,选择装置 II 进行实验(反应在甲中进行)。①若 M 为Na,则实验过程中烧杯中可观察到的现象是
②若观察到烧杯里产生气泡,则说明 M 溶于水(选填“一定是放热反应”、“一定是吸热反应” 或“可能是放热反应”),理由是。
③若观察到烧杯里玻璃管内形成一段水柱,则 M 溶于水是(选填“放热”或“吸热”)过程。
(4)、C(石墨)与适量 H2O(g)反应生成标准状况下 CO 和H2 各 2.24L 时,吸收 3.13kJ 热量,该反应的热化学方程式为。21. 如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中,请回答:
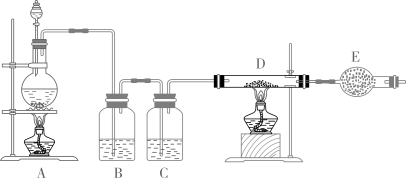 (1)、仪器E的名称是。(2)、装置B中盛放的试剂是:装置C的作用是 .(3)、装置A中浓盐酸与二氧化锰反应的离子方程式是 .(4)、用简单实验验证D中的单质铜是否完全反应 .22. 不同浓度的硫酸与锌反应时,硫酸可以被还原为 , 也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。
(1)、仪器E的名称是。(2)、装置B中盛放的试剂是:装置C的作用是 .(3)、装置A中浓盐酸与二氧化锰反应的离子方程式是 .(4)、用简单实验验证D中的单质铜是否完全反应 .22. 不同浓度的硫酸与锌反应时,硫酸可以被还原为 , 也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。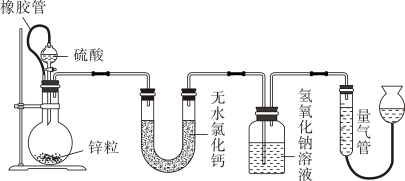
请回答:
(1)、橡胶管的作用是什么?。(2)、按图组装完装置后,在加药品前欲检查装置的气密性,应如何操作?。(3)、写出圆底烧瓶中可能发生的化学反应方程式。(4)、若烧瓶中投入ag锌且完全反应,氢氧化钠溶液洗气瓶增重bg,量气管中收集到VmL气体(标准状况),请用一个代数式表示出a,b,V之间的关系。(5)、反应结束后,为了准确测量气体体积,读数时视线应与液面最低处相平外,若量气管右侧液面高于左侧液面,则的数值(填“偏大”、“偏小”或“无影响”)。23. 为探究X(仅含有两种短周期元素)的组成和性质,设计并完成如下实验。已知A为气体单质,液体B能使硫酸铜粉末变为蓝色。请回答: (1)、写出液体B的电子式;(2)、X的化学式是;(3)、写出金属C与 , 反应的化学方程式;(4)、写出E转化为F的离子方程式。24. 无机盐X由五种元素组成,某学习小组按如下流程进行实验:
(1)、写出液体B的电子式;(2)、X的化学式是;(3)、写出金属C与 , 反应的化学方程式;(4)、写出E转化为F的离子方程式。24. 无机盐X由五种元素组成,某学习小组按如下流程进行实验: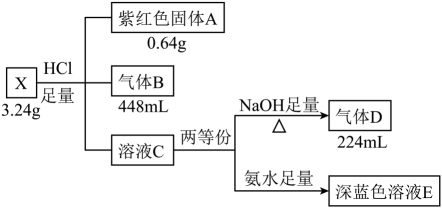
已知:上述气体体积均在标准状况下测得。气体B为纯净物,有刺激性气味,标准状况下密度为2.86 g/L。请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出C→D转化过程的离子方程式。(3)、深蓝色溶液E与气体B反应可生成X沉淀,写出该反应的离子方程式。(4)、若盐X与足量盐酸的反应改在密闭容器中进行,得到固体A、气体B和溶液M(M中不合固体A的组成元素)。设计实验检验溶液M中的。25. 某易溶于水的无色晶体X由四种短周期元素组成,阴、阳离子数之比为1∶2.在一定条件可发生如下转化(所加试剂均足量)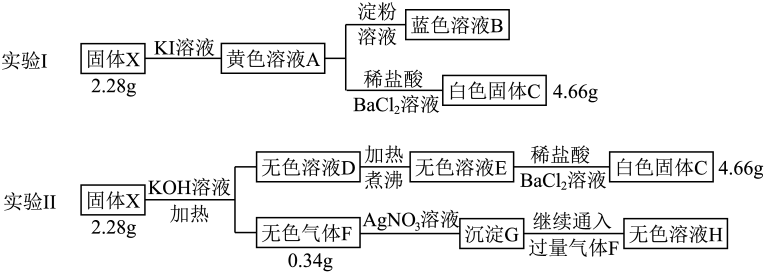 (1)、组成X的四种元素为;X的化学式为。(2)、无色溶液H中所含的阳离子为(用化学式表示)。(3)、写出由固体X到黄色溶液A的化学方程式。(4)、固体X可与溶液反应得到紫色溶液,写出反应的离子方程式。(5)、请设计实验,检验黄色溶液A中的阳离子(除外)。
(1)、组成X的四种元素为;X的化学式为。(2)、无色溶液H中所含的阳离子为(用化学式表示)。(3)、写出由固体X到黄色溶液A的化学方程式。(4)、固体X可与溶液反应得到紫色溶液,写出反应的离子方程式。(5)、请设计实验,检验黄色溶液A中的阳离子(除外)。