2024年高考化学一轮复习:专题12电化学
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 下列说法不正确的是( )A、电解精炼铜时溶液中的铜离子浓度会减少 B、电镀时,应把镀件置于电解池的阴极 C、为防止水闸铁门被腐蚀,可让其与直流电源的负极相连 D、电化学防护中牺牲阳极的阴极保护法是利用了电解池原理2. 锂—铜空气燃料电池容量高、成本低。该电池通过一种复杂的铜腐蚀“现象”产生电能,放电时发生反应:2Li+Cu2O+H2O=2Cu+2Li++2OH- , 下列说法正确的是( )
 A、放电时,电子透过固体电解质向Cu极移动 B、通空气时,铜被腐蚀,表面产生Cu2O C、放电时,正极的电极反应式为O2+2H2O+4e-=4OH- D、将锂电极区有机电解质换成水溶液,可提高电池的工作效率3. 下列过程不涉及氧化还原反应的是( )A、金属的冶炼 B、湿润的红色布条遇到氯气褪色 C、明矾净水 D、刻蚀印刷电路板4. 用如图所示装置电解一段时间后,下列叙述错误的是( )
A、放电时,电子透过固体电解质向Cu极移动 B、通空气时,铜被腐蚀,表面产生Cu2O C、放电时,正极的电极反应式为O2+2H2O+4e-=4OH- D、将锂电极区有机电解质换成水溶液,可提高电池的工作效率3. 下列过程不涉及氧化还原反应的是( )A、金属的冶炼 B、湿润的红色布条遇到氯气褪色 C、明矾净水 D、刻蚀印刷电路板4. 用如图所示装置电解一段时间后,下列叙述错误的是( ) A、电极Ⅰ、电极Ⅱ均为Fe,A为NaCl溶液,两电极间可能会出现白色沉淀 B、电极Ⅰ、电极Ⅱ均为石墨,A为溶液,电极Ⅱ附近溶液变成黄绿色 C、该装置用于保护某钢铁制品时,钢铁制品应与电极Ⅰ连接,该方法叫做外加电流法 D、该装置用于电解精炼铜时,电极Ⅰ增加的质量和电极Ⅱ减轻的质量刚好相等5. 劳动开创未来。下列劳动项目与所述的化学知识有关联的是
A、电极Ⅰ、电极Ⅱ均为Fe,A为NaCl溶液,两电极间可能会出现白色沉淀 B、电极Ⅰ、电极Ⅱ均为石墨,A为溶液,电极Ⅱ附近溶液变成黄绿色 C、该装置用于保护某钢铁制品时,钢铁制品应与电极Ⅰ连接,该方法叫做外加电流法 D、该装置用于电解精炼铜时,电极Ⅰ增加的质量和电极Ⅱ减轻的质量刚好相等5. 劳动开创未来。下列劳动项目与所述的化学知识有关联的是选项
劳动项目
化学知识
A
工厂用铁罐车运输浓硫酸
浓硫酸很难电离出H+ , 与铁不反应
B
将铁闸门与直流电源的负极相连
利用牺牲阳极法保护铁闸门不被腐蚀
C
陶瓷表面上釉
隔绝空气,防止陶瓷被氧化
D
消防演练用泡沫灭火器灭火
Al3+与发生了双水解反应
A、A B、B C、C D、D6. 用如图示的方法可以保护钢质闸门。下列说法正确的是 A、当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 B、当a、b间用导线连接时,X可以是锌棒,电子经导线流入X C、当a、b与外接电源相连时,a应连接电源的正极 D、当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑7. 生活中的一些现象常常涉及化学知识。下列分析中错误的是A、咀嚼米饭时,越嚼越甜,因为淀粉水解生成了麦芽糖 B、向食盐浓溶液中加入鸡蛋清溶液,有白色沉淀析出,因为食盐能使蛋白质变性 C、铁锅用水清洗后,出现铁锈,因为潮湿环境中铁锅会发生电化学腐蚀 D、打开汽水瓶盖,有大量气泡冒出,因为减小压强后二氧化碳的溶解度减小
A、当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 B、当a、b间用导线连接时,X可以是锌棒,电子经导线流入X C、当a、b与外接电源相连时,a应连接电源的正极 D、当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑7. 生活中的一些现象常常涉及化学知识。下列分析中错误的是A、咀嚼米饭时,越嚼越甜,因为淀粉水解生成了麦芽糖 B、向食盐浓溶液中加入鸡蛋清溶液,有白色沉淀析出,因为食盐能使蛋白质变性 C、铁锅用水清洗后,出现铁锈,因为潮湿环境中铁锅会发生电化学腐蚀 D、打开汽水瓶盖,有大量气泡冒出,因为减小压强后二氧化碳的溶解度减小二、多选题
-
8. 如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
 A、A是Cu,B是Zn,C为硫酸铜 B、A是Cu,B是Zn,C为稀硫酸 C、A是Fe,B是Ag,C为稀AgNO3溶液 D、A是Ag,B是Fe,C为稀AgNO3溶液9. 下列实验装置符合实验目的的是( )A、
A、A是Cu,B是Zn,C为硫酸铜 B、A是Cu,B是Zn,C为稀硫酸 C、A是Fe,B是Ag,C为稀AgNO3溶液 D、A是Ag,B是Fe,C为稀AgNO3溶液9. 下列实验装置符合实验目的的是( )A、 测定中和反应的反应热
B、
测定中和反应的反应热
B、 铜的电解精炼
C、
铜的电解精炼
C、 验证电解饱和NaCl溶液(含酚酞)的产物
D、
验证电解饱和NaCl溶液(含酚酞)的产物
D、 在铁制品上镀铜
10. 在缺乏氧气的深层潮湿土壤中存在的硫酸盐还原菌,会附着在钢管表面促进钢铁的腐蚀,这个过程被称为厌氧腐蚀,其反应原理如图所示,下列说法正确的是( )
在铁制品上镀铜
10. 在缺乏氧气的深层潮湿土壤中存在的硫酸盐还原菌,会附着在钢管表面促进钢铁的腐蚀,这个过程被称为厌氧腐蚀,其反应原理如图所示,下列说法正确的是( )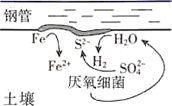 A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀11. 下列说法正确的是( )A、常温下2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O可自发进行,则该反应的ΔH﹤0 B、用牺牲阳极的阴极保护法来保护钢闸门时,可用锌板作为牺牲阳极 C、常温下,向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中 ·c(OH-)值不变 D、Na2O2与足量的水反应生成2.24LO2 , 转移的电子数目为0.2×6.02×1023
A、厌氧腐蚀属于电化学腐蚀 B、负极的电极反应式为 C、每生成1 mol FeS,最终转移的电子数为2 D、镀锌或铜的钢管破损后均会加快钢管的腐蚀11. 下列说法正确的是( )A、常温下2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O可自发进行,则该反应的ΔH﹤0 B、用牺牲阳极的阴极保护法来保护钢闸门时,可用锌板作为牺牲阳极 C、常温下,向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中 ·c(OH-)值不变 D、Na2O2与足量的水反应生成2.24LO2 , 转移的电子数目为0.2×6.02×1023三、非选择题
-
12. 我国材料科学家师昌绪在合金钢、高温合金及材料强度的研究领域作出了杰出贡献,荣获2010年度国家最高科学技术奖.
①合金是生活中常见的材料.某合金具有密度小、强度高的优良性能,常用于制造门窗框架.该合金中含量最高的金属元素的原子结构示意图为 .
②铁锈的主要成分是(填化学式),它是钢铁在潮湿的空气中发生腐蚀的结果.
③玻璃是一种常用的硅酸盐材料.制备普通玻璃的原料有Na2CO3、和(填化学式).
13. 利用如图装置,可以模拟铁的电化学防护.若X为铜,为减缓铁的腐蚀,开关K应置于 处.铁棒上发生的电极反应为 , 该种防护方法称为若X为锌棒,开关K置于处,铁棒上的电极反应为该电化学防护法称为 .
 14. 海边铁制品较易被腐蚀的原因是: . 写出金属防护的一种常用方法 .15. 如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
14. 海边铁制品较易被腐蚀的原因是: . 写出金属防护的一种常用方法 .15. 如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.①环境中的Cl﹣扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为;
②若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为L(标准状况).
 16. 某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:
16. 某同学为了探究不同条件下铁钉的锈蚀情况,设计了如下实验:(ⅰ)取三支试管,标记为I、II、III,I中盛有适量蒸馏水,II中盛有适量蒸馏水和植物油,III洁净干燥
(ⅱ)在三支试管中各放入一根无锈铁钉.并将II和III用软木塞塞紧,III中放入一小团棉花(如图所示).请回答:
 (1)、三支试管中铁钉锈蚀的速度从高到低依次排列为
(1)、三支试管中铁钉锈蚀的速度从高到低依次排列为由此可以得出铁钉锈蚀的条件有和 .
若该同学将I放在每天阳光直晒的阳台上,与避光保存相比,哪种保存方法锈蚀更快?这说明锈蚀速度与什么因素有关?
若该同学将I中的液体换做食盐水,对锈蚀的速率有何影响?这说明锈蚀速率还和什么因素有关? .
17. 某实验小组金属的电化学腐蚀实验探究(1)、完成下列问题。实验序号
实验装置
实验方案
实验现象
实验一

将琼脂加入烧杯中,再加入饱和食盐水和水。搅拌、加热煮沸,使琼脂溶解,转入培养血中。滴入5~6滴酚酞溶液和溶液
将一个铁钉用砂纸打磨光滑,一端缠有铜丝,放入培养皿中一段时间。
铜丝的区域溶液变红色;铁钉区域出现蓝色沉淀。
①请解释铜丝区域溶液变红的原因是。
②写出生成蓝色沉淀的离子方程式。
(2)、完成下列问题。实验序号
实验方案
实验现象
实验二
取饱和溶液于试管中,滴加几滴淀粉,振荡。继续滴加5~6滴溶液,振荡。
滴入溶液后,溶液变蓝色。
根据实验二的现象,推测可能具有“填氧化性或还原性”。
(3)、依据实验二的现象,甲同学认为实验一不一定能说明发生了电化学腐蚀,设计如下实验证明其结论。实验序号
实验装置
实验方案
实验现象
实验三

取煮沸过的的溶液于试管中,向试管中加入一小段铁片,再加入煤油液封。
溶液无明显变化
继续向试管中加入少许固体。
一段时间后,铁片表面产生大量的蓝
根据实验现象推出实验三的结论是:在溶液中情况下,。
(4)、结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为时,实验四的两个实验方案均可以证明发生电化学腐蚀①补全实验方案2中的空格部分
实验序号
实验装置
实验方案
实验现象
实验四

1.按图连接好装置,准确读取电流表读数。
电流表指针偏转,读数为I
2.取于试管中,加入溶液,振荡。
产生蓝色沉淀。
②思考:若电极X为时,电流表读数为 , 推测电极X为时电流表读数的范围是。
18. 某实验小组欲探究牺牲阳极法的原理,设计如图实验装置: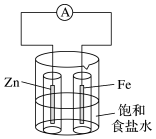 (1)、实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。
(1)、实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。锌棒上发生的电极反应为;铁棒上发生的电极反应为。
(2)、向铁棒附近滴加K3[Fe(CN)6]溶液,无明显现象,这说明该实验中无产生。(3)、实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流表连接。一段时间后,向插入铁棒的玻璃筒内滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞溶液。实验Ⅱ中电流表指针的偏转方向与实验Ⅰ(填“相同”或“相反”)。
(4)、在铁棒和铜棒附近可观察到的现象分别是、。(5)、上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对(填“活泼”或“不活泼”)的金属被保护,根据此原理采取的金属防护方法称为。19. 《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。(1)、查阅高中教材得知铜锈为Cu2(OH)2CO3 , 俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。请写出Cu在空气中生成铜锈的方程式。(2)、继续查阅资料,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学者将铜锈分为无害锈和有害锈,结构如图所示:
Cu2(OH)3Cl属于(填“无害锈”和“有害锈”),请解释原因。
(3)、文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),请结合如图回答:
①过程I的正极反应物是。
②过程I负极的电极反应式是。
(4)、青铜器的修复有以下三种方法:i.柠檬酸浸法:将腐蚀文物直接放在2%—3%的柠檬酸溶液中浸泡除锈;
ii.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)3Cl;
iii.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl- , 能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
20. 根据所学电化学知识填空。(1)、如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
①Zn电极为电池的(填“正极”或“负极”)。
②写出电极反应式:Zn电极 , Cu电极。
③盐桥中向CuSO4溶液中迁移的离子是(填离子符号)。
(2)、金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
①图1中被腐蚀的金属为(填化学式);图2中金属腐蚀类型属于(填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是(填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为。
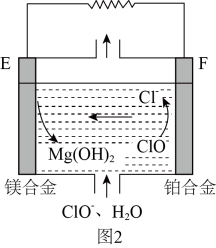
21. 回答下列问题:(1)、X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法错误的是A、若W是单质铁,则Z溶液可能是溶液 B、若W是氢氧化钠,则X水溶液呈酸性 C、若W是氧气,则X、Z的相对分子质量可能相差48 D、若W是强氧化性的单质,则X可能是金属铝(2)、A是一种常见的铵盐,受热分解可得到碱性气体B,C、D是常见的两种氧化物,E溶液显酸性。A、B、C、D、E是含有一种相同元素的五种化合物,在一定条件下可发生如图所示的转化。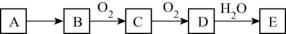
①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
(3)、电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
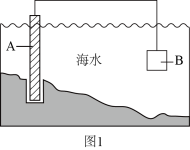
a.碳棒 b.锌板 c.铜板
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。