2024年高考化学一轮复习:专题10化学反应与能量
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列说法错误的是( )A、该过程中电能转化为了化学能 B、该过程属于氮的固定 C、转化过程中能量守恒 D、断裂键会释放出能量2. 反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:

下列有关四种不同反应进程的说法正确的是( )
A、对于进程Ⅰ、Ⅱ,生成等量的P所吸收的热量相同 B、对于进程Ⅱ、Ⅲ,催化效率 C、对于进程Ⅰ,升高温度,正、逆反应速率均增大,但正反应速率增加更明显 D、对于进程Ⅳ,Z没有催化作用3. 下列说法正确的是( ) A、图1所示装置能将化学能转化为电能 B、图2所示反应为吸热反应 C、锌锰干电池中,锌筒作正极 D、蓄电池充电时也发生了氧化还原反应4. 由甲醇制备二甲醚涉及如下反应:
A、图1所示装置能将化学能转化为电能 B、图2所示反应为吸热反应 C、锌锰干电池中,锌筒作正极 D、蓄电池充电时也发生了氧化还原反应4. 由甲醇制备二甲醚涉及如下反应: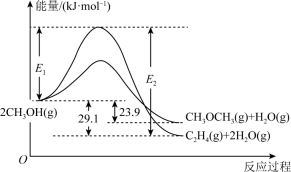
①2CH3OH(g) ⇌ C2H4(g)+2H2O(g) △H1;
2CH3OH(g) ⇌ CH3OCH3(g)+H2O(g) △H2。
下列说法正确的是( )
A、△H1<△H2 B、反应②为吸热反应 C、C2H4(g)+H2O(g) ⇌ CH3OCH3(g) △H=-5.2kJ•mol-1 D、相同条件下,CH3OCH3(g)比C2H4(g)稳定5. 下列说法中正确的是( )A、化学反应中的能量变化都表现为热量的变化 B、增加炼铁高炉的高度可以降低尾气中CO的含量 C、无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率 D、把煤粉碎了再燃烧可以提高煤的燃烧效率6. 下列做法有利于提高空气质量的是( )A、燃放烟花爆竹 B、利用风能发电 C、使用含硫煤供暖 D、使用大排量汽车7. 下列反应属于氧化还原反应,且能量变化如图所示的是( )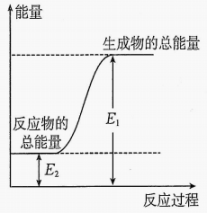 A、甲烷的燃烧反应 B、碳与在高温下化合 C、柠檬酸溶解水垢 D、铝与氧化铁高温下反应8. 由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程示意图如下:
A、甲烷的燃烧反应 B、碳与在高温下化合 C、柠檬酸溶解水垢 D、铝与氧化铁高温下反应8. 由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程示意图如下: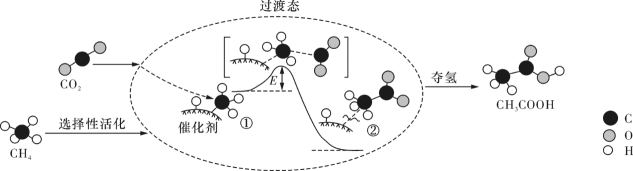
下列说法错误的是( )
A、生成CH3COOH总反应的原子利用率为100% B、CH4 →CH3COOH过程中,有C-H键发生断裂 C、①→②放出能量并形成了C-C键 D、该催化剂能改变反应的焓变二、多选题
-
9. 工业合成氨是人类科学技术的一项重大突破。N2与H2反应合成氨为可逆反应,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=−92.4kJ∙mol−1。氨气经氧化等步骤制得硝酸,利用石灰乳、尿素等可吸收硝酸工业的尾气(含NO、NO2)。下列有关工业合成氨的反应说法正确的是( )A、该反应过程中N2表现出氧化性 B、恒温恒容密闭容器中充入1molH2和3 molN2充分反应后放出热量为92.4 kJ C、断裂1molH-H键的同时断裂2 molN-H键,说明该反应达到平衡状态 D、达到平衡时,增大容器的体积,v(正)减小、v(逆)增加10. 科研人员通过控制光沉积的方法构建复合材料光催化剂,以Fe2+和Fe3+渗透Nafion膜在酸性介质下构建了一个还原和氧化分离的人工光合体系,其反应机理如图。下列说法正确的是
 A、a的价电子排布式:3d5 B、体系中能量转化形式:电能→化学能 C、体系中总反应的活化能:Ea正>Ea逆 D、理论上每消耗18g水生成46gHCOOH11. 一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法错误的是( )
A、a的价电子排布式:3d5 B、体系中能量转化形式:电能→化学能 C、体系中总反应的活化能:Ea正>Ea逆 D、理论上每消耗18g水生成46gHCOOH11. 一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法错误的是( )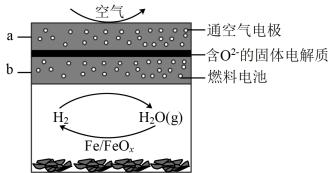 A、a电极上发生氧化反应 B、负极的电极反应式为 C、铁表面发生的反应为 D、若标准状况下33.6L空气参与反应,电路中理论上有6mol电子转移12. 一种染料敏化太阳能电池如图,其成本便宜且对环境无污染。敏化染料()吸附在纳米空心球表面。光照时:(基态)(激发态), , 下列说法正确的是( )
A、a电极上发生氧化反应 B、负极的电极反应式为 C、铁表面发生的反应为 D、若标准状况下33.6L空气参与反应,电路中理论上有6mol电子转移12. 一种染料敏化太阳能电池如图,其成本便宜且对环境无污染。敏化染料()吸附在纳米空心球表面。光照时:(基态)(激发态), , 下列说法正确的是( ) A、该装置能将太阳能转化成电能 B、正极的电极反应式为 C、敏化染料还原过程为 D、该电池工作一段时间后需要补充电解质13. 研究表明,用作催化剂促进水分解时存在两种不同的路径,分解过程中的部分反应历程如图所示(物质中原子之间的距离单位为)。下列说法错误的是
A、该装置能将太阳能转化成电能 B、正极的电极反应式为 C、敏化染料还原过程为 D、该电池工作一段时间后需要补充电解质13. 研究表明,用作催化剂促进水分解时存在两种不同的路径,分解过程中的部分反应历程如图所示(物质中原子之间的距离单位为)。下列说法错误的是 A、水的分解反应为放热反应 B、反应历程中,钒原子的杂化方式发生改变 C、IM2中,距离为“2.174和“2.390”的原子之间作用力是氢键 D、适当升高温度,IM2→FS3的正反应速率增大的程度小于逆反应速率增大的程度14. 是一种很有前途的纳米酶,具有疾病诊断和治疗的潜力。一种带氧空位的纳米酶催化某反应的机理和相对能量(能量单位:)的变化如图(a)、(b)所示。下列说法错误的是
A、水的分解反应为放热反应 B、反应历程中,钒原子的杂化方式发生改变 C、IM2中,距离为“2.174和“2.390”的原子之间作用力是氢键 D、适当升高温度,IM2→FS3的正反应速率增大的程度小于逆反应速率增大的程度14. 是一种很有前途的纳米酶,具有疾病诊断和治疗的潜力。一种带氧空位的纳米酶催化某反应的机理和相对能量(能量单位:)的变化如图(a)、(b)所示。下列说法错误的是 A、该过程的总反应可表示为 B、过程iii和iv表示两个被还原 C、该催化循环过程中的化合价未发生改变 D、该过程的总反应速率由过程ii决定
A、该过程的总反应可表示为 B、过程iii和iv表示两个被还原 C、该催化循环过程中的化合价未发生改变 D、该过程的总反应速率由过程ii决定三、非选择题
-
15. 从能量的角度看,断开化学键要 , 形成化学键要。化学反应是释放能量还是吸收能量取决于 , 当反应物的总能量高于生成物时,该反应为反应;当反应物的总能量低于生成物时,该反应为反应。16. 从能量的角度看,断开化学键要能量,形成化学键要能量。若某反应的反应物总能量大于生成物的总能量,那么,该反应是一个(填“放热”或“吸热”)反应。17. 19世纪初,法国科学家杜龙和珀蒂测定比热时发现:金属的比热( )与其相对原子质量的乘积近似为常数25.08 。将40.0g惰性金属M加热到100℃,投入20.0g温度为36.7℃的水中,最终体系的温度为46.7℃。推算该金属的近似摩尔质量(水的比热为4.18 ,请写出计算过程,结果保留整数)。18. 为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
 (1)、上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是。(2)、某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 , 说明该反应属于(填“吸热”或“放热”)反应。(3)、为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
(1)、上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是。(2)、某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 , 说明该反应属于(填“吸热”或“放热”)反应。(3)、为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。①若M为钠,则实验过程中烧杯中可观察到的现象是;
②若观察到烧杯里产生气泡,则说明M溶于水(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是。
19. 不同的化学反应具有不同的反应热,人们可以通过多种方法获得反应热的数据,通常用实验进行测定,也可以进行理论推算。(1)、已知 , 如图所示是探究中和热的实验装置。
①装置中仪器A的作用是;
②本实验采用50mL 0.50盐酸、50mL 0.55氢氧化钠溶液反应,经三次实验测得反应前后的温差平均值为3.3℃,其密度近似地认为均为1 , 反应后溶液的比热容。则该实验中盐酸和氢氧化钠溶液反应中和热为;
③下列操作会导致中和热的测定数值偏大的是(填标号);
a.大烧杯上不盖塑料盖板
b.将强酸强碱换成弱酸弱碱
c.用50mL 0.50盐酸与1.1g NaOH固体进行反应
d.将环形玻璃搅拌棒改成环形铜质搅拌棒
e.使用浓硫酸与氢氧化钠溶液进行反应
④若将反应物改为50mL 0.50稀硫酸与50mL 0.55氢氧化钡溶液,测得反应热为 , 则(填“>”或“<”),原因是。
(2)、下列化学反应能用图甲表示的反应有 (填标号),能用图乙表示的反应有(填标号)。(已知:键能为1mol气态分子解离成气态原子所吸收的能量)。
A.镁条与盐酸的反应 B.煤的气化
C.煅烧石灰石 D.铝热反应
20. 化学反应在发生物质变化的同时伴随着能量的变化,它是人类获取能量的重要途径,而许多能量的利用与化学反应中的能量变化密切相关。回答下列问题:
(1)、的反应过程如图所示:

该反应为(填“放热”或“吸热”)反应,生成吸收或放出的热量为。
(2)、下列变化中属于吸热反应的是(填标号)。①液态水汽化 ②生石灰与水反应生成熟石灰 ③
④与固体混合
(3)、某化学反应中,设反应物的总能量为 , 生成物的总能量为。若 , 则该反应可用图(填“A”或“B”)表示。
 (4)、为了验证与的氧化性强弱,图中能达到实验目的的装置是(填标号),其正极的电极反应式为;若构建该原电池时两个电极的质量相等,当导线中通过电子时,两个电极的质量差为g。
(4)、为了验证与的氧化性强弱,图中能达到实验目的的装置是(填标号),其正极的电极反应式为;若构建该原电池时两个电极的质量相等,当导线中通过电子时,两个电极的质量差为g。
 (5)、用于燃料电池后,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得定向移向电极,则(填“A”或“B”)电极入口处通 , 参与的电极反应为。
(5)、用于燃料电池后,其利用率更高,装置如图所示(A、B为多孔碳棒)。实验测得定向移向电极,则(填“A”或“B”)电极入口处通 , 参与的电极反应为。
 21. 工业合成氨的反应如下:N2 + 3H22NH3。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2 , 一段时间后反应达平衡状态,实验数据如下表所示:
21. 工业合成氨的反应如下:N2 + 3H22NH3。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2 , 一段时间后反应达平衡状态,实验数据如下表所示:t/s
0
50
150
250
350
n(NH3)
0
0.24
0.36
0.40
0.40
(1)、0~50s内的平均反应速率 v(N2) = 。(2)、250s时,H2的转化率为。(3)、已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是。 (4)、为加快反应速率,可以采取的措施。
(4)、为加快反应速率,可以采取的措施。a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
(5)、下列说法错误的是____。A、使用催化剂是为了加快反应速率,提高生产效率 B、上述条件下,N2不可能100%转化为NH3 C、为了提高N2的转化率,应适当提高H2的浓度 D、250~350s生成物浓度保持不变,反应停止22. 减少CO2排放并实现CO2的有效转化已成为科研工作者的研究热点。根据以下几种常见的CO2转化方法,回答下列问题: (1)、I.研究表明,利用如图所示的原理,可以将CO2转化为炭黑。
(1)、I.研究表明,利用如图所示的原理,可以将CO2转化为炭黑。该过程的能量转化形式为 , 在整个过程中, FeO 的作用是。
(2)、已知:①2Fe3O4(s)=6FeO(s)+O2(g) ΔH1=akJmol②C(s)+O2(g)=CO2(g) ΔH2=bkJ/mol
则过程1的热化学方程式为。
II.以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化: In2O3( 无活性) In2O3-x(有活性) ;
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3主反应
反应②: CO2(g)+H2(g)CO(g)+H2O(g) ΔH4副反应
(3)、某温度下,在恒容密闭反应器中,下列能说明反应①达到平衡状态的是____ (填编号 )。A、混合气体的密度不再变化 B、CH3OH的分压保持不变 C、v正(H2):v逆(CH3OH)=3:1 D、CO2、H2、CH3OH和H2O的浓度之比为1:3:1:1(4)、增大CO2和H2混合气体的流速,可减少产物中H2O(g) 的积累,从而减少催化剂的失活,请用化学方程式表示催化剂失活的原因:。(5)、ii中反应①、②的lnK(K代表化学平衡常数)随 ×103 (T代表温度)的变化如图所示。a.升高温度,反应CO(g)+2H2(g)CH3OH(g)的化学平衡常数K (填“增大” “减小”或“不变”)。
b.恒温恒压密闭容器中,加入2molCO2和4molH2 , 只发生反应①和反应②,初始压强为P0。 在230℃以上,升高温度,CO2 的平衡转化率增大,但甲醇的产率降低,可能原因是 。在300℃发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp= ( 保留两位有效数字)。
