2024年高考化学一轮复习:专题9元素周期表
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 短周期元素W、X、Z、Y、N,原子序数依次增大,W与Y原子最外层电子数之和等于X原子最外层电子数,它们形成如图物质,下列说法正确的是( )
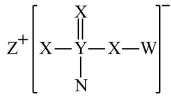 A、原子半径W<X<Y<N<Z B、N的含氧酸酸性比Y的强 C、Z、N都能与X形成有漂白性的物质,且漂白原理相似 D、该化合物中所有原子都满足结构2. 已知前四周期主族元素M、N、P、Q、W在周期表中的位置如图所示,且最外层电子数之和为20。则下列说法正确的是( )
A、原子半径W<X<Y<N<Z B、N的含氧酸酸性比Y的强 C、Z、N都能与X形成有漂白性的物质,且漂白原理相似 D、该化合物中所有原子都满足结构2. 已知前四周期主族元素M、N、P、Q、W在周期表中的位置如图所示,且最外层电子数之和为20。则下列说法正确的是( )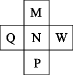 A、M、N的简单氢化物的稳定性:M<N B、N、W的最高价氧化物对应的水化物酸性:N>W C、Q是同周期主族元素中离子半径最小的元素 D、W的氯化物一定满足8电子稳定结构3. 常见的非金属元素和金属元素及其化合物是中学化学核心知识。下列说法正确的是( )A、半径大小:r(Al)>r(Na) B、电离能大小:I1(N)>I1(O) C、电负性大小:χ(F)<χ(O) D、碱性强弱:NaOH<Al(OH)34. 火星气体及岩石中富含原子序数递增的四种短周期元素 , 其中为短周期元素中原子半径最大的元素(除稀有气体元素),为同一主族元素,是地壳中含量最高的元素,火星岩石中含有。下列判断正确的是( )A、离子半径: B、最高价氧化物对应的水化物的酸性: C、简单氢化物的稳定性: D、化合物只含离子键5. 现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大。相关信息如下表:
A、M、N的简单氢化物的稳定性:M<N B、N、W的最高价氧化物对应的水化物酸性:N>W C、Q是同周期主族元素中离子半径最小的元素 D、W的氯化物一定满足8电子稳定结构3. 常见的非金属元素和金属元素及其化合物是中学化学核心知识。下列说法正确的是( )A、半径大小:r(Al)>r(Na) B、电离能大小:I1(N)>I1(O) C、电负性大小:χ(F)<χ(O) D、碱性强弱:NaOH<Al(OH)34. 火星气体及岩石中富含原子序数递增的四种短周期元素 , 其中为短周期元素中原子半径最大的元素(除稀有气体元素),为同一主族元素,是地壳中含量最高的元素,火星岩石中含有。下列判断正确的是( )A、离子半径: B、最高价氧化物对应的水化物的酸性: C、简单氢化物的稳定性: D、化合物只含离子键5. 现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大。相关信息如下表:元素
相关信息
X
最外层电子数是核外电子总数的一半
Y
在地壳中含量居第三位
Z
单质为淡黄色固体,常存在于火山喷口附近
Q
同周期元素中原子半径最小
下列说法正确的是( )
A、常温时,X单质能与水发生剧烈反应 B、工业上常用电解熔融的来制备Y C、因为Q元素的氢化物酸性比Z强,所以非金属性:Q>Z D、第5周期且与Q同主族元素的单质在常温常压下呈固态6. 现有四种元素基态原子的电子排布式如下:①②③④。则下列有关比较中正确的是( )A、第一电离能:④>③>①>② B、原子半径:④>③>②>① C、电负性:④>③>①>② D、最高正化合价:④>③=②>①7. CdSnAs2是一种高迁移率的新型热电材料,下列有关该材料所涉及元素及其同族元素相关化合物的论述正确的是( )A、键角由大到小的顺序为NH3> PH3> AsH3 B、Cd为48号元素,其基态原子的电子排布式为[ Ar]3d104s2 C、Sn位于第五周期第IVA族,其价层电子排布式为4d105s25p2 D、SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4的还原性小于CH4的8. X、Y、Z、W、R属于元素周期表中前20号主族元素,且原子序数依次增大。X和Z的基态原子的2p能级上各有两个未成对电子,W与Z同族。R的最外层电子数与最内层电子数相等。下列说法正确的是( )A、元素第一电离能: B、简单离子半径: C、简单气态氢化物的热稳定性: D、最高价氧化物对应水化物的酸性:二、多选题
-
9. 、、三种非金属,原子最外层电子数相等。等物质的量的单质、、分别与足量钠反应时放热,反应放出的热量分别为 , 且 , 下列判断一定正确的是( )A、气态氢化物的沸点 B、最高价氧化物的水化物酸性 C、气态氢化物的稳定住 D、原子半径10. 、、、是原子序数依次增大的短周期不同主族元素,的轨道有两个未成对电子,元素原子半径在同周期中最大,与最外层电子数之和与的最外层电子数相等,元素单质常温下是淡黄色固体。下列说法正确的是( )A、第一电离能: B、在元素周期表中位于区 C、、、的单质形成的晶体类型相同,均为分子晶体 D、的最高价含氧酸的钠盐溶液中有三种含元素的微粒11. 部分短周期元素的原子半径及主要化合价见下表。
元素
X
Y
Z
W
T
原子半径/nm
0.152
0.186
0.066
0.102
0.099
最外层电子数
1
1
6
6
7
下列有关说法正确的是( )
A、简单离子的半径:Y>Z>X B、气态氢化物的热稳定性:W>Z C、Y与Z形成的化合物可能具有强氧化性 D、常温下,W单质的分子间作用力小于T单质12. 一种抗甲状腺药物结构简式如图所示,其中W、X、Y、Z为原子序数依次增大的短周期元素,分别位于三个周期,原子序数 , 下列说法错误的是( ) A、原子半径: B、Y和Z的最高价含氧酸均为强酸 C、W和Y形成的化合物中只含共价键 D、该物质中Y为杂化
A、原子半径: B、Y和Z的最高价含氧酸均为强酸 C、W和Y形成的化合物中只含共价键 D、该物质中Y为杂化三、非选择题
-
13. 下表列出了A- H8种元素在周期表中的位置(填元素符号) :
族
周期
I A
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
E
F
3
A
C
D
G
H
4
B
这8种元素分别为A , B , C ,D , E ,F , G H 。其中化学性质最不活泼的是。
14. 铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:(1)、Fe元素位于元素周期表的区,与Fe同周期的所有元素的基态原子中,未成对电子数与Fe3+相同的元素有种。(2)、FeCl3蒸汽状态下以双聚分子(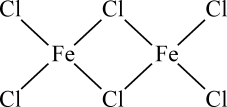 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。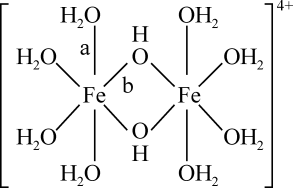 (3)、用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为 , K4[Fe(CN)6]中存在(填代号)。
(3)、用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为 , K4[Fe(CN)6]中存在(填代号)。a.离子键|b.氢键 c.配位键 d.金属键
(4)、Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为;Fe4N晶胞中与N最近的Fe原子数为;Fe与Fe之间的最短距离为cm。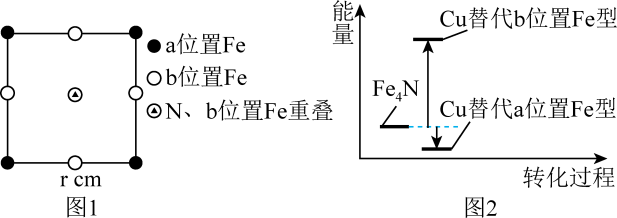 15. 海洋资源的利用具有非常广阔的前景。回答下列问题:
15. 海洋资源的利用具有非常广阔的前景。回答下列问题:Ⅰ.海水提溴
 (1)、溴元素在元素周期表中的位置为(2)、吸收塔用二氧化硫和水吸收的离子方程式为:(3)、蒸馏塔的蒸馏温度应控制在最有利于生产,原因可能为:温度过高,;温度过低,(4)、两次通入的离子反应相同,其离子方程式为 , 通反应后使用了空气吹出法,该方法利用了溴单质的性质。(5)、Ⅱ.海水提镁
(1)、溴元素在元素周期表中的位置为(2)、吸收塔用二氧化硫和水吸收的离子方程式为:(3)、蒸馏塔的蒸馏温度应控制在最有利于生产,原因可能为:温度过高,;温度过低,(4)、两次通入的离子反应相同,其离子方程式为 , 通反应后使用了空气吹出法,该方法利用了溴单质的性质。(5)、Ⅱ.海水提镁
工业上常用于沉淀的廉价试剂①的俗名是。操作Ⅰ的名称是。
(6)、步骤A的化学方程式为(7)、Ⅲ.海带提碘
步骤B需搅拌、加热煮沸的目的是。步骤C中反应的离子方程式为
16. 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题: (1)、元素p是(填元素符号),元素p的基态原子电子排布式是:。(2)、cdef四种元素的第一电离能由小到大顺序为:。(3)、o、p两元素的部分电离能数据如下表:
(1)、元素p是(填元素符号),元素p的基态原子电子排布式是:。(2)、cdef四种元素的第一电离能由小到大顺序为:。(3)、o、p两元素的部分电离能数据如下表:电离能/kJ·mol-1
元素o
元素p
I1
717
759
I2
1509
1561
I3
3248
2957
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是。
(4)、下列各项叙述中,正确的是____。A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 B、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 D、24Cr原子的电子排布式是1s22s22p63s23p63d44s217. 比较下列粒子的半径大小①Na Mg O F
②Na+ Mg2+ O2- F-
③ Na+ Mg2+ S2- Cl-
18. 如图的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线. 19. 下表为元素周期表前三周期的一部分:
19. 下表为元素周期表前三周期的一部分:X
R
Y
Z
W
(1)、基态Z原子的价电子排布式为。(2)、X与Y的简单氢化物中沸点较高的是(填化学式),原因是。(3)、选出X的基态原子的电子排布图(填“①”或“②”),另一电子排布图不能作为基态原子的电子排布图是因为它不符合(填标号)。①
 ②
②
A.能量最低原理 B.泡利原理 C.洪特规则
(4)、以上五种元素中,(填元素符号)元素第一电离能最大,与分子中键角较大的是(填分子式)。(5)、已知Z、W可形成分子 , 且Z、W原子均满足稳定结构,则的结构式为 , Z原子的杂化方式为。20. 研究性学习小组设计了几组实验验证元素周期律。(1)、I.甲组同学在A、B、C,D四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相同的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块(镁、铝已除去氧化膜),观察现象。甲组同学实验的目的:验证同一主族从上到下金属元素原子失电子能力逐渐(填“增强”或“减弱”,下同);同一周期主族元素从左到右金属元素原子失电子能力逐渐。
(2)、实验中发现B、C两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法:____(填字母)。A、将烧杯中的冷水换成等量的98%浓硫酸 B、将烧杯中的冷水换成热水 C、将烧杯中的冷水换成等量的的盐酸 D、将烧杯中的冷水换成等量的的溶液(3)、II.乙组同学设计实验探究碳、硅元素非金属性的相对强弱,实验装置如图所示。
仪器A的名称为。
(4)、实验步骤:①连接仪器,② , ③加入固体、液体药品,④打开A的活塞滴入浓硫酸,⑤加热,观察现象。(5)、问题探究:[已知酸性:亚硫酸(H2SO3)>碳酸(H2CO3)]①铜与浓硫酸反应的化学方程式为;装置E中酸性溶液的作用是。
②能说明碳元素的非金属性比硅元素的强的实验现象是。
③该实验能否证明S的非金属性强于C的非金属性?(填“能”或“不能”),理由是。
21. 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。族周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
二
①
②
③
④
三
⑤
⑥
⑦
⑧
⑨
⑩
(1)、从元素原子得失电子的角度看,元素⑤具有(填“氧化性”或“还原性”)。(2)、元素②形成的单质气体含有(填“极性”或“非极性”)共价键。(3)、元素③、⑨与H原子以原子个数比为1∶1∶1形成的化合物的电子式为。(4)、第三周期中元素的最高价氧化物对应水化物中碱性最强的是(填化学式,下同),最高价氧化物对应的水化物具有两性的物质是 , 这两种物质反应的离子方程式为。(5)、元素③、⑤、⑨形成简单离子的半径由大到小的顺序是(填离子符号)。22. 下表显示了元素周期表中的一部分。族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
第一周期
1 H
氢
2 He
氦
第二周期
3 Li
锂
4 Be
镀
5 B
硼
6 C
碳
7 N
氮
8 O
氧
9 F
氟
10 Ne
氖
第三周期1
1 Na
钠
12 Mg
镁
33 Al
铝
14 Si
硅
15 P
磷
16 S
硫
17 C
氯
18 Ar
氩
请回答下列问题。
(1)、硫元素的原子序数是。(2)、氟元素的原子结构示意图为____(填写字母)。A、 B、
B、 (3)、镁元素在元素周期表的第(填“二”或“三”)周期第(填“ⅡA”或“ⅢA”)族。(4)、已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H(填“<”或“>”)Na。(5)、雷雨天闪电时空气中有O3生成,O2转化为O3是(填“物理变化”或“化学变化”)。(6)、SiO2可用于生产光导纤维,SiO2中硅元素的化合价为。(7)、海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为。23. A、B、C、D、E、F、G、H 是八种短周期主族元素。根据下表完成后面填空:(所有空都用元素符号或化学式填写)
(3)、镁元素在元素周期表的第(填“二”或“三”)周期第(填“ⅡA”或“ⅢA”)族。(4)、已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H(填“<”或“>”)Na。(5)、雷雨天闪电时空气中有O3生成,O2转化为O3是(填“物理变化”或“化学变化”)。(6)、SiO2可用于生产光导纤维,SiO2中硅元素的化合价为。(7)、海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为。23. A、B、C、D、E、F、G、H 是八种短周期主族元素。根据下表完成后面填空:(所有空都用元素符号或化学式填写)族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
A
2
B
C
D
3
E
F
G
H
(1)、表中所标出的A、B、C、D、E、F 六种元素中,原子半径最大的元素是 , 非金属性最强的元素是 , 这两种元素形成的化合物可能的化学式是。(任写一种)(2)、写出F的核外电子排布式。F 的最高价氧化物对应的水化物能与E的最高价氧化物对应的水化物发生反应,写出该反应的方程式。(3)、D元素和G元素的非金属性强弱为 , 用一个事例或方程式来表现这个强弱。(4)、A、B、D、E 四种元素所形成的化合物是 , 侯氏制碱法的第一步即制取该物质,写出该步骤的化学方程式: 。24. 已知a、b、c、d、e、f是原子序数依次增大的前四周期的六种元素, a元素基态原子最高能级的不同轨道都有电子且自旋方向相同;b元素基态原子的价电子排布为nsnnp2n;c元素的电负性在已知元素中最强;d元素基态原子的价电子数等于其电子层数;e元素的单质在常温下为黄绿色气体;f元素基态原子最外层只有1个电子,次外层所有轨道的电子均成对。请回答下列问题(答题时涉及a~f元素,要用元素符号或化学式表示):(1)、基态d原子的核外电子共有种空间运动状态;f元素位于周期表的区,其基态原子的电子排布式为。(2)、简单氢化物的沸点c>e的原因是。(3)、a、b、c三种元素的第一电离能由大到小的顺序为。(4)、a的最高价氧化物对应水化物中的酸根阴离子的空间构型为。(5)、比较表1中Mn、Fe两元素的I2、I3 , 可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子(填“易”或“难”),你的解释是。元素
Mn
Fe
电离能/kJ·mol
I1
717
759
I2
1509
1561
I3
3248
2957
表1:Mn、Fe的部分电离能
25. 根据下图短周期主族元素的原子序数和化合价(最高正价或最低负价)的关系推断元素种类,回答下列问题: (1)、写出元素②在周期表中的位置;(2)、元素⑤、⑥的最高价氧化物对应的水化物中,碱性较强的是(填化学式);(3)、⑥、⑦、⑧三种元素常见离子的半径最大的是(填离子符号);(4)、元素⑦、⑧形成的简单氢化物中,稳定性较强的是(填化学式);(5)、用电子式表示⑤和⑦按2∶1的原子个数比形成化合物的过程。
(1)、写出元素②在周期表中的位置;(2)、元素⑤、⑥的最高价氧化物对应的水化物中,碱性较强的是(填化学式);(3)、⑥、⑦、⑧三种元素常见离子的半径最大的是(填离子符号);(4)、元素⑦、⑧形成的简单氢化物中,稳定性较强的是(填化学式);(5)、用电子式表示⑤和⑦按2∶1的原子个数比形成化合物的过程。