2024年高考化学一轮复习:专题8原子结构
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 下列物质的表示不正确的是( )A、原子核内有8个中子的碳原子 B、分子的电子式:
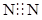 C、氯原子的结构示意图:
C、氯原子的结构示意图: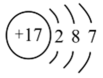 D、乙烯的结构式:
D、乙烯的结构式: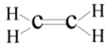 2. 四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
2. 四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )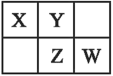 A、原子半径(r)大小比较: B、Y位于第二周期ⅥA族 C、Z的非金属性比W的弱 D、W的氧化物对应水化物一定是弱酸3. 下列化学用语表示正确的是( )A、用于考古断代的碳原子符号: B、用电子式表示NaCl的形成过程:
A、原子半径(r)大小比较: B、Y位于第二周期ⅥA族 C、Z的非金属性比W的弱 D、W的氧化物对应水化物一定是弱酸3. 下列化学用语表示正确的是( )A、用于考古断代的碳原子符号: B、用电子式表示NaCl的形成过程: C、乙酸乙酯的结构式:
C、乙酸乙酯的结构式: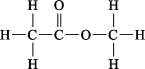 D、Ca2+的离子结构示意图:
D、Ca2+的离子结构示意图: 4. 周期表中VA族元素及其化合物作用广泛。氨是重要的化工原料,广泛用于生产铵盐、硝酸、纯碱、医药等;肼的燃烧热为 , 是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下,与通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列说法正确的是( )A、和中的H—N—H键角相等 B、和晶体类型均为共价晶体 C、和都是由极性键构成的非极性分子 D、基态砷原子核外价电子排布式为5. 元素X、Y、Z、W为短周期主族元素,且原子序数依次增大,X的2p能级中有2个未成对电子,Y是地壳中含量最高的元素 , Z的最高价氧化物对应的水化物为中强碱,W与Y同主族。下列说法正确的是( )A、原子半径:X<Y B、电负性:Y< W C、XY2与WY2的VSEPR模型相同 D、Z的第一电离能大于同周期相邻的元素6. 下列化学用语表示错误的是( )A、熟石膏的化学式: B、甘氨酸的空间填充模型:
4. 周期表中VA族元素及其化合物作用广泛。氨是重要的化工原料,广泛用于生产铵盐、硝酸、纯碱、医药等;肼的燃烧热为 , 是常用的火箭燃料;氮和磷都是植物生长的营养元素,单质磷可由磷酸钙、石英砂和碳粉在电弧炉中熔烧制得;砷化镓是典型的二代半导体材料,在700~900℃条件下,与通过化学气相沉积可制得砷化镓晶体;铅锑合金一般用作铅蓄电池的负极材料。下列说法正确的是( )A、和中的H—N—H键角相等 B、和晶体类型均为共价晶体 C、和都是由极性键构成的非极性分子 D、基态砷原子核外价电子排布式为5. 元素X、Y、Z、W为短周期主族元素,且原子序数依次增大,X的2p能级中有2个未成对电子,Y是地壳中含量最高的元素 , Z的最高价氧化物对应的水化物为中强碱,W与Y同主族。下列说法正确的是( )A、原子半径:X<Y B、电负性:Y< W C、XY2与WY2的VSEPR模型相同 D、Z的第一电离能大于同周期相邻的元素6. 下列化学用语表示错误的是( )A、熟石膏的化学式: B、甘氨酸的空间填充模型: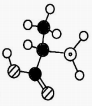 C、淀粉的分子式:
D、的结构示意图:
C、淀粉的分子式:
D、的结构示意图: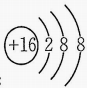
二、多选题
-
7. 反应2NH3+3Cl2=6HCl+N2 , NH3+HCl=NH4Cl(白烟)可用于氯气管道泄漏的检查。下列表示反应中的相关微粒的化学用语正确的是( )A、氯离子的结构示意图:
 B、HCl的电子式:
B、HCl的电子式: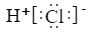 C、中子数为20的氯原子:
D、氮气的结构式:
8. 短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。
C、中子数为20的氯原子:
D、氮气的结构式:
8. 短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。YQ2X2YYW4Y的单质
下列说法正确的是
A、常温下,W与Q形成的化合物为液态 B、X的最高价氧化对应的水化物是强酸 C、ZQ2可用于自来水消毒 D、YW4中仅含离子键9. 短周期元素X、Y、Z、M原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的。下列说法正确的是( ) A、简单离子半径:Y>Z>M B、常温下Z和M的单质均能溶于浓硝酸 C、X+与Y结合形成的化合物是离子晶体 D、Z的最高价氧化物的水化物碱性强于M的最高价氧化物的水化物碱性10. Q、X、Y、Z、W是原子序数依次增大的短周期主族元素,其最外层电子数之和为26,Q与X、Y、Z、W位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,W的一种气态氧化物是高效消毒剂。下列说法正确的是( )A、简单化物的稳定性:Z<Q B、Q与Z一定位于同一主族 C、最高价氧化物的水化物的酸性:Z>Y D、工业上常用电解X与W形成的化合物水溶液的方法制备X单质
A、简单离子半径:Y>Z>M B、常温下Z和M的单质均能溶于浓硝酸 C、X+与Y结合形成的化合物是离子晶体 D、Z的最高价氧化物的水化物碱性强于M的最高价氧化物的水化物碱性10. Q、X、Y、Z、W是原子序数依次增大的短周期主族元素,其最外层电子数之和为26,Q与X、Y、Z、W位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,W的一种气态氧化物是高效消毒剂。下列说法正确的是( )A、简单化物的稳定性:Z<Q B、Q与Z一定位于同一主族 C、最高价氧化物的水化物的酸性:Z>Y D、工业上常用电解X与W形成的化合物水溶液的方法制备X单质三、非选择题
-
11. 合成氨是人类科学技术发展史上的一项重大成就:。目前合成氨工业中使用的催化剂铁触媒中主要成分为(和),还含有少量的、、、、等。回答问题:(1)、基态N原子中,电子占据最高能级的符号是 , 占据该能级电子的电子云轮廓图为形,核外存在对自旋相反的电子。(2)、26号元素基态原子的价层电子轨道表示式是
 。 (3)、的价层电子排布式为 , 在元素周期表中位于区(填“s”“p”“d”或“”)。(4)、分子中,与N原子相连的H显正电性。分析电负性大小关系为NH(填“>”“<”或“=”)。(5)、的第一电离能 , 的第一电离能 , 结合基态原子价层电子排布式解释第一电离能镁元素高于铝元素的原因:。12. 海洋是巨大的化学资源宝库。从海水中可以制取氯、溴、镁等多种化工产品。(1)、在元素周期表中的位置是第周期、第族。(2)、的最高价氧化物对应的水化物为 , 其中溴元素的化合价是 , 的酸性比的酸性(填“强”或“弱”)。(3)、金属性强于用原子结构解释原因:和位于同一周期,原子核外电子层数相同, , 原子半径大于 , 失电子能力强于。(4)、在元素周期表中,溴()位于第4周期,与同主族。下列实验或事实能说明得电子能力强于的是(填字母)。
。 (3)、的价层电子排布式为 , 在元素周期表中位于区(填“s”“p”“d”或“”)。(4)、分子中,与N原子相连的H显正电性。分析电负性大小关系为NH(填“>”“<”或“=”)。(5)、的第一电离能 , 的第一电离能 , 结合基态原子价层电子排布式解释第一电离能镁元素高于铝元素的原因:。12. 海洋是巨大的化学资源宝库。从海水中可以制取氯、溴、镁等多种化工产品。(1)、在元素周期表中的位置是第周期、第族。(2)、的最高价氧化物对应的水化物为 , 其中溴元素的化合价是 , 的酸性比的酸性(填“强”或“弱”)。(3)、金属性强于用原子结构解释原因:和位于同一周期,原子核外电子层数相同, , 原子半径大于 , 失电子能力强于。(4)、在元素周期表中,溴()位于第4周期,与同主族。下列实验或事实能说明得电子能力强于的是(填字母)。a.将通入溶液中可制得
b.常温常压下,为气态,为液态
c.约500℃开始分解,HCl约1000℃开始缓慢分解
13. 为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。如表是元素周期表的一部分,请按题目要求回答下列问题: (1)、m的一种合金是用量最大、用途最广的合金,则m的元素名称为 , 其在周期表中的位置。m的单质高温下可与水蒸气反应,其化学方程式为:(2)、在a 到n元素中,其某种氧化物可用于呼吸面具中氧气来源,请写出该过程包含的化学方程式 , 该元素的离子结构示意图:(3)、d、g 、n三种元素对应单质的氧化性由强到弱的顺序为:(用其单质的化学式表示)将g的单质通入NaOH溶液中可制备漂白液,漂白液的漂白原理为:(用化学方程式表示)。(4)、f的氧化物既能与酸反应生成盐和水,也能与碱反应生成盐和水,我们把这种氧化物叫做 。14. 依据第2周期元素第一电离能的变化规律,参照图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)、m的一种合金是用量最大、用途最广的合金,则m的元素名称为 , 其在周期表中的位置。m的单质高温下可与水蒸气反应,其化学方程式为:(2)、在a 到n元素中,其某种氧化物可用于呼吸面具中氧气来源,请写出该过程包含的化学方程式 , 该元素的离子结构示意图:(3)、d、g 、n三种元素对应单质的氧化性由强到弱的顺序为:(用其单质的化学式表示)将g的单质通入NaOH溶液中可制备漂白液,漂白液的漂白原理为:(用化学方程式表示)。(4)、f的氧化物既能与酸反应生成盐和水,也能与碱反应生成盐和水,我们把这种氧化物叫做 。14. 依据第2周期元素第一电离能的变化规律,参照图中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置. 15. 硅在生活、生活和科学研究中具有广泛的应用。回答下列问题:(1)、硅在元素周期表的位置是。(2)、请写出硅的原子结构示意图。(3)、氮化硅是一种性能优良的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,根操以上描述,推测氮化硅可能有哪些用途:(填字母)。
15. 硅在生活、生活和科学研究中具有广泛的应用。回答下列问题:(1)、硅在元素周期表的位置是。(2)、请写出硅的原子结构示意图。(3)、氮化硅是一种性能优良的无机非金属材料,它的熔点高,硬度大,电绝缘性好,化学性质稳定,根操以上描述,推测氮化硅可能有哪些用途:(填字母)。a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作电线
(4)、若要下图装置证明酸性:。
从以下所给物质中选出甲同学设计的实验所用到的物质:①稀;②稀盐酸;③碳酸钙;④溶液;⑤。试剂A与C分别为、(填序号);试管中发生反应的离子方程式为。有同学认为此实验不能说明酸性强弱,你认为原因是。
16.(1)、I.硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。从图1中选择符合图2要求的X代表的物质:X。
 (2)、硫原子的最外层电子排布式为 , 其原子核外有种不同能量的电子。在周期表中,与硫相邻的短周期元素的原子半径由大到小的顺序是。(3)、硫化氢溶液在空气中易变浑浊,说明S的非金属性比O(填“强”或“弱”),从原子结构的角度解释其原因:。(4)、下图是燃煤发电厂处理废气的装置示意图,下列说法错误的是____。
(2)、硫原子的最外层电子排布式为 , 其原子核外有种不同能量的电子。在周期表中,与硫相邻的短周期元素的原子半径由大到小的顺序是。(3)、硫化氢溶液在空气中易变浑浊,说明S的非金属性比O(填“强”或“弱”),从原子结构的角度解释其原因:。(4)、下图是燃煤发电厂处理废气的装置示意图,下列说法错误的是____。 A、使用此装置可减少导致酸雨的气体的形成 B、装置内发生了化合反应和分解反应 C、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中一定含有SO2 D、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2(5)、II.某化学兴趣小组用以下装置探究SO2的某些化学性质。
A、使用此装置可减少导致酸雨的气体的形成 B、装置内发生了化合反应和分解反应 C、若排放的气体能使澄清石灰水变浑浊,说明排放的气体中一定含有SO2 D、整个过程的总反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2(5)、II.某化学兴趣小组用以下装置探究SO2的某些化学性质。
装置乙的作用是。若X为品红溶液,观察到溶液褪色,说明SO2具有(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
a.氧化性 b.还原性 c.漂白性 d.酸性
(6)、若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式。Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-++H+
17. 炭粉、CO、H2均可作为实验室还原CuO的还原剂,实验小组对CuO的还原反应及还原产物组成进行探究。查阅资料: PdCl2溶液能吸收CO,生成黑色Pd沉淀、一种氢化物和一种氧化物。
回答下列问题:
(1)、铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为____。A、577~492 nm B、597~577 nm C、622~597 nm(2)、基态Cu+的价电子轨道表示式为。(3)、小组同学用如图所示装置探究炭粉与CuO反应的产物。
①实验结束后,打开开关K通氮气,其目的是。
②试剂X的作用为。
③若气体产物中含有CO,则观察到的现象为 , 其中反应的化学方程式为。
(4)、某小组同学为测定炭粉还原CuO后固体混合物(仅有C和Cu2O)两种杂质)中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸(恰好使固体溶解达到最大值),过滤、洗涤、干燥,所得沉淀的质量为0.160g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25. 00 mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.5000 mol· L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12. 00 mL。已知:2Cu2++5I-=2CuI↓ + ,+2= +3I-。①还原后固体混合物中单质Cu的质量分数为%。
②若CuI吸附部分 ,会导致所测Cu单质的质量分数 (填“偏大”、“偏小”或“无影响”)。
18. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。
①的价层电子排布式为。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因。
③中与与的作用力类型分别是。
(2)、晶体的晶胞形状为立方体,边长为 , 结构如图2。
①距离最近的阴离子有个。
②的摩尔质量为 , 阿伏加德罗常数为。
该晶体的密度为。
19. 如图为元素周期表的一部分,请参考元素①~⑩在表中的位置,用化学式回答问题:族
周期
ⅠA
0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
①
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩
(1)、铝元素在周期表中的位置是。(2)、写出在该元素周期表中属于卤族元素的序号,并写出其离子的结构示意图。(3)、元素⑧、⑨、⑩的最高价含氧酸的酸性由弱到强的顺序为。(4)、⑤在空气中加热燃烧后产物,既含离子键又含非极性共价键的离子化合物,写出该产物的电子式为;写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式。(5)、已知X为第ⅡA族元素(前四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b=(用含a的代数式表示)。20. 按要求完成下列填空:(1)、下列给定的物质中:①NaCl晶体;②;③镁条;④氨气;⑤液态的HCl。属于非电解质的是(填编号)。(2)、写出金属锂投入水中反应的化学方程式:。(3)、比较稳定性:(填“>”、“<”、“=”)。21. 有A、B、C、D、四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子,D元素的原子失去1个电子,所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题:(1)、上述四种元素的名称分别是:A、B、C 、D。(2)、画出A离子的结构示意图 , B离子的结构示图 , C的原子结构示意图 ,D的原子结构示意图。(3)、写出B单质与A单质反应的化学方程式:。(4)、在生活中B的一种化合物可以用来做漂白粉,其有效成分化学式是:。漂白粉需要密封避光保存的原理用化学方程式书写出来:。(5)、写出由C元素构成的互为同素异形体的两种物质:。22. 根据编号①~⑩代表的元素在周期表中的位置,用相应的化学符号回答下列问题:族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
1
①
2
②
③
④
⑤
⑥
3
⑦
⑧
⑨
⑩
(1)、①~⑩代表的元素中,金属性最强的元素是(元素符号),元素⑨⑩形成的化合物与元素⑤的简单氢化物水溶液反应的离子方程式为:。(2)、④的最高价氧化物的电子式。用电子式表示①与⑩形成稳定化合物的过程。(3)、⑨和⑩形成的化合物所含化学键类型为 , 证明化合物含有该化学键的实验事实是。(4)、元素④、⑤、⑩形成的最高价氧化物的水合物酸性强弱顺序是 , 写出一个能证明④和⑩非金属性强弱的化学方程式(5)、⑤和⑩形成的简单氢化物中沸点较高的是 , 原因是。