2024年高考化学一轮复习:专题5常见的金属元素
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 物质的性质决定用途,下列两者对应关系不正确的是( )A、石墨能导电,可用作电极材料 B、过氧化钠可以和二氧化碳反应生成氧气,可用作呼吸面具的供氧剂 C、铝密度小、硬度高,可用作飞机外壳材料 D、氯气常温时不易与铁反应,可用铁罐储存液氯2. 下列对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
向浓盐酸中加入浓硫酸可制备氯化氢气体
浓盐酸易挥发,浓硫酸与水作用放出大量的热
Ⅰ对,Ⅱ对;有
B
能与浓反应
具有还原性,具有氧化性,二者在任何条件下反应生成的气体一定是
Ⅰ对,Ⅱ对;无
C
硫单质在纯氧中燃烧有少量生成
能与在一定条件下反应生成
Ⅰ对,Ⅱ对;无
D
硝酸铵和碱石灰共热用于实验室制备
铵盐与碱能发生复分解反应
Ⅰ对,Ⅱ对;有
A、A B、B C、C D、D3. 下列说法不正确的是( )A、FeO是一种黑色粉末,不稳定,在空气里受热,能被迅速氧化成 B、在钢铁厂的生产中,炽热的铁水注入模具之前,模具必须进行充分干燥 C、使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害 D、硫酸亚铁、硫酸铝可用于污水处理4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、氨气易液化,且液氨汽化时要吸收大量热,因此可用作制冷剂 B、纯铝具有很强的抗腐蚀能力,因此可用作制造飞机的材料 C、可中和酸和受热分解,并产生气体,因此可用作食物膨松剂 D、难溶于水和酸,且不容易被X射线透射,因此可用作“钡餐”5. 我国科学家成功利用人工合成淀粉,使淀粉生产方式从农耕种植转变为工业制造成为可能,其部分转化过程如下:
已知:ZnO是两性氧化物;水解可制得。在指定条件下,下列选项所示的物质间的转化能实现的是( )
A、 B、 C、 D、6. 使4.6gCu和Mg的合金完全溶于浓硝酸中,假定硝酸被还原后只产生4.48LNO2气体(标准状况),向反应后溶液中加入足量NaOH溶液,生成沉淀的最大量为( )A、6.3g B、7.5g C、8.0g D、9.7g7. 物质的性质决定用途,下列两者对应关系错误的是A、能与酸反应,可用作抗胃酸药 B、受热易分解,可用作冷敷袋的主要物质 C、Al还原性比Fe强,Al和能发生铝热反应得到Fe D、易结合水变成蓝色晶体,可用来检验水二、多选题
-
8. 在给定条件下,下列选项所示的物质间转化均能一步实现的是( )A、 B、 C、 D、9. 氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如下图所示:
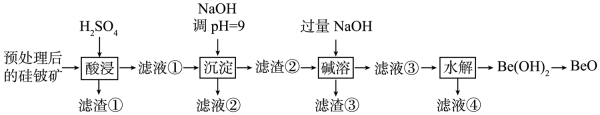
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO。下列说法错误的是( )
A、“酸浸”步骤所得“滤渣①”的主要成分为Si B、“滤液②”经处理后可获得副产品Na2SO4·10H2O C、“碱溶”时,主要反应为Be(OH)2+2OH-=BeO+2H2O D、“水解”时,适当增大溶液pH有利于提高BeO的提取率10. 向物质的量浓度均为0.1mol/L的的混合溶液中加入一定质量的Zn粉,充分反应后过滤,得到固体A和溶液B。下列说法正确的是( )A、向溶液B中滴入几滴KSCN溶液,溶液可能变为血红色 B、将固体A投入稀盐酸中,没有气泡生成,则溶液B中可能含有大量和 C、若溶液B呈蓝绿色,则固体A中一定不含铁元素 D、若溶液B无色透明,则固体A中可能含有Zn粉11. 下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是( )A、 B、 C、 D、12. 类推时要注意物质的相似性和特殊性,下列类推结论正确的是( )选项
化学事实
类推结论
A
在中燃烧生成
在中燃烧也生成
B
属于碳酸盐,也属于正盐
也属于碳酸盐和正盐
C
受热分解为和
也能受热分解生成和
D
与反应放出
与反应也放出
A、A B、B C、C D、D三、非选择题
-
13. 补齐物质与其用途之间的连线如B−a
物质
用途
A.碳酸氢钠
a.作呼吸面具供养剂
B.过氧化钠
b.作食品膨松剂
C.漂粉精
c.作红色颜料
D.氧化铁
d.作游泳池消毒剂
14. 将用途的序号填在对应物质的后面:物质: A.氯化铁;B.氧化铁; C.漂粉精;D.碳酸氢钠。
用途:a.红色颜料 b.焙制糕点 c.蚀刻铜板 d.游泳池消毒
15. 某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中.
编号
现象
离子方程式
①
②
③
16. 某化学小组制取无水三氯化铁并研究其与铜的反应,设计如图实验。(1)、I.制备无水三氯化铁实验装置如图。(已知无水三氯化铁易潮解,易升华)
试剂X可以是;若缺少C装置其后果是(写一条)。
(2)、整个装置充满黄绿色气体后,才开始加热D装置的目的是。(3)、若实验过程中FeCl3沉积在D和E的导管之间,导致导管内径变小,除去沉积FeCl3的简易操作是。(4)、II.探究三氯化铁与铜反应的实验如图:(已知CuCl、CuSCN是难溶于水的白色固体)

请从平衡角度说明红色褪去的可能原因。
(5)、为了进一步研究白色沉淀进行如图实验。
①如图蓝色溶液中可能含有的盐有Cu(NO3)2、。
②实验中CuSCN与过量稀HNO3反应生成白色沉淀B的阴离子,同时生成N2、NO和CO2气体。CuSCN与HNO3反应中还原剂与氧化剂的物质的量之比为(已知SCN-中C为+4价)。
17. 金属及其化合物在人类生产、生活中发挥着重要作用。(1)、中国四大发明之一的指南针由天然磁石制成的,其主要成分是____(填字母)。A、Fe B、FeO C、Fe3O4 D、Fe2O3(2)、在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是(用化学方程式表示)。(3)、铝制餐具不宜长期存放酸性、碱性或咸的食物,其中Al和NaOH溶液反应的离子方程式是(4)、“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2 mol·L-1的NaClO溶液,欲用NaClO固体配制该溶液,实验中需要称量 gNaClO晶体,下图不需要的仪器是(写出仪器名称),若定容时仰视刻度线,则所配溶液浓度0.2 mol·L-1 (填“>”或“<”) (5)、双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:。
(5)、双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:。_+_H2O2+_=_Mn2++_H2O+_
18. 氯化铁是重要的化工原料。针对氯化铁的实验室制备方法,回答下列问题:(1)、Ⅰ.的制备制备流程图如下:

将废铁屑分批加入稀盐酸中,至盐酸反应完全。判断反应完全的现象为。含有少量铜的废铁屑比纯铁屑反应快,原因为。
(2)、操作①所必需的玻璃仪器中,除烧杯外还有。(3)、检验溶液中是否残留的试剂是。(4)、为增大溶液的浓度,向稀溶液中加入纯Fe粉后通入。此过程中发生的主要反应的离子方程式为。(5)、操作②为。(6)、Ⅱ.由制备无水将与液体混合并加热,制得无水。已知沸点为77℃,反应方程式为: , 装置如下图所示(夹持和加热装置略)。

仪器A的名称为 , 其作用为。NaOH溶液的作用是。
(7)、干燥管中无水不能换成碱石灰,原因是。(8)、由下列结晶水合物制备无水盐,适宜使用上述方法的是(填序号)。a. b. c.
19. 从海水中可以获得淡水、食盐并可提取镁、溴等物质。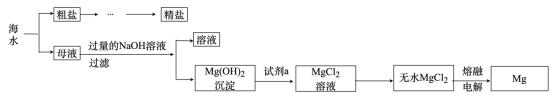 (1)、试剂a是。(2)、从母液中提取镁的过程中,镁元素经历了的过程,目的是。(3)、若要验证所得溶液中是否含有 , 可采用的方法是。(不要求描述操作步骤和现象)(4)、用溶液制成无水 , 加热溶液过程中,会生成溶液和一种酸性气体。写出该反应的化学方程式。(5)、为了除去粗盐中、、及泥沙可将粗盐溶于水,然后进行下列操作,正确的操作顺序是____。
(1)、试剂a是。(2)、从母液中提取镁的过程中,镁元素经历了的过程,目的是。(3)、若要验证所得溶液中是否含有 , 可采用的方法是。(不要求描述操作步骤和现象)(4)、用溶液制成无水 , 加热溶液过程中,会生成溶液和一种酸性气体。写出该反应的化学方程式。(5)、为了除去粗盐中、、及泥沙可将粗盐溶于水,然后进行下列操作,正确的操作顺序是____。①过滤 ②加过量溶液 ③加适量盐酸 ④加过量溶液 ⑤加过量溶液
A、②⑤④①③ B、①④②⑤③ C、④②⑤③① D、⑤②④①③20. 有一份含镁、铝的合金粉末样品,将其分为两等份,向第一份样品中加入过量的氢氧化钠溶液,得到336mLH2(标准状况),向第二份样品中加入100mL1mol/L的盐酸,完全反应后,得到672mLH2(标准状况)。试计算:(1)、原样品中铝的物质的量为。(2)、该合金中镁、铝的物质的量之比为。(3)、为将第二份样品反应后的溶液中的镁、铝元素完全分开,至少需加入1mol/L的NaOH溶液mL。21. 磁性物质X只含两种元素,属于半金属材料,某兴趣小组对化合物X的组成展开如图探究(图中部分产物未标出),已知B的相对分子质量为17,液态B可作制冷剂。请回答:
 (1)、X的组成元素是Fe和(填元素符号);写出C的化学式。(2)、写出溶液A与过量NaOH溶液加热生成气体B的离子方程式。(3)、写出固体X与过量稀HCl反应的化学方程式。22. 为探究由三种短周期元素构成的化合物X(其中一种为金属元素)的组成和性质,某研究小组设计并完成了如下实验(步骤中所加试剂均过量)。
(1)、X的组成元素是Fe和(填元素符号);写出C的化学式。(2)、写出溶液A与过量NaOH溶液加热生成气体B的离子方程式。(3)、写出固体X与过量稀HCl反应的化学方程式。22. 为探究由三种短周期元素构成的化合物X(其中一种为金属元素)的组成和性质,某研究小组设计并完成了如下实验(步骤中所加试剂均过量)。
请回答下列问题:
(1)、组成X的三种元素是 , X的化学式是。(2)、X与足量NaOH溶液反应的化学方程式是。(3)、将溶液B加入到溶液A中会出现白色沉淀,该反应离子反应方程式为。(4)、常温下,将金属单质C投入到H2O2溶液中并加入少量稀H2SO4 , 观察到溶液变蓝色且一段时间后产生大量气泡,原因是。(5)、已知气体B中会混有另一物质C.请设计实验证明C的存在。23. A~G为中学常见的物质,其中A~F中含有同一种金属元素,各物质间有如下转化关系。其中B、G为地壳中含量排前两位的金属单质,D、F为碱,C、E为仅含两种元素的盐(部分条件已省略)。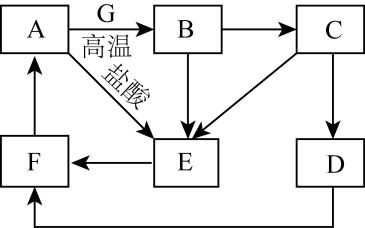
回答下列问题:
(1)、A的化学式为;E溶液的颜色为色。(2)、E转化为F的离子方程式为。(3)、在溶液中D转化为F的现象为。(4)、某同学在老师的指导下展开了延伸学习,配制480mLC溶液。①在配制C溶液时需加入少量铁屑,其目的是。
②在配制过程中,下列不正确操作会导致所配溶液浓度(填“偏高”“偏低”或“无影响”)
a、用托盘天平称量时,左盘放砝码,并且使用游码:;
b、烧杯和玻璃棒未洗涤:;
c、定容时俯视刻度线:。