2024年高考化学一轮复习:专题4氧化还原反应
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 下列离子方程式中正确的是( )A、溶液中滴加足量溶液: B、碳酸氢钘溶液与少量石灰水反应: C、溶液中滴加过量氨水: D、次氯酸钙溶液中通入少量2. 汽车剧烈碰撞时,安全气囊中发生反应 , 氧化剂是( )A、 B、 C、 D、3. Fe2+催化H2O2分解产生HO•,HO•将NO氧化为的机理如图所示,下列有关说法错误的是( )
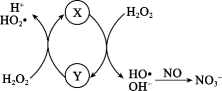 A、图中Y是Fe3+ , 是反应过程的中间产物 B、HO•将NO氧化为的方程式为:3HO•+NO+OH-=+2H2O C、若反应温度过高,NO的去除率可能下降 D、图中H2O2均表现强氧化性4. 氮循环是自然界中一种重要的物质循环方式。下列说法不正确的是( )
A、图中Y是Fe3+ , 是反应过程的中间产物 B、HO•将NO氧化为的方程式为:3HO•+NO+OH-=+2H2O C、若反应温度过高,NO的去除率可能下降 D、图中H2O2均表现强氧化性4. 氮循环是自然界中一种重要的物质循环方式。下列说法不正确的是( )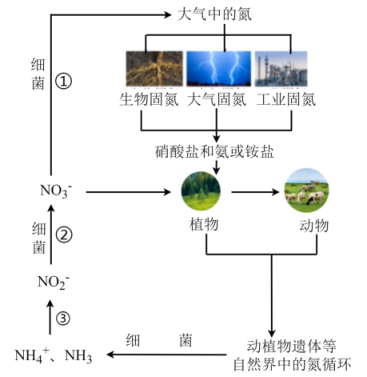 A、过程①中氮元素被还原 B、过程②③也属于氮的固定 C、过程③可能有氧气参与 D、含氮无机物和含氮有机物之间可以相互转化5. 制硫酸过程中有以下反应发生:4FeS+11O22Fe2O3+8SO2 , 下列说法正确的是( )A、FeS2既是氧化剂又是还原剂 B、还原剂与氧化剂的质量之比为4:11 C、SO2只是氧化产物 D、每消耗1.1mol氧气,反应中转移4.4 mol电子6. 酸性高锰酸钾溶液可用于测定室内空气甲醛含量,发生的反应为: , 将室内空气通入20 mL mol⋅L酸性溶液中,当通入10 L空气时,溶液恰好变为无色(假定空气中无其它还原性气体,甲醛可被溶液完全吸收),则室内空气中甲醛的浓度(单位:mg/L)为( )A、 B、 C、 D、7. 为阿伏加德罗常数的值,下列说法不正确的是( )A、18g的中含有的电子是10 B、个氧分子与个氢分子的质量比为16∶1 C、32g硫在足量的氧气中完全燃烧,转移电子数为4 D、质量为3.0g的和混合物中含有中子数为1.6
A、过程①中氮元素被还原 B、过程②③也属于氮的固定 C、过程③可能有氧气参与 D、含氮无机物和含氮有机物之间可以相互转化5. 制硫酸过程中有以下反应发生:4FeS+11O22Fe2O3+8SO2 , 下列说法正确的是( )A、FeS2既是氧化剂又是还原剂 B、还原剂与氧化剂的质量之比为4:11 C、SO2只是氧化产物 D、每消耗1.1mol氧气,反应中转移4.4 mol电子6. 酸性高锰酸钾溶液可用于测定室内空气甲醛含量,发生的反应为: , 将室内空气通入20 mL mol⋅L酸性溶液中,当通入10 L空气时,溶液恰好变为无色(假定空气中无其它还原性气体,甲醛可被溶液完全吸收),则室内空气中甲醛的浓度(单位:mg/L)为( )A、 B、 C、 D、7. 为阿伏加德罗常数的值,下列说法不正确的是( )A、18g的中含有的电子是10 B、个氧分子与个氢分子的质量比为16∶1 C、32g硫在足量的氧气中完全燃烧,转移电子数为4 D、质量为3.0g的和混合物中含有中子数为1.6二、多选题
-
8. 工业上从海水中制溴的步骤为:(I)先把盐卤加热到363K后控制pH为3.5,通入氯气把溴置换出来;(II)再用空气把溴吹出并用碳酸钠溶液吸收;(III)最后再用硫酸酸化,单质溴又从溶液中析出。其中,碳酸钠溶液吸收溴单质的反应可以分三步进行,其反应的机理如图所示。下列说法正确的是( )
第一步:

第二步:

第三步:
 A、1molH-O中含有的电子数为9NA B、第二步反应为Br2在OH-中歧化,产生Br-和BrO- C、当第(III)步产生1molBr2时则转移的电子数为2NA D、该反应机理说明BrO-的稳定性较差9. 一定条件下,与发生反应:。设为阿伏加德罗常数的值,下列说法正确的是( )A、分子中所含的质子总数为 B、常温常压下,每消耗 , 此时转移的电子数为 C、每生成 , 此时所得氧化产物的分子总数为 D、室温下,分子中所含的原子总数为10. 下列有关离子方程式的书写正确的是( )A、用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH+SO+H2O B、将Na加入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ C、NO2通入水中制硝酸:2NO2+H2O=2H++NO+NO D、稀硫酸滴入Na2S2O3溶液中:2H++S2O=SO2↑+S↓+H2O11. 将1.76g铜镁合金完全溶解于50mL某浓度的硝酸中,得到和NO的混合气体1120mL(标准状况),当向反应后的溶液中加入溶液时,金属离子全部转化为沉淀,测得沉淀的质量为3.12g。下列说法正确的是( )A、该合金中铜与镁的物质的量之比是1∶1 B、该硝酸中的物质的量浓度是10.8 mol/L C、和NO的混合气体中,的体积分数是70% D、得到的和NO混合气体通入一定量O2后被水完全吸收,消耗O2的体积为448 mL
A、1molH-O中含有的电子数为9NA B、第二步反应为Br2在OH-中歧化,产生Br-和BrO- C、当第(III)步产生1molBr2时则转移的电子数为2NA D、该反应机理说明BrO-的稳定性较差9. 一定条件下,与发生反应:。设为阿伏加德罗常数的值,下列说法正确的是( )A、分子中所含的质子总数为 B、常温常压下,每消耗 , 此时转移的电子数为 C、每生成 , 此时所得氧化产物的分子总数为 D、室温下,分子中所含的原子总数为10. 下列有关离子方程式的书写正确的是( )A、用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2=2NH+SO+H2O B、将Na加入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ C、NO2通入水中制硝酸:2NO2+H2O=2H++NO+NO D、稀硫酸滴入Na2S2O3溶液中:2H++S2O=SO2↑+S↓+H2O11. 将1.76g铜镁合金完全溶解于50mL某浓度的硝酸中,得到和NO的混合气体1120mL(标准状况),当向反应后的溶液中加入溶液时,金属离子全部转化为沉淀,测得沉淀的质量为3.12g。下列说法正确的是( )A、该合金中铜与镁的物质的量之比是1∶1 B、该硝酸中的物质的量浓度是10.8 mol/L C、和NO的混合气体中,的体积分数是70% D、得到的和NO混合气体通入一定量O2后被水完全吸收,消耗O2的体积为448 mL三、非选择题
-
12.(1)、实验室制取氯气反应的化学方程式为:;
①在该反应中,氧化剂与还原剂的物质的量之比是;
②若在反应中生成了标况下2.24L氯气,则电子转移的个数是NA。
(2)、氯酸钾和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O①用双线桥表示上述反应中电子转移的方向和数目;
②浓盐酸在该反应中表现的性质是(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是(填化学式);
④上述反应产生0.1molCl2时,转移电子的物质的量为。
13. 实验室制的化学方程式为。(1)、作氧化剂的物质是 , 锰元素的化合价(填“升高”或“降低”)。(2)、反应中每生成1mol , 消耗的物质的量是mol,转移电子的物质的量是mol。14. 实验室用浓盐酸和MnO2制Cl2 , 并以干燥 Cl2为原料进行实验,装置如下图所示。回答下列问题:
Cl2为原料进行实验,装置如下图所示。回答下列问题:  (1)、装置B中盛放的试剂是 , 图中盛放碱石灰的仪器是;从A装置导出的气体若不经过B、C装置而直接进入D管,产生的安全隐患是。(2)、实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,分别写出A中反应的化学方程式:A , 氧化剂和还原剂的物质的量之比 。(3)、F装置所起的作用是。(4)、已知KMnO4与浓盐酸在常温下反应就可制取氯气,写出该反应的离子方程式然后用单线桥标出电子转移的情况: , 当生成标准状况下44.8L Cl2时对应转移的电子数为。15. 在制备NiOOH的某种工艺流程,所得NiOOH常会混有 , 其组成可表示为。现称取10.14g样品溶于稀硫酸,加入100mL 1.0000 标准溶液,搅拌至溶液清亮,定容至200mL。取出20.00mL,用0.0100 标准溶液滴定,用去标准溶液20.00mL,请通过计算确定x:y的值并写出计算过程。涉及反应如下:16. 硫代硫酸钠(Na2S2O3)是常用的还原剂。在一定体积的某维生素C(化学式C6H8O6)溶液中加入a mol·L-1I2溶液V1 mL,使维生素C完全氧化,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b mol·L-1 Na2S2O3溶液V2 mL。
(1)、装置B中盛放的试剂是 , 图中盛放碱石灰的仪器是;从A装置导出的气体若不经过B、C装置而直接进入D管,产生的安全隐患是。(2)、实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,分别写出A中反应的化学方程式:A , 氧化剂和还原剂的物质的量之比 。(3)、F装置所起的作用是。(4)、已知KMnO4与浓盐酸在常温下反应就可制取氯气,写出该反应的离子方程式然后用单线桥标出电子转移的情况: , 当生成标准状况下44.8L Cl2时对应转移的电子数为。15. 在制备NiOOH的某种工艺流程,所得NiOOH常会混有 , 其组成可表示为。现称取10.14g样品溶于稀硫酸,加入100mL 1.0000 标准溶液,搅拌至溶液清亮,定容至200mL。取出20.00mL,用0.0100 标准溶液滴定,用去标准溶液20.00mL,请通过计算确定x:y的值并写出计算过程。涉及反应如下:16. 硫代硫酸钠(Na2S2O3)是常用的还原剂。在一定体积的某维生素C(化学式C6H8O6)溶液中加入a mol·L-1I2溶液V1 mL,使维生素C完全氧化,充分反应后,用Na2S2O3溶液滴定剩余的I2 , 消耗b mol·L-1 Na2S2O3溶液V2 mL。已知发生的反应为:C6H8O6+I2=C6H6O6+2H++2I- , 2S2O32-+I2=S4O62-+2I-
该溶液中维生素C的物质的量是多少mol?(写出简要的计算过程)。
17. 在标况下,将128g铜投入到足量的浓硝酸溶液中,求生成气体的体积.18. 资料显示,可以将氧化为。某小组同学设计实验探究被氧化的产物及铜元素的价态。已知:易溶于溶液,发生反应红棕色;和氧化性几乎相同。
(1)、将等体积的溶液加入到铜粉和的固体混合物中,振荡。实验记录如下:
实验现象
实验Ⅰ
极少量溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色
实验Ⅱ
部分溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色
实验Ⅲ
完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色
初始阶段,被氧化的反应速率:实验Ⅰ填“”“”或“”实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有蓝色或无色 , 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入 , 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤的目的是。
查阅资料, , 无色容易被空气氧化。用离子方程式解释步骤的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 , 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓溶液,填实验现象 , 观察到少量红色的铜。分析铜未完全反应的原因是。
(2)、上述实验结果,仅将氧化为价。在隔绝空气的条件下进行电化学实验,证实了能将氧化为。装置如图所示,分别是。 (3)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。19. 硅的提纯是电子工业一项十分重要的工作,可用粗硅与干燥的气体反应制(其中含有、),与过量在反应制得纯硅。有关物质的物理常数见下表:
(3)、运用氧化还原反应规律,分析在上述实验中被氧化的产物中价态不同的原因:。19. 硅的提纯是电子工业一项十分重要的工作,可用粗硅与干燥的气体反应制(其中含有、),与过量在反应制得纯硅。有关物质的物理常数见下表:物质
沸点/
57.7
12.8
33.0
熔点/
回答下列问题:
(1)、基态原子核外电子共有种运动状态;粗硅与反应完全后的混合物冷却到标准状况,可通过(填写操作名称)提纯得到。(2)、已知在有存在的条件下,硅可以和浓硝酸反应生成六氟合硅酸 , 该反应的化学方程式为。(3)、实验室可以采用如图装置(夹持、尾气处理装置及部分加热装置均略去)用与过量干燥反应制取纯硅。
①仪器a的名称为 , 装置B中的试剂为。
②将装置C水浴加热,该加热方式的优点是。
③为保证实验安全,加热装置D前必须完成的操作是:ⅰ.检验装置的气密性;ⅱ. , 该装置中发生反应的化学方程式为。
20. 某小组通过实验探究氧化还原反应的规律。已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
物质
H2O2
H2O2(酸化)
FeCl3
KMnO4(酸化)
NaNO3(酸化)
NaBr
KI
Na2S
浓度
5%
5%
0.1mol•L-1
电位值/mV
276
683
671
1130
603
362
116
-361
根据表中数据,回答下列问题:
(1)、浓度均为0.1mol•L-1的下列三种溶液,氧化性由强到弱的顺序为(填序号)。①FeCl3 ②酸性KMnO4 ③酸性NaNO3
(2)、影响物质氧化性强弱的因素有、。(3)、已知Fe3+与I-不能共存,由此推测下列一定不能大量共存的离子组是。a.Fe3+、Br- b.Fe3+、S2- c.NO、H+、I- d.H+、MnO、I-
(4)、向等浓度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,发生反应的离子方程式为。(已知MnO在酸性环境下的产物为Mn2+)(5)、往淀粉-KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。猜想1:_▲_。
猜想2:I2被氯水继续氧化
查阅资料:HClO不能漂白淀粉与I2结合形成的蓝色物质。
序号
实验操作
试剂
现象
结论
1
分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象
a
_▲_
猜想1不正确
2
淀粉溶液
溶液不变蓝
猜想2正确(I2被氧化为IO)
3
b+稀H2SO4
溶液变蓝
①猜想1为 , 实验1所用试剂a为 , 实验1的现象为。
②实验3所用试剂b是一种可溶性含碘化合物,该反应的离子方程式为。
21. 钠及其化合物在生产和生活中有广泛的应用。钠钾合金可用作核反应堆的传热介质。钠钾合金溶于水,生成氢气的(在标准状况下)体积为;(1)、该过程中转移的电子数目为个。(2)、确定该钠钾合金的组成(用的形式表示):。(3)、如果所得溶液的体积仍为 , 则溶液中的物质的量浓度为。22. 硝酸铈铵[(NH4)2Ce(NO3)6]为橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作氧化剂和分析试剂;二氧化铈(CeO2)为白色或黄白色固体,难溶于水,有强氧化性,主要用于玻璃、催化剂、电子管等工业。(NH4)2Ce(NO3)6和CeO2均是常见的强氧化剂,可用Ce2(CO3)3(难溶于水)为原料进行制取。 (1)、碳酸铈可溶于硝酸中,写出酸溶1的离子方程式:。(2)、“沉淀1”时,溶液中Ce(NO3)3转化为Ce(OH)3(HO2)沉淀。写出沉淀1反应的化学方程式:。(3)、“酸溶2”时,控制反应温度为80℃,硝酸与Ce(OH)3(HO2)分解产生的Ce(OH)4反应生成H2Ce(NO3)6 , 反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,原因是。(4)、“沉淀2”时,控制其他条件一定,改变加入NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉淀的收率如图1所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入n(NH4NO3)∶n(Ce)=4∶1的目的是。
(1)、碳酸铈可溶于硝酸中,写出酸溶1的离子方程式:。(2)、“沉淀1”时,溶液中Ce(NO3)3转化为Ce(OH)3(HO2)沉淀。写出沉淀1反应的化学方程式:。(3)、“酸溶2”时,控制反应温度为80℃,硝酸与Ce(OH)3(HO2)分解产生的Ce(OH)4反应生成H2Ce(NO3)6 , 反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,原因是。(4)、“沉淀2”时,控制其他条件一定,改变加入NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉淀的收率如图1所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入n(NH4NO3)∶n(Ce)=4∶1的目的是。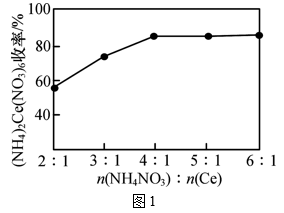 (5)、已知:4Ce(OH)3(白色沉淀)+O2+2H2O=4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如图2所示。实验小组以Ce2(CO3)3为原料制取CeO2 , 请设计实验方案:将Ce2(CO3)3完全溶解于盐酸中, , 得CeO2固体。[须选用的试剂和仪器:2mol·L-1氨水、O2、1mol·L-1HNO3、1mol·L-1AgNO3溶液、马弗炉(可用于固体的高温加热)]
(5)、已知:4Ce(OH)3(白色沉淀)+O2+2H2O=4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如图2所示。实验小组以Ce2(CO3)3为原料制取CeO2 , 请设计实验方案:将Ce2(CO3)3完全溶解于盐酸中, , 得CeO2固体。[须选用的试剂和仪器:2mol·L-1氨水、O2、1mol·L-1HNO3、1mol·L-1AgNO3溶液、马弗炉(可用于固体的高温加热)]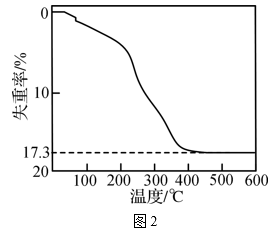 23. 化合物X由三种元素组成,某学习小组按如下流程进行实验:
23. 化合物X由三种元素组成,某学习小组按如下流程进行实验:
已知:黄褐色固体A的式量小于100,溶液C是单一溶质盐溶液。
(1)、X的组成元素是 , X的化学式是。(2)、写出B溶液与溶液恰好完全沉淀时的离子反应方程式:。(3)、固体A是一种良好的脱硫剂,请写出常温下固体A在氛围中与反应的化学反应方程式:。(4)、设计实验检验溶液B中的阳离子:。24. 随着原子序数的递增,8种短周期元素原子半径的相对大小、最高正化合价或最低负化合价如图所示。请用相应的化学用语回答下列问题: (1)、元素F在元素周期表中的位置是。(2)、元素D、G的简单气态氢化物中,热稳定性较差的是(填化学式)。元素G、H的最高价氧化物的水化物中,酸性较强的是。(填化学式)(3)、化合物BD2所含的化学键类型是。由固态变为气态克服的微粒间作用力是。(4)、化合物E3C遇水反应生成氨气(NH3)和一种强碱,反应的化学方程式为 , 氮气(NH3)的电子式为。25. 丙烯酸乙酯是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成该物质的路线如图所示。
(1)、元素F在元素周期表中的位置是。(2)、元素D、G的简单气态氢化物中,热稳定性较差的是(填化学式)。元素G、H的最高价氧化物的水化物中,酸性较强的是。(填化学式)(3)、化合物BD2所含的化学键类型是。由固态变为气态克服的微粒间作用力是。(4)、化合物E3C遇水反应生成氨气(NH3)和一种强碱,反应的化学方程式为 , 氮气(NH3)的电子式为。25. 丙烯酸乙酯是一种食用香料,用乙烯、丙烯等石油化工产品为原料合成该物质的路线如图所示。
回答下列问题:
(1)、关于CH2=CH2 , 下列说法正确的是____。A、CH2=CH2中碳原子采用sp2杂化 B、CH2=CH2能使酸性高锰酸钾溶液褪色,发生氧化反应 C、使用酸性高锰酸钾溶液可以除去甲烷中混有的乙烯,得到纯净的甲烷 D、乙烯和聚乙烯均可发生加成反应(2)、CH2=CHCH3中,最多个原子共平面;化合物D中所含官能团的名称为、。(3)、反应①的化学方程式为。(4)、分子式为C5H12O的醇类同分异构体有种,其中核磁共振氢谱为三组峰的结构简式为。(5)、丙烯酸乙酯一定条件下会发生加聚反应,生成的聚合物有较好的弹性,可用于生产织物。该加聚反应的化学方程式为。