2024年高考化学一轮复习:专题2物质的组成、结构和性质的关系
试卷更新日期:2023-08-30 类型:一轮复习
一、选择题
-
1. 下列物质间的反应,反应物的用量或浓度不会影响生成物的是( )A、NaHCO3和Ca(OH)2 B、Al2O3和NaOH溶液 C、Fe和稀HNO3 D、CO2和NaOH溶液2. 民以食为天,《黄帝内经》说:“五谷为养,五果为助,五畜为益,五菜为充”。列说法正确的是( )A、“五畜”富含油脂和蛋白质,它们都是天然高分子化合物 B、“五果”富含糖类,其中的葡萄糖、蔗糖都能发生水解反应 C、“五谷”富含淀粉,淀粉是天然高分子化合物 D、“五菜”富含纤维素,纤维素能为人体提供能量3. 不断进步的材料逐渐构筑了我们现代社会的文明。下列说法错误的是( )A、“唐三彩”和景德镇瓷器的主要化学成分都是硅酸盐 B、玻璃是一种常见的无机非金属材料,在一定温度下软化可制得玻璃仪器 C、塑料、合成纤维、合成橡胶属于合成有机高分子材料 D、以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化4. 下列说法错误的是( )A、海水淡化的主要方法有蒸馏法、反渗透法和电渗析法 B、工业上可通过电解溶液的方法获得镁单质 C、石油的分馏是物理变化,而煤的干馏主要是化学变化 D、通过石油的裂化和裂解可以得到乙烯、丙烯等化工原料5. 短周期元素X、Y、Z、W在元素周期表中的位置关系如图,若Y原子的最外层电子数是内层电子数的3倍,则下列说法正确的是( )
X
Y
Z
W
A、原子半径:r(W)>r(Z)>r(Y)>r(X) B、四种元素的常见单质中,Z单质的熔、沸点最高 C、最高价氧化物对应水化物的酸性:Z>W>X D、W的简单阴离子的还原性强于Z的简单阴离子的还原性6. 下列说法不正确的是( )A、屠呦呦因发现抗疟疾青蒿素,而获得诺贝尔生理学或医学奖 B、英国科学家道尔顿提出原子学说,为近代化学的发展奠定了基础 C、俄国科学家门捷列夫发现了元素周期律,使得化学的研究有规律可循 D、戴维发现一种黄绿色气体,舍勒确定该气体为氯气二、多选题
-
7. 下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、8. 固体化合物X由3种元素组成。某学习小组进行了如下实验。下列推断错误的是( )
 A、由现象1得出化合物X含有氢元素 B、固体混合物Y的成分是Cu和KOH C、的化学式Cu D、若X与浓盐酸反应产生黄绿色气体,则反应中X作氧化剂9. “铬鞣制法”可以使皮革变的柔软和耐用,为检测皮革中的含量,可以采取碘量法测定,过程如下:
A、由现象1得出化合物X含有氢元素 B、固体混合物Y的成分是Cu和KOH C、的化学式Cu D、若X与浓盐酸反应产生黄绿色气体,则反应中X作氧化剂9. “铬鞣制法”可以使皮革变的柔软和耐用,为检测皮革中的含量,可以采取碘量法测定,过程如下:①高温熔融:
②酸化:
③加碘化钾滴定:、
若皮革样品质量为 , 滴定过程共消耗的。下列说法正确的是( )
A、反应①中氧化剂与还原剂的物质的量比为5∶1 B、元素参与了3个氧化还原过程 C、实验过程中,所得与的物质的量比可能大于5∶2 D、皮革中的含量为10. 宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料[主要成分],青色来自蓝铜矿[主要成分]。下列说法正确的是( )A、孔雀石、蓝铜矿颜料在空气中性质稳定 B、孔雀石、蓝铜矿颜料耐酸耐碱 C、与都是难溶于水的非电解质 D、保存《千里江山图》需控制温度和湿度三、非选择题
-
11. 补齐物质与其用途之间的连线。
物质
用途
A.碳酸氢钠
a.作膨松剂
B.浓硫酸
b.作制冷剂
C.液氨
c.作红色涂料
D.氧化铁
E.过氧化钠
d.作供氧剂
e.作干燥剂
12. 补齐物质与其用途之间的连线。物质
用途
A.铝
a.制合金
B.过氧化钠
b.作供氧剂
C.碳酸氢钠
c.作红色颜料
D.氧化铁
d.作食用碱
13. 补齐物质与其用途的连线。物质 用途
A.过氧化钠 a.做红色颜料
B.食盐 b.做调味品
C.氧化铁 c.用于烘焙糕点
D.碳酸氢钠 d.用于供氧剂
D→c,A→ , B→ , C→。
14. 红矶钠是重要的化工原料,工业上以铬铁矿( , 含少量、)为主要原料制备红矾钠的工艺流程如下: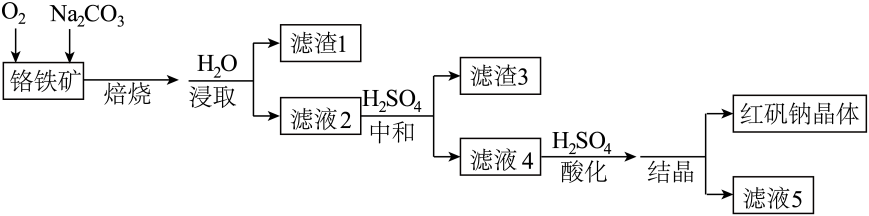
已知:i. ii.
回答下列问题:
(1)、焙烧铬铁矿生成 , 并将和转化为可溶性钠盐。①焙烧时为加快反应速率,可采取的措施是。
②生成的化学方程式如下,将其补充完整:。
□+□□_+□+□
(2)、滤液2中含有的溶质有:、。(3)、中和时的理论范围为4.5~9.3,调控不过高也不能过低的理由。(4)、酸化后所得溶液中主要含有和。
①结晶时,将混合溶液加热浓缩、(填操作)、冷却结晶、过滤得到红矾钠晶体。
②滤液5最适宜返回上述流程中,参与循环再利用。
(5)、工业上还可用膜电解技术(装置如图所示),以为主要原料制备 , 结合化学用语简述制备的原理:。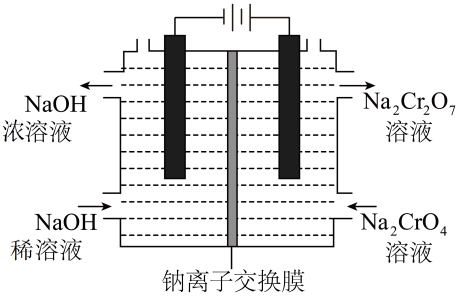 (6)、 可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要的质量)。现有某水样 , 酸化后加入的溶液 , 使水样中的还原性物质完全被氧化;再用的溶液滴定剩余的 , 消耗溶液 , 则该水样的为。【被还原为;换算关系:】15. 某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品 , 在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重和。试求该有机物的实验式和分子式。16. 粗ZnS中的S2-的含量可以用“碘量法”测得。准确称取0.150g样品,置于碘量瓶中,移取25.00mL0.1000mo/L的I2—KI溶液于其中,并加入乙酸溶液,密闭,置于暗处充分反应5min,硫元素完全转化为单质硫析出。以淀粉为指示剂,过量的I2用0.1000mol/LNa2S2O3溶液滴定,反应式为I2+2S2O =2I-+S4O 。测定时,消耗Na2S2O3溶液体积24.00mL。请计算样品中S2-的含量为__(计算结果保留三位有效数字,写出计算过程)。17. 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
(6)、 可用于测定水体的COD(COD是指每升水样中还原性物质被氧化所需要的质量)。现有某水样 , 酸化后加入的溶液 , 使水样中的还原性物质完全被氧化;再用的溶液滴定剩余的 , 消耗溶液 , 则该水样的为。【被还原为;换算关系:】15. 某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品 , 在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重和。试求该有机物的实验式和分子式。16. 粗ZnS中的S2-的含量可以用“碘量法”测得。准确称取0.150g样品,置于碘量瓶中,移取25.00mL0.1000mo/L的I2—KI溶液于其中,并加入乙酸溶液,密闭,置于暗处充分反应5min,硫元素完全转化为单质硫析出。以淀粉为指示剂,过量的I2用0.1000mol/LNa2S2O3溶液滴定,反应式为I2+2S2O =2I-+S4O 。测定时,消耗Na2S2O3溶液体积24.00mL。请计算样品中S2-的含量为__(计算结果保留三位有效数字,写出计算过程)。17. 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4 , 加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)、N、O、H三种元素的第一电离能由大到小的顺序为(用元素符号表示)(2)、步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是(3)、关于步骤五中的一系列操作的相关表述,错误的是____(填字母)。A、过滤时可使用玻璃棒搅拌的方式来缩短时间 B、过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 C、洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 D、所得的产品可以采取电热炉烘干的方式彻底干燥(4)、II.硫酸亚铁铵的分解已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

B装置的作用是
(5)、实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式;若去掉C,是否能得出同样结论,并解释其原因。(6)、A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。实验步骤
预期现象
结论
①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解;
②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液
固体残留物仅为Fe2O3
18. 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。
 (1)、A中发生反应的化学方程式为。(2)、C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为 , 反应中KOH必须过量的原因是。(3)、写出C中总反应的离子方程式:。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。(4)、Ⅱ.K2FeO4产品纯度的测定
(1)、A中发生反应的化学方程式为。(2)、C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为 , 反应中KOH必须过量的原因是。(3)、写出C中总反应的离子方程式:。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。(4)、Ⅱ.K2FeO4产品纯度的测定准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O , 滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
根据以上数据,样品中K2FeO4的质量分数为。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果(填“偏高”“偏低”或“无影响”)。
19. 石墨烯铜复合材料的电导率高,韧性好,可用于制备高铁的“超级导线”。某化学小组用如下装置测定其中的碳含量(铜、碳以外的成分不与浓硫酸反应)。已知:实验前后,各通入一次 , 将装置中的气体全部赶入到U型管中。 (1)、仪器B的名称为 , 装置D中的试剂为;(2)、碳与浓硫酸反应的化学方程式为;(3)、装置E和F中碱石灰的作用为;(4)、实验结束后,U型管(E)增重 , 则碳含量为;(5)、若撤去D,则实验测定的结果(填“偏高”“偏低”或“无影响”)。20. 某化合物X由三种元素组成,某兴趣小组开展探究实验(每一步反应均充分进行)
(1)、仪器B的名称为 , 装置D中的试剂为;(2)、碳与浓硫酸反应的化学方程式为;(3)、装置E和F中碱石灰的作用为;(4)、实验结束后,U型管(E)增重 , 则碳含量为;(5)、若撤去D,则实验测定的结果(填“偏高”“偏低”或“无影响”)。20. 某化合物X由三种元素组成,某兴趣小组开展探究实验(每一步反应均充分进行)
已知:气体B能使湿润的红色石蕊试纸变蓝
(1)、气体B的结构式;化合物X的组成元素。(2)、写出溶液A→沉淀D反应的离子方程式。(3)、写出化合物X与足量NaOH反应的化学方程式。(4)、将沉淀C溶于稀硫酸中,请设计实验方案检验所得溶液中的金属阳离子。21. 以废铜渣(主要成分Cu、CuO,及少量和铁的氧化物)为原料制备并测定其组成的部分过程如下: (1)、浸取。向废铜渣中加入一定量和稀硫酸,充分反应。
(1)、浸取。向废铜渣中加入一定量和稀硫酸,充分反应。①基态的核外电子排布式为。
②Cu转化为的离子方程式是。
③该步骤中实际用量超过理论用量的原因是。
(2)、除铁。向浸取后所得溶液中加入一定量 , 有黄色沉淀生成,该沉淀颗粒大、易沉降。①该反应的离子方程式为。
②通过调节溶液的pH使生成沉淀也可达到除铁的目的。加入“除铁”的优点是。
(3)、测定。为测定的组成,进行如下实验:步骤1:称取3.540 g样品,加水溶解配成100.00 mL溶液A,取20.00 mL溶液A,加入一定量稀硫酸酸化后,用标准溶液滴定至终点,共用去标准溶液标准溶液16.00 mL。
步骤2:向步骤1滴定后所得溶液中加入过量KI溶液,充分反应。加入淀粉指示剂,用 标准溶液滴定至终点,共用去标准溶液20.00 mL。
实验过程中发生如下反应:
通过计算确定该样品的化学式(写出计算过程)。
22. 磁性材料X()为化合物,由2种元素组成,某学习小组开展如图探究实验。
其中,无色气体C能使湿润的红色石蕊试纸变蓝,流程中所用到的试剂均过量。
请回答:
(1)、沉淀D的化学式是 , 溶液B中含有的溶质是(用化学式表示)。(2)、化合物X的化学式是。(3)、气体C通入溶液生成白色沉淀F的离子方程式为。(4)、请写出X和稀盐酸反应生成A和B的化学方程式。(5)、请用化学方法设计实验验证B溶液中的金属阳离子。23. 固体化合物由三种元素组成。某学习小组开展如下探究实验:
请回答:
(1)、组成的元素有 , 的化学式为。(2)、化合物X可以由对应金属的某种盐溶液在精准控制和加热一定的温度下制得,请写出相应的方程式。(3)、固体能溶于的水溶液,产物中含一种正八面体的负三价阴离子,写出其相应的离子方程式。(4)、现已确认红褐色固体B中只含有一种金属元素,请设计实验进一步验证红褐色固体B中所含金属离子。