浙江省杭州市2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-08-16 类型:期末考试
一、单选题
-
1. 下列物质属于碱性氧化物是( )A、SiO2 B、NO C、Na2O D、Al2O32. 铁及其化合物应用广泛,下列说法不正确的是( )A、FeCl3溶液作为制作电路板的腐蚀液 B、在酱油中加入铁强化剂,可以减少缺铁性贫血问题的发生 C、氧化铁常用作油漆、涂料的红色原料 D、合金钢的用途广泛,它只含Fe、C两种元素3. 下列化学用语表示正确的是( )A、H2O2的电子式: B、轨道的电子云轮廓图:
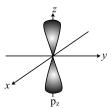 C、2—丁烯的结构简式:
D、CO2的空间填充模型:
C、2—丁烯的结构简式:
D、CO2的空间填充模型: 4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、液氨汽化需要吸收大量的热,可用作制冷剂 B、具有强氧化性,可用作消毒剂 C、Na2CO3受热不分解,可用于去除油污 D、BaSO4不溶于酸和水,且不容易被X射线透过,可用作消化系统X射线检查的内服药剂5. 下列关于物质制备的说法不正确的是( )A、工业上可以用“吹出法”从海水提溴 B、工业上用电解氯化铝制备金属铝 C、工业上用98.3%的浓硫酸吸收SO3制备硫酸 D、工业生产中用H2还原SiHCl3制备高纯硅6. 火法炼铜的原理 , 下列说法正确的是( )A、—2价的S发生还原反应,生成了SO2 B、该反应中氧化剂只有O2 C、生成64 g Cu,转移电子的总数约为3×6.02×1023 D、为了提高铜的产率,O2应过量7. 下列反应的离子方程式正确的是( )A、向苯酚钠溶液中通入少量
4. 物质的性质决定用途,下列两者对应关系不正确的是( )A、液氨汽化需要吸收大量的热,可用作制冷剂 B、具有强氧化性,可用作消毒剂 C、Na2CO3受热不分解,可用于去除油污 D、BaSO4不溶于酸和水,且不容易被X射线透过,可用作消化系统X射线检查的内服药剂5. 下列关于物质制备的说法不正确的是( )A、工业上可以用“吹出法”从海水提溴 B、工业上用电解氯化铝制备金属铝 C、工业上用98.3%的浓硫酸吸收SO3制备硫酸 D、工业生产中用H2还原SiHCl3制备高纯硅6. 火法炼铜的原理 , 下列说法正确的是( )A、—2价的S发生还原反应,生成了SO2 B、该反应中氧化剂只有O2 C、生成64 g Cu,转移电子的总数约为3×6.02×1023 D、为了提高铜的产率,O2应过量7. 下列反应的离子方程式正确的是( )A、向苯酚钠溶液中通入少量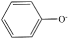
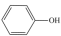 B、向氯化二氨合银溶液中加硝酸:
C、硫酸铵溶液和氢氧化钡溶液反应:
D、向烧碱溶液中加入一小段铝片:
8. 下列说法不正确的是( )A、向鸡蛋清溶液加入饱和硫酸铵溶液产生沉淀,再加水沉淀不溶解 B、核酸是由磷酸、戊糖、碱基通过一定方式形成的生物大分子 C、油脂在碱性条件下可发生皂化反应 D、淀粉不能被氢氧化铜氧化,是非还原性糖9. 对乙酰氨基酚结构如图,它微溶于乙醚和热水,几乎不溶于冷水,用于治疗感冒发热、关节痛、神经痛及偏头痛、癌性痛及手术后止痛。下列说法不正确的是 ( )
B、向氯化二氨合银溶液中加硝酸:
C、硫酸铵溶液和氢氧化钡溶液反应:
D、向烧碱溶液中加入一小段铝片:
8. 下列说法不正确的是( )A、向鸡蛋清溶液加入饱和硫酸铵溶液产生沉淀,再加水沉淀不溶解 B、核酸是由磷酸、戊糖、碱基通过一定方式形成的生物大分子 C、油脂在碱性条件下可发生皂化反应 D、淀粉不能被氢氧化铜氧化,是非还原性糖9. 对乙酰氨基酚结构如图,它微溶于乙醚和热水,几乎不溶于冷水,用于治疗感冒发热、关节痛、神经痛及偏头痛、癌性痛及手术后止痛。下列说法不正确的是 ( ) A、该分子能形成分子间氢键 B、该分子中存在2种官能团 C、1 mol该物质与足量NaOH溶液反应,最多消耗1 mol NaOH D、分子中的C原子有sp2和sp3两种杂化方式10. 科学家发现对LiTFSI一种亲水有机盐进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。LiTFSI的结构如图2,A、B、C、D为同一周期的短周期元素,C与E位于同一主族。下列说法正确的是 ( )
A、该分子能形成分子间氢键 B、该分子中存在2种官能团 C、1 mol该物质与足量NaOH溶液反应,最多消耗1 mol NaOH D、分子中的C原子有sp2和sp3两种杂化方式10. 科学家发现对LiTFSI一种亲水有机盐进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。LiTFSI的结构如图2,A、B、C、D为同一周期的短周期元素,C与E位于同一主族。下列说法正确的是 ( )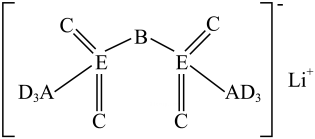 A、元素A、D形成的分子中一定不含非极性键 B、第一电离能:B>C>A C、电负性:D>E>C D、简单气态氢化物的稳定性:E>D11. 某全固态薄膜锂离子电池截面结构如图3,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料,同时电极B中失电子转化为 , 集流体起导电作用。下列说法不正确的是 ( )
A、元素A、D形成的分子中一定不含非极性键 B、第一电离能:B>C>A C、电负性:D>E>C D、简单气态氢化物的稳定性:E>D11. 某全固态薄膜锂离子电池截面结构如图3,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料,同时电极B中失电子转化为 , 集流体起导电作用。下列说法不正确的是 ( ) A、充电时,集流体A与外接电源的负极相连 B、放电时,电极B为正极,反应可表示为 C、放电时,外电路通过a mol电子,内电路中有a mol Li+通过LiPON薄膜电解质从正极迁移到负极 D、导电介质不可能为溶液12. 强酸可由如下反应制备,。下列说法正确的是( )A、的电子式为
A、充电时,集流体A与外接电源的负极相连 B、放电时,电极B为正极,反应可表示为 C、放电时,外电路通过a mol电子,内电路中有a mol Li+通过LiPON薄膜电解质从正极迁移到负极 D、导电介质不可能为溶液12. 强酸可由如下反应制备,。下列说法正确的是( )A、的电子式为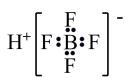 B、相同条件下,酸性弱于HF
C、BF3的空间结构是三角锥形
D、中含有配位键
13. 室温下,向1.00L0.100mol/LNH4HCO3溶液中加入0.100mol/LNaOH溶液,溶液中主要型体的分布系数[如的分布系数]以及pH随变化如图,下列说法正确的是( )
B、相同条件下,酸性弱于HF
C、BF3的空间结构是三角锥形
D、中含有配位键
13. 室温下,向1.00L0.100mol/LNH4HCO3溶液中加入0.100mol/LNaOH溶液,溶液中主要型体的分布系数[如的分布系数]以及pH随变化如图,下列说法正确的是( ) A、溶液中 , 水的电离受到促进 B、当溶液pH=10时,约为0.1 C、 D、加入少量NaOH时,OH-先与发生反应14. 自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点。HNO自由基与O2反应过程的能量变化如图,下列说法不正确的是( )
A、溶液中 , 水的电离受到促进 B、当溶液pH=10时,约为0.1 C、 D、加入少量NaOH时,OH-先与发生反应14. 自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点。HNO自由基与O2反应过程的能量变化如图,下列说法不正确的是( ) A、反应物的键能总和小于生成物的键能总和 B、该历程中正反应的最大活化能是 C、产物P1、P2中,P1的稳定性更强 D、使用催化剂不能提高产物P2的平衡产率15. 已知:室温下,CaCO3的 , H2CO3的电离常数 , , HClO的电离常数。室温下,向60 mL蒸馏水加入1 g CaCO3 , 经过一段时间,迅速加入10 mL蒸馏水该操作重复多次 , 过程中电导率的变化如图,下列说法不正确的是( )
A、反应物的键能总和小于生成物的键能总和 B、该历程中正反应的最大活化能是 C、产物P1、P2中,P1的稳定性更强 D、使用催化剂不能提高产物P2的平衡产率15. 已知:室温下,CaCO3的 , H2CO3的电离常数 , , HClO的电离常数。室温下,向60 mL蒸馏水加入1 g CaCO3 , 经过一段时间,迅速加入10 mL蒸馏水该操作重复多次 , 过程中电导率的变化如图,下列说法不正确的是( )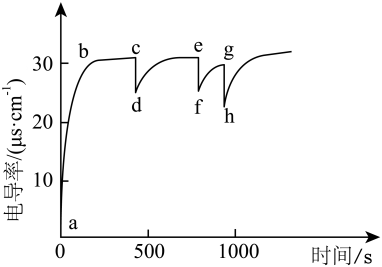 A、a→b:电导率上升是由于CaCO3固体溶解速率大于沉淀速率 B、c点溶液中Ca2+浓度接近 C、g→h:向饱和CaCO3溶液中迅速加入10 mL蒸馏水 D、向NaClO浓溶液通入少量CO2气体,溶液含碳微粒主要以的形式存在16. 下列方案设计、现象和结论均正确的是 ( )
A、a→b:电导率上升是由于CaCO3固体溶解速率大于沉淀速率 B、c点溶液中Ca2+浓度接近 C、g→h:向饱和CaCO3溶液中迅速加入10 mL蒸馏水 D、向NaClO浓溶液通入少量CO2气体,溶液含碳微粒主要以的形式存在16. 下列方案设计、现象和结论均正确的是 ( )目的
方案设计
现象和结论
A
比较Fe3+和I2的氧化性强弱
向含有淀粉的KI溶液中滴入溶液
溶液变蓝说明氧化性Fe3+>I2
B
比较AgCl和AgI的溶解度大小
向的AgNO3溶液中加入的NaCl溶液,再加入的NaI溶液
白色沉淀变为黄色沉淀说明AgCl的溶解度比AgI大
C
比较NH3、H2O与Cu2+的配位能力强弱
向的CuSO4溶液逐滴加入氨水
先产生蓝色沉淀,然后沉淀消失得到深蓝色的透明溶液说明NH3与Cu2+的配位能力比H2O与Cu2+的配位能力强
D
探究基团之间的相互影响
标号1、2试管分别装有3 mL的甲基环己烷、甲苯,分别滴加3滴酸性高锰酸钾溶液,振荡
试管1溶液的紫色不褪去,试管2溶液的紫色褪去说明苯环使甲基活化,甲基易被氧化
A、A B、B C、C D、D二、结构与性质
-
17. 填空(1)、LiAlH4、NaBH4是有机合成中常用的还原剂。的空间结构的名称是 , NaBH4中Na+核外有种不同运动状态的电子。(2)、下列Li原子电子排布图表示的状态中,能量最低和最高的状态分别为、填标号。
A.
 B.
B.
C.
 D.
D. (3)、以NaAlH4为代表的金属络合物贮氢材料成为研发热点。NaAlH4晶体的晶胞如图,与紧邻且等距的Na+有个,该晶胞中含有Na+的数目为。
(3)、以NaAlH4为代表的金属络合物贮氢材料成为研发热点。NaAlH4晶体的晶胞如图,与紧邻且等距的Na+有个,该晶胞中含有Na+的数目为。
三、元素或物质推断题
-
18. 已知X是白色固体,焰色反应呈黄色,隔绝空气加热分解生成A、B、C三种物质物质的量均相等 , , Mx是X的摩尔质量,X、A、B所含元素种类相同,气体C能使品红褪色,气体E是一种纯净物,相对分子质量为34,实验流程如下部分产物已省略。
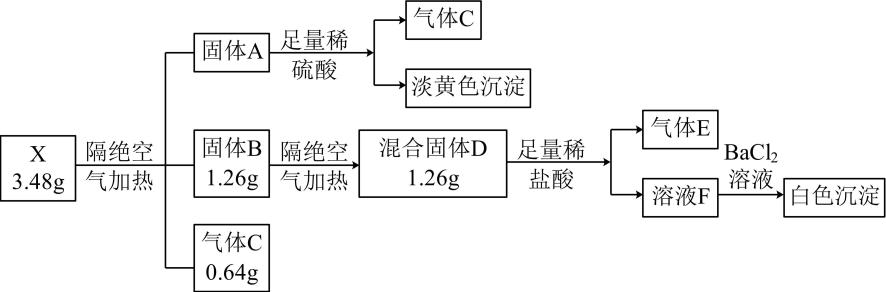 (1)、气体C的分子式 , X的化学式是。(2)、写出B→D反应的化学方程式。(3)、A可用作定影剂,除去照相底片上未曝光的AgBr,产物中银元素为二配位的配合物,写出AgBr溶于A溶液的离子方程式。(4)、设计实验方案检验气体E。
(1)、气体C的分子式 , X的化学式是。(2)、写出B→D反应的化学方程式。(3)、A可用作定影剂,除去照相底片上未曝光的AgBr,产物中银元素为二配位的配合物,写出AgBr溶于A溶液的离子方程式。(4)、设计实验方案检验气体E。四、原理综合题
-
19. 工业上可利用CO2来制备清洁液体燃料甲醇,有关化学反应如下:
反应①:
反应②:
反应③:
请回答:
I.
(1)、。(2)、反应①可通过反应②、反应③两个步骤实现,若反应②为慢反应、反应③为快反应,下列示意图能体现上述反应能量变化的是____填标号。A、 B、
B、 C、
C、 D、
D、 (3)、向恒温恒压0.1 MPa的密闭容器中充入1 mol CO2、1 mol H2、6 mol He选择合适催化剂按反应②进行,平衡时测得CO2的转化率为20%,则该反应的用分压代替平衡浓度计算,分压=总压×物质的量分数。(4)、Ⅱ.在CFBR催化下反应①受到反应限度的限制、存在竞争性逆水煤气变换反应反应②和水诱导催化剂失活等影响,导致CO2转化率和甲醇选择性都比较低。某科学团队研发一种具有反应、分离气态水的双功能的分子筛膜催化反应器CMR,提高CO2加氢制备甲醇的效率。
(3)、向恒温恒压0.1 MPa的密闭容器中充入1 mol CO2、1 mol H2、6 mol He选择合适催化剂按反应②进行,平衡时测得CO2的转化率为20%,则该反应的用分压代替平衡浓度计算,分压=总压×物质的量分数。(4)、Ⅱ.在CFBR催化下反应①受到反应限度的限制、存在竞争性逆水煤气变换反应反应②和水诱导催化剂失活等影响,导致CO2转化率和甲醇选择性都比较低。某科学团队研发一种具有反应、分离气态水的双功能的分子筛膜催化反应器CMR,提高CO2加氢制备甲醇的效率。保持一定压强,向密闭容器中投入一定量CO2和H2 , 只发生反应①②,不同反应模式下CO2的平衡转化率和甲醇选择性的实验数据如下表所示。甲醇的选择性
实验组
反应模式
压强/MPa
温度/℃
CO2转化率/%
CH3OH选择性/%
①
CFBR
3
5
250
25.6
61.3
②
CFBR
3
5
230
20.0
70.0
③
CFBR
3
3
260
21.9
67.3
④
CMR
3
3
260
36.1
100
下列说法正确的是____。
A、CFBR模式下,温度低有利于工业生产CH3OH B、CFBR模式下,在原料气中掺入适量CO,可以提高CH3OH的选择性 C、CMR模式下,适当增加压强,可以提高CO2的平衡转化率 D、CMR模式下,温度越高则反应速率越快(5)、由表中数据可知,CMR模式下CO2的平衡转化率显著提高,结合反应分析原因。五、实验题
-
20. 某学习小组利用Cl2和Na2CO3溶液反应生成Cl2O,再用水吸收Cl2O制备HClO溶液尾气处理装置没有画出。已知:①Cl2O是强氧化剂,极易溶于水,沸点为3.8℃,42℃以上分解为Cl2和O2 , 高浓度时易爆炸。②常温下 , 回答下列问题:
 (1)、装置C的名称为 , 装置A中生成氯气,写出反应的离子方程式。(2)、装置B中生成了Cl2O和CO2 , 各装置的连接顺序为→→→→C。(3)、实验需要向D中通入一定量的空气不参与反应,装置D的作用回答2点为;。(4)、实验时装置B用冰水浴冷却的原因是。(5)、测定装置E中HClO溶液浓度的实验方案:取20.00 mL的E溶液,加入稀硫酸酸化的V1mL、的FeSO4溶液,置于暗处静置、充分反应,再用7 , 标准溶液滴定多余的Fe2+至终点,消耗K2Cr2O7溶液V2mL已知此条件下不与Cl-反应,HClO浓度为。
(1)、装置C的名称为 , 装置A中生成氯气,写出反应的离子方程式。(2)、装置B中生成了Cl2O和CO2 , 各装置的连接顺序为→→→→C。(3)、实验需要向D中通入一定量的空气不参与反应,装置D的作用回答2点为;。(4)、实验时装置B用冰水浴冷却的原因是。(5)、测定装置E中HClO溶液浓度的实验方案:取20.00 mL的E溶液,加入稀硫酸酸化的V1mL、的FeSO4溶液,置于暗处静置、充分反应,再用7 , 标准溶液滴定多余的Fe2+至终点,消耗K2Cr2O7溶液V2mL已知此条件下不与Cl-反应,HClO浓度为。六、有机推断题
-
21. 某研究小组按下列路线合成药物氯吡格雷。

已知:
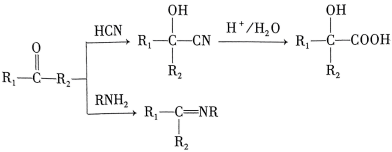
请回答:
(1)、化合物C的官能团名称是;化合物F的结构简式是。(2)、写出A→B的化学方程式。(3)、下列说法正确的是____。A、B→C的反应类型是还原反应 B、氯吡格雷存在手性异构体,能发生水解反应 C、G转化H时会生成副产物 D、化合物E的分子式为C5H9NS(4)、设计C→…→D的合成路线用流程图表示,简单有机物和无机试剂任选。(5)、写出同时符合下列条件的化合物G的同分异构体的结构简式。①含有苯环;
②1H-NMR谱表明分子中共有4种不同化学环境的氢原子。
-
-
-
-