四川省成都市蓉城名校联2022-2023学年高二下学期期末联考化学试题
试卷更新日期:2023-08-16 类型:期末考试
一、单选题
-
1. 化学与生活密切相关。下列说法错误的是( )A、家庭储备的药品过期后应作为有害垃圾处理 B、食品包装袋里的硅胶颗粒可防止食品氧化变质 C、家用苏打可用于洗涤厨房用具的油污 D、铝制餐具不能长时间存放酸性或碱性食物2. 下列化学用语表示正确的是( )A、用于考古断代的碳原子符号: B、用电子式表示NaCl的形成过程:
 C、乙酸乙酯的结构式:
C、乙酸乙酯的结构式: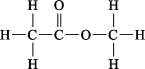 D、Ca2+的离子结构示意图:
D、Ca2+的离子结构示意图: 3. 下列说法正确的是( )A、能电离出H+的化合物就是酸,能电离出OH-的化合物就是碱 B、金属氧化物都是碱性氧化物,非金属氧化物都是酸性氧化物 C、能导电的物质不一定是电解质,电解质不一定能导电 D、能否产生丁达尔效应是溶液和胶体的本质区别4. 某无色溶液中,下列离子可大量共存的是( )A、K+、Ba2+、Cl-、 B、Cu2+、、Na+、Br- C、Mg2+、K+、、 D、H+、Ca2+、、I-5. 欲除去下列括号中的杂质,所选试剂正确的是( )A、CO2(HCl)——饱和Na2CO3溶液 B、CH4(C2H4)——酸性KMnO4溶液 C、Cl2(HCl)——饱和食盐水 D、NH3(H2O)——浓硫酸6. 为了环境保护,工厂烟气可经过下列工艺进行脱硫,则2S(g)=S2(g)的反应热ΔH为( )
3. 下列说法正确的是( )A、能电离出H+的化合物就是酸,能电离出OH-的化合物就是碱 B、金属氧化物都是碱性氧化物,非金属氧化物都是酸性氧化物 C、能导电的物质不一定是电解质,电解质不一定能导电 D、能否产生丁达尔效应是溶液和胶体的本质区别4. 某无色溶液中,下列离子可大量共存的是( )A、K+、Ba2+、Cl-、 B、Cu2+、、Na+、Br- C、Mg2+、K+、、 D、H+、Ca2+、、I-5. 欲除去下列括号中的杂质,所选试剂正确的是( )A、CO2(HCl)——饱和Na2CO3溶液 B、CH4(C2H4)——酸性KMnO4溶液 C、Cl2(HCl)——饱和食盐水 D、NH3(H2O)——浓硫酸6. 为了环境保护,工厂烟气可经过下列工艺进行脱硫,则2S(g)=S2(g)的反应热ΔH为( )①H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH1
②2H2S(g)+SO2(g)=S2(g)+2H2O(g) ΔH2
③H2S(g)+O2(g)=S(g)+H2O(g) ΔH3
A、ΔH1+ΔH2-ΔH3 B、ΔH1+ΔH2-2ΔH3 C、ΔH1-ΔH2+2ΔH3 D、ΔH1+ΔH2-ΔH37. 设NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温常压下,1.8gH2O含有NA个电子 B、1mol·L-1的CH3COONa溶液中,CH3COO-数目不一定小于NA C、一定条件下,1mol金属钠与足量O2反应,转移NA个电子 D、标准状况下,22.4LSO3含有NA个分子8. 下列物质间的反应,反应物的用量或浓度不会影响生成物的是( )A、NaHCO3和Ca(OH)2 B、Al2O3和NaOH溶液 C、Fe和稀HNO3 D、CO2和NaOH溶液9. 下列关于化学反应与能量的说法正确的是( )A、NH4Cl固体和Ba(OH)2·8H2O反应时,反应物的总键能小于生成物的总键能 B、已知H2(g)+I2(g)2HI(g) ΔH=-QkJ·mol-1 , 在一定条件下,向密闭容器中充入1molHI(g),反应达到平衡状态的过程中,吸收的热量为0.5QkJ C、已知甲烷的燃烧热为890.3kJ·mol-1 , 则1mol甲烷充分燃烧生成CO2和水蒸气放出的热量小于890.3kJ D、硫酸和盐酸分别与NaOH溶液反应的中和热数值之比为2:110. 下列离子方程式书写正确的是( )A、将少量CO2通入BaCl2溶液:CO2+Ba2++H2O=BaCO3↓+2H+ B、AlCl3溶液和氨水反应:Al3++3OH-=Al(OH)3↓ C、向NaClO溶液中通少量SO2:2ClO-+SO2+H2O=2HClO+ D、向盐酸中滴入少量Na2CO3溶液:+2H+=CO2↑+H2O11. 实验室可用如图所示的装置制备SO2并探究其性质。下列说法错误的是( ) A、A装置中的药品可替换成铜片和浓硫酸 B、B装置可作储气瓶和安全瓶 C、C装置中溶液变浑浊,说明SO2具有氧化性 D、E中可选用NaOH溶液除去尾气12. 某些中草药中含有的咖啡酸具有止血的疗效,其结构简式如图所示。下列说法错误的是( )
A、A装置中的药品可替换成铜片和浓硫酸 B、B装置可作储气瓶和安全瓶 C、C装置中溶液变浑浊,说明SO2具有氧化性 D、E中可选用NaOH溶液除去尾气12. 某些中草药中含有的咖啡酸具有止血的疗效,其结构简式如图所示。下列说法错误的是( )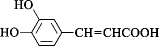 A、该分子中所有原子不可能都共面 B、该物质可发生加成反应、酯化反应、取代反应 C、1mol该物质最多可与4molH2发生反应 D、该物质与Na、NaOH、Na2CO3均可反应13. 已知前四周期主族元素M、N、P、Q、W在周期表中的位置如图所示,且最外层电子数之和为20。则下列说法正确的是( )
A、该分子中所有原子不可能都共面 B、该物质可发生加成反应、酯化反应、取代反应 C、1mol该物质最多可与4molH2发生反应 D、该物质与Na、NaOH、Na2CO3均可反应13. 已知前四周期主族元素M、N、P、Q、W在周期表中的位置如图所示,且最外层电子数之和为20。则下列说法正确的是( )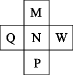 A、M、N的简单氢化物的稳定性:M<N B、N、W的最高价氧化物对应的水化物酸性:N>W C、Q是同周期主族元素中离子半径最小的元素 D、W的氯化物一定满足8电子稳定结构14. 下列离子浓度的关系正确的是( )A、0.1mol·L-1K2S溶液中:c(H+)+c(HS-)+2c(H2S)=c(OH-) B、0.1mol·L-1NaHCO3溶液中:c()+2c()+c(H2CO3)=c(Na+) C、等物质的量的CH3COONa和盐酸的混合溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) D、物质的量浓度相等的NH4Cl溶液、CH3COONH4溶液和NH4HSO4溶液中c()依次增大15. 用海水得到的粗盐中含有较多杂质(如不溶性的泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等),粗盐提纯的流程如图所示。下列说法错误的是( )
A、M、N的简单氢化物的稳定性:M<N B、N、W的最高价氧化物对应的水化物酸性:N>W C、Q是同周期主族元素中离子半径最小的元素 D、W的氯化物一定满足8电子稳定结构14. 下列离子浓度的关系正确的是( )A、0.1mol·L-1K2S溶液中:c(H+)+c(HS-)+2c(H2S)=c(OH-) B、0.1mol·L-1NaHCO3溶液中:c()+2c()+c(H2CO3)=c(Na+) C、等物质的量的CH3COONa和盐酸的混合溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) D、物质的量浓度相等的NH4Cl溶液、CH3COONH4溶液和NH4HSO4溶液中c()依次增大15. 用海水得到的粗盐中含有较多杂质(如不溶性的泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等),粗盐提纯的流程如图所示。下列说法错误的是( )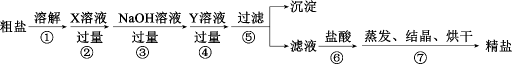 A、步骤①⑤⑦均会使用的仪器是玻璃棒 B、步骤②所加X溶液和步骤④所加Y溶液的顺序可以调换 C、步骤⑥加入盐酸的目的是除去过量的NaOH和Na2CO3 D、该提纯过程未涉及氧化还原反应16. Fe2+催化H2O2分解产生HO•,HO•将NO氧化为的机理如图所示,下列有关说法错误的是( )
A、步骤①⑤⑦均会使用的仪器是玻璃棒 B、步骤②所加X溶液和步骤④所加Y溶液的顺序可以调换 C、步骤⑥加入盐酸的目的是除去过量的NaOH和Na2CO3 D、该提纯过程未涉及氧化还原反应16. Fe2+催化H2O2分解产生HO•,HO•将NO氧化为的机理如图所示,下列有关说法错误的是( )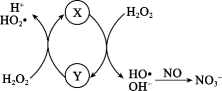 A、图中Y是Fe3+ , 是反应过程的中间产物 B、HO•将NO氧化为的方程式为:3HO•+NO+OH-=+2H2O C、若反应温度过高,NO的去除率可能下降 D、图中H2O2均表现强氧化性17. 常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。下列说法错误的是( )
A、图中Y是Fe3+ , 是反应过程的中间产物 B、HO•将NO氧化为的方程式为:3HO•+NO+OH-=+2H2O C、若反应温度过高,NO的去除率可能下降 D、图中H2O2均表现强氧化性17. 常温下,在不同试剂中加入酸或碱后体系pH的变化如表所示。下列说法错误的是( )试剂
pH
初始
通入0.01molHCl气体
加入0.01molNaOH固体
①1LH2O
7
a
12
②0.10molCH3COOH,0.10molCH3COONa配制成1L的溶液
4.76
4.67
4.85
已知:缓冲作用是维持溶液自身pH值的相对稳定。
A、表中a的数值等于2(忽略通入HCl气体前后体系的体积变化) B、试剂①如表所示通入HCl和加入NaOH相比,水的电离程度相同 C、试剂②中c(CH3COOH)>c(Na+)>c(CH3COO-) D、NH3·H2O—NH4Cl溶液具有与试剂②相似的缓冲作用18. 下列实验操作、现象及结论均正确的是( )选项
实验操作
实验现象
实验结论
A
向淀粉KI溶液中滴入适量稀硫酸
溶液变蓝
稀硫酸将I-氧化为I2
B
向AgCl悬浊液中滴入适量氨水
悬浊液变澄清
AgCl(s)Ag+(aq)+Cl-(aq)平衡正向移动
C
加热NH4Cl固体
产生刺激性气味的气体
加热NH4Cl可制备NH3
D
向酸性KMnO4溶液中滴入H2C2O4溶液
酸性KMnO4溶液褪色
H2C2O4具有漂白性
A、A B、B C、C D、D19. 爱迪生发明的镍铁碱性电池的寿命是铅蓄电池的数倍,为了纪念爱迪生的付出,这种电池也叫“爱迪生蓄电池”,其反应原理为:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2 , 用爱迪生蓄电池制取少量Na2FeO4的装置如图所示。下列说法正确的是( )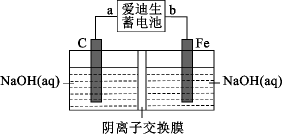 A、装置图中爱迪生蓄电池的负极是b B、该电池工作一段时间充电时,生成NiO2的反应是还原反应 C、电解质溶液中OH-透过阴离子交换膜从右池移到左池 D、Fe电极上的反应为:Fe-6e-+8OH-=FeO+4H2O20. 向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中各种含磷微粒的物质的量分数的变化如图所示。下列说法错误的是( )
A、装置图中爱迪生蓄电池的负极是b B、该电池工作一段时间充电时,生成NiO2的反应是还原反应 C、电解质溶液中OH-透过阴离子交换膜从右池移到左池 D、Fe电极上的反应为:Fe-6e-+8OH-=FeO+4H2O20. 向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中各种含磷微粒的物质的量分数的变化如图所示。下列说法错误的是( )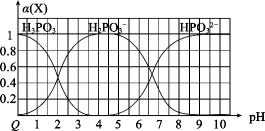 A、H3PO3是二元弱酸 B、该温度下,H3PO3的Ka1=1.0×10-2 C、NaH2PO3溶液显碱性 D、以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式为:H2PO+OH-=H2O+HPO
A、H3PO3是二元弱酸 B、该温度下,H3PO3的Ka1=1.0×10-2 C、NaH2PO3溶液显碱性 D、以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式为:H2PO+OH-=H2O+HPO二、元素或物质推断题
-
21. 如图所示是铁及其化合物的价类二维图。回答下列问题:
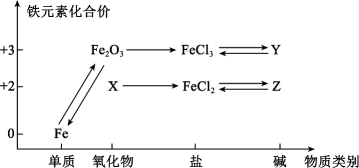 (1)、X的化学式为 , 生铁在潮湿空气中主要发生(填“析氢”或“吸氧”)腐蚀。(2)、工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是(填标号)。
(1)、X的化学式为 , 生铁在潮湿空气中主要发生(填“析氢”或“吸氧”)腐蚀。(2)、工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是(填标号)。a.电解法 b.热还原法 c.热分解法 d.物理方法
(3)、检验FeCl3和FeCl2混合溶液中Fe2+的操作是;除去FeCl2溶液中的少量FeCl3加入的最佳试剂为。(4)、Z在空气中很容易变成Y,该反应的化学方程式为。(5)、FeCl3和KI在水溶液中转化的离子反应有:2Fe3++2I-2Fe2++I2 , 为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的____(填标号)。A、淀粉溶液 B、KSCN溶液 C、硝酸银溶液 D、酸性高锰酸钾溶液三、有机推断题
-
22. 有机物X、Y、Z、W、O、P、Q的转化关系如图所示(部分条件省略)。已知X是淀粉水解的最终产物,Y、W是厨房里常见调味剂的主要成分,P为相对分子质量为28的烃,Q是高分子化合物。回答下列问题:
 (1)、X所含官能团的名称是。(2)、Q的结构简式为。(3)、写出Y生成Z的化学方程式;其反应类型为。(4)、上述有机物中能使酸性高锰酸钾溶液褪色的有种。(5)、O的同分异构体中能与NaOH溶液反应的共有种(不包含O本身)。
(1)、X所含官能团的名称是。(2)、Q的结构简式为。(3)、写出Y生成Z的化学方程式;其反应类型为。(4)、上述有机物中能使酸性高锰酸钾溶液褪色的有种。(5)、O的同分异构体中能与NaOH溶液反应的共有种(不包含O本身)。四、元素或物质推断题
-
23. 短周期主族元素X、Y、Z、W的原子序数依次增加,X、Y、W位于不同周期,Z、W位于同主族。它们组成的一种无机物A的结构如图所示。回答下列问题:
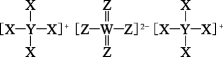 (1)、Y在周期表的位置是。(2)、X和Y组成的最简单化合物的电子式为。(3)、A的水溶液呈性,用离子方程式表示其原因为。(4)、以铅蓄电池为电源,用直接电解法将污水中无机物A的阳离子转变为无污染的物质,其装置如下图所示:
(1)、Y在周期表的位置是。(2)、X和Y组成的最简单化合物的电子式为。(3)、A的水溶液呈性,用离子方程式表示其原因为。(4)、以铅蓄电池为电源,用直接电解法将污水中无机物A的阳离子转变为无污染的物质,其装置如下图所示:
Pt1电极接铅蓄电池(填“正”或“负”)极,所接电极的电极材料为 , 污水中A的阳离子在电极上发生反应的电极反应式为。
五、工业流程题
-
24. 重铬酸钠晶体(Na2Cr2O7·2H2O)是重要的基本化工原料,是化学实验中重要的氧化剂。工业生产中重铬酸钠晶体可用铬铁矿(主要成分为FeO·Cr2O3 , 还有少量SiO2和Al2O3)来制取,其流程如图所示。回答下列问题:
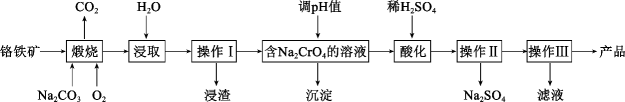 (1)、“煅烧”过程中氧化Cr2O3发生反应的化学方程式为。(2)、“浸取”过程中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是。(3)、已知重铬酸钠晶体和硫酸钠的溶解度随温度的变化关系如图所示,操作Ⅱ是。
(1)、“煅烧”过程中氧化Cr2O3发生反应的化学方程式为。(2)、“浸取”过程中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是。(3)、已知重铬酸钠晶体和硫酸钠的溶解度随温度的变化关系如图所示,操作Ⅱ是。 (4)、“酸化”过程中加入稀硫酸酸化,溶液橙色变深,从化学平衡的角度解释其原因为。(5)、“操作Ⅲ”得到的滤液中含有重铬酸钠对水体有污染,通常加入亚硫酸钠转化为Cr3+ , 再加入氢氧化钠溶液使其转化为Cr(OH)3而除去,常温下要除去废液中多余的Cr3+ , 调节pH至少为 , 才能使铬离子沉淀完全(已知溶液中离子浓度小于1×10-5mol·L-1 , 则认为离子完全沉淀;Ksp[Cr(OH)3]=1×10-32)。
(4)、“酸化”过程中加入稀硫酸酸化,溶液橙色变深,从化学平衡的角度解释其原因为。(5)、“操作Ⅲ”得到的滤液中含有重铬酸钠对水体有污染,通常加入亚硫酸钠转化为Cr3+ , 再加入氢氧化钠溶液使其转化为Cr(OH)3而除去,常温下要除去废液中多余的Cr3+ , 调节pH至少为 , 才能使铬离子沉淀完全(已知溶液中离子浓度小于1×10-5mol·L-1 , 则认为离子完全沉淀;Ksp[Cr(OH)3]=1×10-32)。六、实验题
-
25. 硫代硫酸钠是化学实验中一种重要的试剂,易溶于水,易氧化,易水解,因此使用前往往需要标定其浓度,然后用标定浓度的硫代硫酸钠溶液探究浓度、温度对化学反应速率的影响。回答下列问题:
Ⅰ.用间接碘量法标定硫代硫酸钠溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g·mol-1)0.5880g。平均分成3份分别放入3个锥形瓶中,加入水均配成20.00mL溶液,加入过量的KI并酸化,发生反应:6I-+Cr2O+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用Na2S2O3溶液滴定,发生反应:I2+2S2O=2I-+S4O , 三次消耗Na2S2O3溶液的平均体积为20.00mL。
(1)、硫代硫酸钠溶液中含有的杂质最有可能是(填化学式),检验该杂质是否存在的操作是。(2)、Na2S2O3溶液盛放在(填“酸式”或“碱式”)滴定管中;达到滴定终点的现象是:当滴入最后一滴标准溶液时,;所标定的硫代硫酸钠溶液的浓度为mol·L-1.(3)、Ⅱ.某化学实验小组根据反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O设计实验,探究硫代硫酸钠溶液的浓度和温度对反应速率的影响,实验数据如表所示:实验编号
反应温度/℃
0.1mol·L-1稀硫酸的体积/mL
0.1mol·L-1硫代硫酸钠溶液的体积/mL
加入的水的体积/mL
产生等量的沉淀所需时间/s
①
20
2
1
V1
t1
②
30
2
1
2
t2
③
30
2
V2
1
t3
实验(填实验编号)是探究硫代硫酸钠溶液的温度对反应速率的影响。
(4)、V1V2 , t1t3。(均填“>”“<”或“=”)七、原理综合题
-
26. 不依赖植物,人工合成碳水化合物,一直是世界各国科学家的梦想。我国中科院天津工业生物技术研究所的科学家在国际上首次突破二氧化碳人工合成淀粉,研究碳的化合物对减少CO2在大气中累积及实现可再生能源的有效利用具有重要意义。CO2和H2在一定条件下能发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH.回答下列问题:(1)、该反应中反应物与生成物的能量与活化能的关系如图所示,该反应的ΔH=kJ·mol-1(用含Ea1和Ea2的代数式表示)。
 (2)、恒温恒容条件下,下列不能说明该反应达到平衡状态的是____(填标号)。A、ʋ(CO2)正=ʋ(CH3OH)逆 B、CH3OH(g)的体积分数与H2O(g)的体积分数相等 C、混合气体的密度不再变化 D、混合气体的压强不再变化(3)、一定温度下,向一体积为3L的刚性密闭容器中充入3molCO2和6molH2 , 此时容器内的压强为45kPa,发生上述反应,进行5min时达到平衡,此时容器内的压强为30kPa,则0~5min内用H2表示的化学反应速率为mol·L-1·min-1.该温度下,该反应的平衡常数K=L2·mol-2(4)、以CO2、H2为原料合成CH3OH时,还发生了副反应:
(2)、恒温恒容条件下,下列不能说明该反应达到平衡状态的是____(填标号)。A、ʋ(CO2)正=ʋ(CH3OH)逆 B、CH3OH(g)的体积分数与H2O(g)的体积分数相等 C、混合气体的密度不再变化 D、混合气体的压强不再变化(3)、一定温度下,向一体积为3L的刚性密闭容器中充入3molCO2和6molH2 , 此时容器内的压强为45kPa,发生上述反应,进行5min时达到平衡,此时容器内的压强为30kPa,则0~5min内用H2表示的化学反应速率为mol·L-1·min-1.该温度下,该反应的平衡常数K=L2·mol-2(4)、以CO2、H2为原料合成CH3OH时,还发生了副反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH1=+41.5kJ·mol-1
一定压强下,按照一定比例投入原料,CO2的平衡转化率在300℃以下随温度升高而减小,在300℃以上随温度升高而增大,甲醇的产量在300℃以下随温度升高而减小,在300℃以上随温度升高基本不变,理由是。
-
-
-
-
-