陕西省渭南市大荔县2022-2023学年高二下学期期末质量检测化学试题
试卷更新日期:2023-08-16 类型:期末考试
一、单选题
-
1. 化学与社会生产、生活、环境等密切相关,下列说法正确的是( )A、碳酸氢钠药片可用于治疗胃酸过多,与醋同服可提高疗效 B、婴幼儿滴眼液中含微量硝酸银,银离子消炎与“84”消杀原理不相同 C、北京冬奥会采用光伏电池,有利于实现“碳中和”,光伏发电所用太阳能电池板的主要原料为 D、2023年蒙古、中国、日本多地沙尘肆虐,沙尘和雾霾都属于胶体范畴2. 有机化合物种类繁多,下列关于生活中常见有机物的说法正确的是( )A、花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物 B、向鸡㿿清的溶液中加入饱和硫酸钠溶液产生沉淀,加水后沉淀溶解,发生的是化学变化 C、棉花可用作生产无烟火药,含有的主要成分是纤维素 D、向淀粉溶液中加入硫酸溶液,加热后滴入几滴氢氧化铜悬浊液,再加热至沸腾,未出现红色物质,说明淀粉未水解3. 下列有关有机化合物的说法正确的是( )
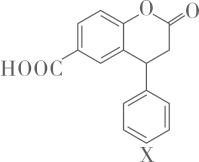 A、在酸性条件下水解,水解产物只有一种 B、该有机物分子含有3种官能团 C、化合物最多能与的反应 D、分子中两个苯环一定处于同一平面4. 宏观辦识与微观探析是化学的核心素养之一,用微观粒子表示的方程式正确的是( )A、碳酸氢铵溶液中滴加过量澄清石灰水: B、食醋除水垢: C、印刷电路板反应原理: D、用稀硝酸洗涤做过银镜反应的试管:5. 学习化学知识可以辨别“真”“伪”,下列叙述属于“真”的是( )A、可作净水剂的原因是易溶于水 B、电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量相等 C、在测定中和热实验中,使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差 D、的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变6. 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为: , 下列有关说法正确的是( )
A、在酸性条件下水解,水解产物只有一种 B、该有机物分子含有3种官能团 C、化合物最多能与的反应 D、分子中两个苯环一定处于同一平面4. 宏观辦识与微观探析是化学的核心素养之一,用微观粒子表示的方程式正确的是( )A、碳酸氢铵溶液中滴加过量澄清石灰水: B、食醋除水垢: C、印刷电路板反应原理: D、用稀硝酸洗涤做过银镜反应的试管:5. 学习化学知识可以辨别“真”“伪”,下列叙述属于“真”的是( )A、可作净水剂的原因是易溶于水 B、电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量相等 C、在测定中和热实验中,使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差 D、的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变6. 普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为: , 下列有关说法正确的是( )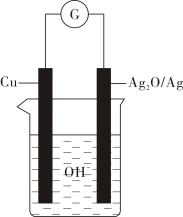 A、测量原理示意图中,电流方向从经过导线流向 B、电池工作时,溶液中向正极移动 C、电路中转移的电子,电极的质量增加 D、电极的电极反应式为7. 下列实验装置能达到实验目的是(夹持仪器未画出)( )
A、测量原理示意图中,电流方向从经过导线流向 B、电池工作时,溶液中向正极移动 C、电路中转移的电子,电极的质量增加 D、电极的电极反应式为7. 下列实验装置能达到实验目的是(夹持仪器未画出)( )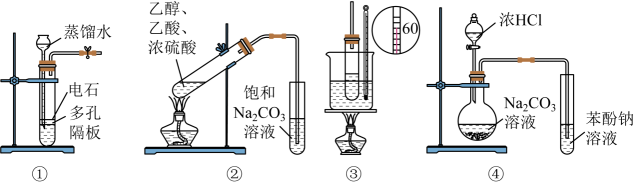 A、①装置用于实验室制备乙炔 B、②装置制备并收集乙酸乙酯 C、③装置用于实验室制硝基苯 D、④装置可装置证明酸性:盐酸>碳酸>苯酚8. 苯乙醛可用于制备工业香料,工业上通过以下途径制备苯乙醛。下列说法错误的是 ( )
A、①装置用于实验室制备乙炔 B、②装置制备并收集乙酸乙酯 C、③装置用于实验室制硝基苯 D、④装置可装置证明酸性:盐酸>碳酸>苯酚8. 苯乙醛可用于制备工业香料,工业上通过以下途径制备苯乙醛。下列说法错误的是 ( )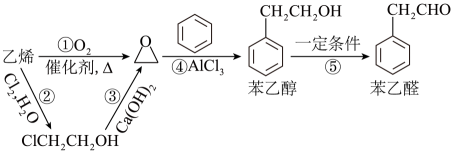 A、反应①和④的原子利用率均为 B、乙烯、苯乙醇、苯乙醛均能使酸性高锰酸钾溶液褪色 C、向2 mL10%的硫酸铜溶液中滴加5滴2%的氢氧化钠溶液,再加入0.5 mL苯乙醛溶液,加热,有砖红色沉淀出现 D、预测可以发生反应
A、反应①和④的原子利用率均为 B、乙烯、苯乙醇、苯乙醛均能使酸性高锰酸钾溶液褪色 C、向2 mL10%的硫酸铜溶液中滴加5滴2%的氢氧化钠溶液,再加入0.5 mL苯乙醛溶液,加热,有砖红色沉淀出现 D、预测可以发生反应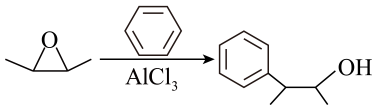 9. 多相催化反应是反应物分子在催化剂表面通过吸附、解吸附过程进行的反应。我国学者发现在时,甲醇在铜基催化剂上的反应机理如下(该反应为可逆反应):
9. 多相催化反应是反应物分子在催化剂表面通过吸附、解吸附过程进行的反应。我国学者发现在时,甲醇在铜基催化剂上的反应机理如下(该反应为可逆反应):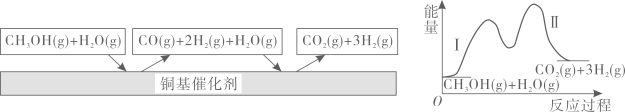
下列说法正确的是( )
A、反应是放热反应, , 反应II是吸热反应, B、是热能转化为化学能的过程 C、铜基催化剂可以加快反应速率,降低反应的活化能,但不参与反应 D、在反应中既生成又消耗,可认为是催化剂10. 下列溶液混合后,所得溶液中各离子浓度关系不正确的是( )A、0.1 mol·L-1的NaOH溶液与0.1 mol·L-1的CH3COOH溶液等体积混合:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) B、常温下,0.01 mol·L-1的NaOH溶液与pH=2的CH3COOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) C、常温下,0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) D、0.1 mol·L-1的CH3COOH溶液和0.1 mol·L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)11. 下列实验操作与预期实验目的或所得实验结论一致的是( )选项
实验操作
实验目的或结论
A
将氯乙烷与氢氧化钠溶液共热一段时间,再
向冷却后的混合液中滴加硝酸银溶液
检验水解产物中的氯离子
B
将缠绕铜丝灼烧后反复插入盛乙醇的试管,然后滴入酸性高锰酸钾溶液
乙醇催化氧化生成乙醛
C
向苯中滴加溴水,再加入铁粉
制备溴苯
D
向汽油和植物油中分别加入一定量的NaOH溶液加热振荡,观察油层是否消失或变浅
鉴别植物油和矿物油
A、A B、B C、C D、D12. 用酸性氢氧燃料电池电解苦卤水含、、、)的装置如图所示(、为石墨电极)。下列说法中,正确的是( )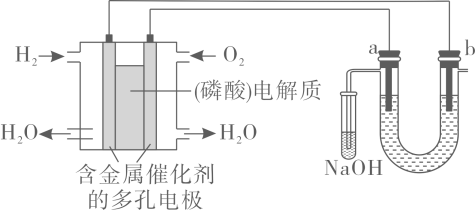 A、电池工作时,正极反应式为: B、忽略能量损耗,当电池中消耗时,极为阳极,理论上周围会产生 C、电解时,电子流动路径是:负极外电路阴极溶液阳极正极 D、电解时,电极周围首先放电的是而不是 , 说明当其他条件相同时前者的还原性强于后者13. 下列有关物质的结构,性质、用途,说法不正确的是( )A、氨基酸既能与盐酸反应,也能与烧碱溶液反应 B、
A、电池工作时,正极反应式为: B、忽略能量损耗,当电池中消耗时,极为阳极,理论上周围会产生 C、电解时,电子流动路径是:负极外电路阴极溶液阳极正极 D、电解时,电极周围首先放电的是而不是 , 说明当其他条件相同时前者的还原性强于后者13. 下列有关物质的结构,性质、用途,说法不正确的是( )A、氨基酸既能与盐酸反应,也能与烧碱溶液反应 B、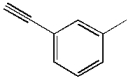 分子中共平面的原了最多为15个
C、异戊烷的一氯代物有3种
D、室温下,在水中的溶解度:乙二醇苯酚溴乙烷
14. 高分子广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如图:
分子中共平面的原了最多为15个
C、异戊烷的一氯代物有3种
D、室温下,在水中的溶解度:乙二醇苯酚溴乙烷
14. 高分子广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如图: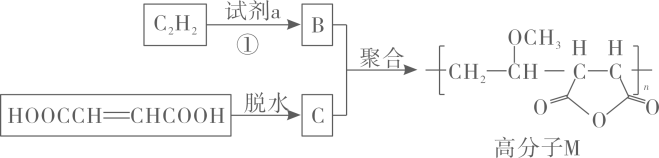
下列说法不正确的是( )
A、反应①为取代反应 B、化合物的核磁共振氢谱有一组峰 C、高分子在一定条件下可以发生水解反应 D、合成的聚合反应是加聚反应15. 废旧铅蓄电池的铅膏中主要含有、、和 , 还有少量、的盐或氧化物等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。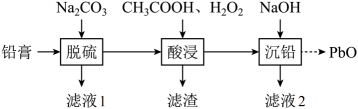
已知:室温下,、、。、完全沉淀时的pH分别是3.2和4.6;开始沉淀时的pH是7.2。
下列说法正确的是( )
A、“脱硫”后的滤液中, B、“酸浸”中和的反应,体现了的氧化性 C、“酸浸”后溶液的pH约为4.9,滤渣的主要成分是和 D、“沉铅”时,控制溶液的 , 则滤液2中为二、填空题
-
16. 请依据所学知识填空:(1)、物质的量为的烃在氧气中完全燃烧,生成化合物B、C各 , 试回答:
①烃的分子式为;
②若烃能使溴水褪色,在催化剂作用下与加成,其加成产物分子中含有4个甲基,烃A可能的结构简式有种。
(2)、请完成下列转化的化学方程式(注明反应条件)。①甲苯与浓硝酸、浓硫酸混合制TNT
②1,3-丁二烯制备1,4-溴-2-丁烯
(3)、① 的一氯代物具有不同沸点的产物有种。
的一氯代物具有不同沸点的产物有种。②
 系统命名的名称为。
系统命名的名称为。③写出2-丁烯在一定条件下加聚产物的结构简式。
三、原理综合题
-
17. 针对氮氧化物的研究是当前的重大课题。(1)、用活性炭还原防止空气污染。其反应原理为。一定温度下,向恒容密闭容器中加入足量的C(s)和 , 如图表示体系中物质浓度变化曲线,请回答下列问题:

①图中点的正点的(正)(填“>”“<”或“=”);用表示从内该反应的平均速率。
②在该温度下,计算达到平衡状态时的转化率是
③对于该化学反应原理,说法不正确的是
A.反应过程中,容器内压强不再变化,说明反应达到平衡
B.反应过程中,气体密度维持不变,说明反应达到平衡
C.增大压强能提高的转化率,同时也能提高的平衡产率
D.加入对反应催化效果更佳的催化剂,加快反应速率,但不能提高的平衡转化率
E.升高温度,平衡正向移动,正反应速率增大,逆反应速率减小
(2)、环境治理依然是当今的热点问题,研究新的环境治理手段具有重要意义。回答下列问题:①的反应历程分以下两步:
第一步;
第二步(用含、的式子表示)。
②催化还原是重要的烟气脱硝技术,研究发现在以为主的催化剂上可能发生的反应过程如图。请写出脱硝过程的总反应的化学方程式:。
 (3)、一定温度下,在体积为的恒容密闭容器中加入和发生反应 , 测得和的物质的量随时间的变化如图所示:
(3)、一定温度下,在体积为的恒容密闭容器中加入和发生反应 , 测得和的物质的量随时间的变化如图所示:
①若该反应的正、逆反应速率分别可表示为 , , k正、k逆分别为正、逆反应速率常数,A、B两点对应的时刻,该反应的正反应速率之比。
②若平衡时总压强为 , 用平衡分压代替其平衡浓度表示的化学平衡常数[已知:气体分压气体总压该气体的体积分数]。
四、实验题
-
18. 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
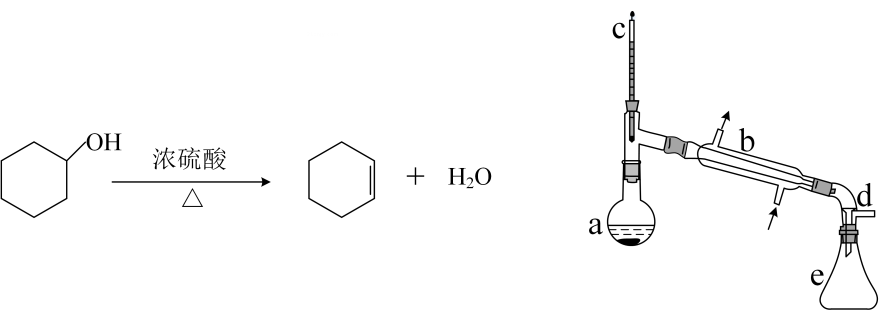
可能用到的有关数据如下:
密度
沸点
溶解性
环己醇
0.9618
161
微溶于水
环己烯
0.8102
83
难溶于水
合成反应:
在中加入环己醇和2小片碎瓷片,冷却搅动下慢慢加入浓硫酸。b中通入冷却水后,开始缓慢加热 , 控制馏出物的温度不超过。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯。
回答下列问题:
(1)、装置b的名称是。合成环己烯的反应类型是(2)、环己烯和氢气发生加成反应的化学方程式为(有机物必须用键线式表示)。(3)、在本实验分离过程中,最终产物应该从分液漏斗的(填“上口倒出”或“下口放出”)。(4)、本实验中最容易产生有机副产物的结构简式为 , 分离提纯过程中加入无水氯化钙的目的是。(5)、在环己烯粗产物蒸馏过程中,可能用到的仪器有
A.蒸馏烧瓶 B.温度计 C.漏斗 D.玻璃棒 E.接收器 F.球形冷凝管(6)、本实验所得到的环己烯的产率是(用百分数表示,结果保留一位小数)。五、有机推断题
-
19. 化合物是一种有机光电材料中问体。实验室由芳香化合物制备的一种合成路线如下:
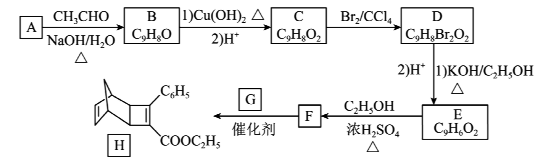
已知:①
②
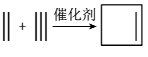
请回答下列问题:
(1)、化合物的名称为 , D中官能团的名称为。(2)、下列说法正确的是____。A、的反应类型是取代反应 B、化合物可以与溶液反应 C、化合物D不能发生消去反应 D、能使高锰酸钾褪色,也能使溴水褪色F.化合物的分子式为(3)、化学反应方程式为。(4)、芳香化合物是的同分异构体,具有以下特点:①只有一个环状结构;②具有两个相同的官能团;③能发生银镜反应,共有种(不考虑立体异构)。其中核磁共振氢谱有四种不同化学环境的氢,且峰面积之比为 , 写出一种符合要求的的结构简式。(5)、写出用环戊烷和2丁炔为原料制备化合物( )的合成路线(用流程图表示,其他试剂任选)。
)的合成路线(用流程图表示,其他试剂任选)。
-
-
-