江苏省南京市六校联合体2022-2023学年高二下学期期末考试化学试题
试卷更新日期:2023-08-16 类型:期末考试
一、单选题
-
1. 化学为人类科技发展作出巨大贡献。下列物质主要成分属于纤维素的是( )A、棉、麻 B、黑火药 C、陶瓷烧制 D、丝绸2. 少量Na2O2与CO2反应生成Na2CO3和O2 , 下列说法正确的是( )
 A、Na2O2的电子式为
A、Na2O2的电子式为 B、Na2CO3仅含离子键
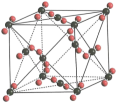
C、干冰晶胞如图所示,配位数为12
D、16O和18O互为同素异形体
3. 常见的非金属元素和金属元素及其化合物是中学化学核心知识。下列说法正确的是( )A、半径大小:r(Al)>r(Na) B、电离能大小:I1(N)>I1(O) C、电负性大小:χ(F)<χ(O) D、碱性强弱:NaOH<Al(OH)34. 下列有关SO2的实验原理或方案能达到目的的是( )A、
B、Na2CO3仅含离子键
C、干冰晶胞如图所示,配位数为12
D、16O和18O互为同素异形体
3. 常见的非金属元素和金属元素及其化合物是中学化学核心知识。下列说法正确的是( )A、半径大小:r(Al)>r(Na) B、电离能大小:I1(N)>I1(O) C、电负性大小:χ(F)<χ(O) D、碱性强弱:NaOH<Al(OH)34. 下列有关SO2的实验原理或方案能达到目的的是( )A、 制SO2
B、
制SO2
B、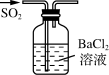 制BaSO3沉淀
C、
制BaSO3沉淀
C、 验证SO2的还原性
D、
验证SO2的还原性
D、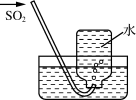 收集SO2
5. 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1 , 肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。下列说法正确的是( )A、HNO2与KMnO4酸性溶液反应:5NO+2+6H+=5+2Mn2++3H2O B、氨气燃烧的热化学方程式:4NH3(g)+3O2(g)=6H2O(g)+2N2(g) ΔH=-1265kJ·mol-1 C、肼(N2H4)—空气碱性燃料电池的负极反应:N2H4+4e-=4H++N2↑ D、氢氧化铜溶于氨水的化学方程式:Cu(OH)2+4NH3=[Cu(NH3)4](OH)26. 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1 , 肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。连二亚硝酸(HON=NOH)是一种重要的还原剂,可由亚硝酸和羟胺反应制备,其反应的化学方程式为( )HONO+H2NOH→HON=NOH+H2O。下列说法错误的是A、亚硝酸根离子(NO)为V形结构 B、羟胺是极性分子 C、1个HON=NOH中有6个σ键 D、连二亚硝酸可能易溶于水7. 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1。肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。关于物质的性质及其相关用途,下列说法错误的是( )A、蛋白质盐析是可逆的,可采用多次盐析来分离提纯蛋白质 B、亚硝酸钠(NaNO2)具有防腐作用,可用来浸泡新鲜瓜果 C、浓氨水具有挥发性和还原性,可用于检验输送氯气的管道是否漏气 D、NH3易液化,液氨汽化时吸收大量热,可用作制冷剂8. 利用电解原理制备的装置如图所示(M、N均为惰性电极)。下列说法正确的是( )
收集SO2
5. 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1 , 肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。下列说法正确的是( )A、HNO2与KMnO4酸性溶液反应:5NO+2+6H+=5+2Mn2++3H2O B、氨气燃烧的热化学方程式:4NH3(g)+3O2(g)=6H2O(g)+2N2(g) ΔH=-1265kJ·mol-1 C、肼(N2H4)—空气碱性燃料电池的负极反应:N2H4+4e-=4H++N2↑ D、氢氧化铜溶于氨水的化学方程式:Cu(OH)2+4NH3=[Cu(NH3)4](OH)26. 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1 , 肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。连二亚硝酸(HON=NOH)是一种重要的还原剂,可由亚硝酸和羟胺反应制备,其反应的化学方程式为( )HONO+H2NOH→HON=NOH+H2O。下列说法错误的是A、亚硝酸根离子(NO)为V形结构 B、羟胺是极性分子 C、1个HON=NOH中有6个σ键 D、连二亚硝酸可能易溶于水7. 氮是生命所需的重要元素,是蛋白质的重要组成部分。亚硝酸(HNO2)是一种亮蓝色的弱酸,电离平衡常数为4.6×10-4;亚硝酸既有氧化性,又有还原性。亚硝酸溶液微热即分解。亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂。氨气的燃烧热316.25kJ·mol-1。肼(N2H4)为无色油状液体,有类似于氨的刺鼻气味,是一种强极性化合物。关于物质的性质及其相关用途,下列说法错误的是( )A、蛋白质盐析是可逆的,可采用多次盐析来分离提纯蛋白质 B、亚硝酸钠(NaNO2)具有防腐作用,可用来浸泡新鲜瓜果 C、浓氨水具有挥发性和还原性,可用于检验输送氯气的管道是否漏气 D、NH3易液化,液氨汽化时吸收大量热,可用作制冷剂8. 利用电解原理制备的装置如图所示(M、N均为惰性电极)。下列说法正确的是( )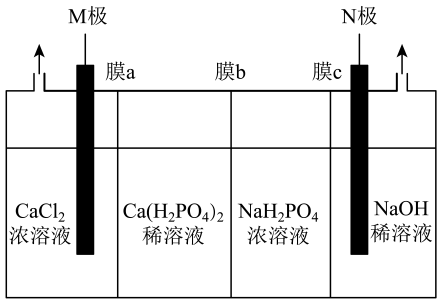 A、极与电源负极相连 B、常温下,电解后N极附近溶液减小 C、膜a、膜c均为阴离子交换膜,膜b为阳离子交换膜 D、电解时可获得副产物、、9. 汽车尾气中的有害气体可通过如下反应实现转化:2NO(g)+2CO(g)2CO2(g)+N2(g)。下列说法正确的是( )A、每转化22.4LNO,转移电子数为2×6.02×1023 B、该反应ΔH<0 C、反应的平衡常数K= D、其他条件相同,使用催化剂,可提高活化分子百分数,降低反应的焓变10. 抗阿尔茨海默病药物多奈哌齐的部分合成路线如下:
A、极与电源负极相连 B、常温下,电解后N极附近溶液减小 C、膜a、膜c均为阴离子交换膜,膜b为阳离子交换膜 D、电解时可获得副产物、、9. 汽车尾气中的有害气体可通过如下反应实现转化:2NO(g)+2CO(g)2CO2(g)+N2(g)。下列说法正确的是( )A、每转化22.4LNO,转移电子数为2×6.02×1023 B、该反应ΔH<0 C、反应的平衡常数K= D、其他条件相同,使用催化剂,可提高活化分子百分数,降低反应的焓变10. 抗阿尔茨海默病药物多奈哌齐的部分合成路线如下: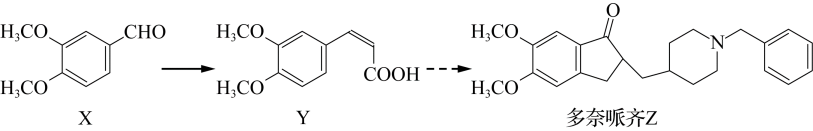
下列说法正确的是( )
A、X分子中的含氧官能团为醛基、酮羰基 B、1molX最多能与3molH2反应 C、Z既能与氢氧化钠溶液反应又能与盐酸反应 D、Y存在顺反异构体且所有碳原子可能共平面11. 根据下列实验操作和现象所得结论正确的是( )选项
实验操作和实验现象
结论
A
在一块除去铁锈的铁片上滴1滴含有酚酞的食盐水静置2~3min,溶液边缘出现红色
铁片上发生了吸氧腐蚀
B
将足量H2O2溶液滴入少量的酸性高锰酸钾溶液溶液紫色褪去
H2O2具有漂白性
C
向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口,试纸颜色无明显变化
原溶液中无
D
向Na2CO3、Na2S的混合溶液中滴入少量AgNO3溶液,有黑色沉淀生成
Ksp(Ag2S)<Ksp(Ag2CO3)
A、A B、B C、C D、D12. 室温下,通过下列实验探究NaHCO3溶液的性质实验
实验操作和现象
1
用pH试纸测得0.1mol·L-1NaHCO3溶液的pH约为8
2
向0.1mol·L-1NaHCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液,产生白色沉淀
3
向0.1mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液
4
向浓NaHCO3溶液中加入浓Al2(SO4)3溶液,有气体和沉淀生成
下列说法不正确的是( )
A、实验1的溶液中存在c(Na+)>c(H2CO3)>c() B、实验2所得上层清液中存在c(Ba2+)·c()=Ksp(BaCO3) C、实验3反应后的溶液中存在c(Na+)<c(HCO)+2c(CO) D、实验4中发生反应的离子方程式为:Al3++3=Al(OH)3↓+3CO2↑13. 通过反应Ι:CO2(g)+3H2(g)CH3OH(g)+H2O(g)可以实现CO2捕获并资源化利用。密闭容器中,反应物起始物质的量比=3时,在不同条件下(分别在温度为250℃下压强变化和在压强为5×105Pa下温度变化)达到平衡时CH3OH物质的量分数变化如下图所示,主要反应如下:反应II:CO2(g)+H2(g) CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g)ΔH3=—90.7kJ·mol-1
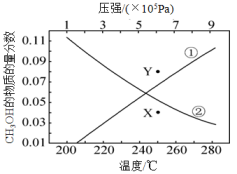
下列说法正确的是( )
A、反应Ι的ΔH1=+48.2kJ·mol-1 B、曲线②表示CH3OH的物质的量分数随压强的变化 C、一定温度下,增大的比值,可提高CO2平衡转化率 D、在5×105Pa、250℃、起始=3条件下,使用高效催化剂,能使CH3OH物质的量分数从X点达到Y点二、工业流程题
-
14. 以废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程可表示为:
 (1)、Mn2+的基态核外电子排布式为。(2)、“酸浸”时为提高锰离子的浸出率,可采取的措施有。(3)、“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+ , 滤渣1的主要成分为FeS2和S,写出该反应的离子方程式。(4)、已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为;滤渣2除MnO2、CaCO3外主要成分是(填化学式)。(5)、测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)。
(1)、Mn2+的基态核外电子排布式为。(2)、“酸浸”时为提高锰离子的浸出率,可采取的措施有。(3)、“反应I”中加入硫铁矿(主要成分FeS2)与MnO2反应生成Mn2+与Fe3+ , 滤渣1的主要成分为FeS2和S,写出该反应的离子方程式。(4)、已知:Ksp[Fe(OH)3]=1×10-38。“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为;滤渣2除MnO2、CaCO3外主要成分是(填化学式)。(5)、测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO,过滤洗涤;将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体0.5360g;充分反应后,用0.0400mol·L-1KMnO4溶液滴定,用去20.00mL。计算产品中MnSO4的质量分数(写出计算过程,保留两位有效数字)。[已知:+→CO2↑+Mn2+(未配平)]
三、有机推断题
-
15. 白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
 (1)、B分子中碳原子的杂化方式为。(2)、C→D的反应类型为。(3)、白花丹酸分子中混有
(1)、B分子中碳原子的杂化方式为。(2)、C→D的反应类型为。(3)、白花丹酸分子中混有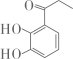 , 写出同时满足下列条件的该有机物的一种同分异构的结构简式:
, 写出同时满足下列条件的该有机物的一种同分异构的结构简式:①分子中有四种不同化学环境的氢;②与FeCl3溶液能发生显色反应,且1mol该物质最多能与3molNaOH反应。
(4)、E的结构简式为。(5)、已知:R—BrRMgBr。根据已有知识并结合相关信息写出以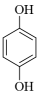 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备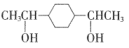 的合成路线流程图。
的合成路线流程图。 四、工业流程题
-
16. 硝酸铈铵[(NH4)2Ce(NO3)6]为橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作氧化剂和分析试剂;二氧化铈(CeO2)为白色或黄白色固体,难溶于水,有强氧化性,主要用于玻璃、催化剂、电子管等工业。(NH4)2Ce(NO3)6和CeO2均是常见的强氧化剂,可用Ce2(CO3)3(难溶于水)为原料进行制取。
 (1)、碳酸铈可溶于硝酸中,写出酸溶1的离子方程式:。(2)、“沉淀1”时,溶液中Ce(NO3)3转化为Ce(OH)3(HO2)沉淀。写出沉淀1反应的化学方程式:。(3)、“酸溶2”时,控制反应温度为80℃,硝酸与Ce(OH)3(HO2)分解产生的Ce(OH)4反应生成H2Ce(NO3)6 , 反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,原因是。(4)、“沉淀2”时,控制其他条件一定,改变加入NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉淀的收率如图1所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入n(NH4NO3)∶n(Ce)=4∶1的目的是。
(1)、碳酸铈可溶于硝酸中,写出酸溶1的离子方程式:。(2)、“沉淀1”时,溶液中Ce(NO3)3转化为Ce(OH)3(HO2)沉淀。写出沉淀1反应的化学方程式:。(3)、“酸溶2”时,控制反应温度为80℃,硝酸与Ce(OH)3(HO2)分解产生的Ce(OH)4反应生成H2Ce(NO3)6 , 反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,原因是。(4)、“沉淀2”时,控制其他条件一定,改变加入NH4NO3固体的量,测得(NH4)2Ce(NO3)6沉淀的收率如图1所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入n(NH4NO3)∶n(Ce)=4∶1的目的是。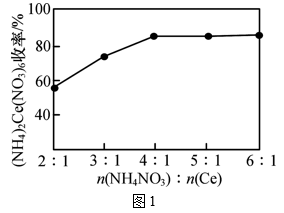 (5)、已知:4Ce(OH)3(白色沉淀)+O2+2H2O=4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如图2所示。实验小组以Ce2(CO3)3为原料制取CeO2 , 请设计实验方案:将Ce2(CO3)3完全溶解于盐酸中, , 得CeO2固体。[须选用的试剂和仪器:2mol·L-1氨水、O2、1mol·L-1HNO3、1mol·L-1AgNO3溶液、马弗炉(可用于固体的高温加热)]
(5)、已知:4Ce(OH)3(白色沉淀)+O2+2H2O=4Ce(OH)4(黄色沉淀),Ce(OH)4受热分解时失重百分比与温度的关系如图2所示。实验小组以Ce2(CO3)3为原料制取CeO2 , 请设计实验方案:将Ce2(CO3)3完全溶解于盐酸中, , 得CeO2固体。[须选用的试剂和仪器:2mol·L-1氨水、O2、1mol·L-1HNO3、1mol·L-1AgNO3溶液、马弗炉(可用于固体的高温加热)]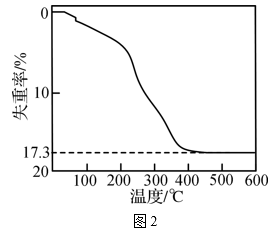
五、原理综合题
-
17. 回收利用含硫化合物有利于节约资源、保护环境。(1)、一种由含H2S的烟气回收硫黄的工艺为:将一部分含H2S的烟气在空气中燃烧,将燃烧所得产物与剩余烟气混合,冷却后可回收得到硫黄(S8)。该工艺中涉及反应为:
反应1:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ·mol-1(a<0)
反应2:4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=bkJ·mol-1(b>0)
反应3:4S2(g)=S8(s) ΔH3=ckJ·mol-1(c<0)
如果上述反应均能完全进行,为提高硫黄的产率,该工艺中需要控制反应1和反应2烟气的体积比为。
(2)、某工业废水中含有乙硫醇(C2H5SH),已知C2H5SH水溶液中的物种分布分数如图1所示。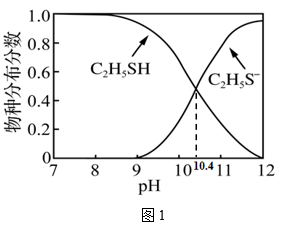
已知:Ka1(H2S)=9×10-8 , 分别从电离常数和共价键极性的角度比较H2S和C2H5SH酸性强弱:
①(电离常数);
②(共价键极性)。
(3)、一种以Al2O3为催化剂载体、FeS2为催化剂的H2还原烟气中SO2制S的反应机理如图2和图3所示: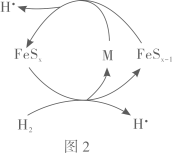

①图3中所示的转化过程可描述为。
②图2中FeSx和H2反应生成M、FeSx-1和H•的化学方程式为。
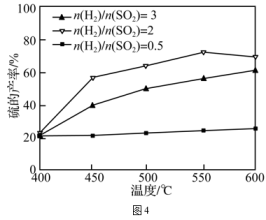
③其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率与温度和n(H2)/n(SO2)比值的关系如图4所示。500℃时,n(H2)/n(SO2)比值为3时硫的产率小于比值为2时的原因是。
-
-
-