湖南省株洲市炎陵县2022-2023学年高一下学期化学期末质量检测试题
试卷更新日期:2023-08-16 类型:期末考试
一、单选题
-
1. 下列化合物中,能由组成该化合物的两种元素的单质直接化合而成的是( )A、 B、 C、CuS D、2. 下列说法不正确的是( )A、凡是呈酸性的雨水都称为酸雨 B、将大气中游离态的氮转化为氮的化合物的过程叫做氮的固定 C、二氧化硅是制造光导纤维的材料,单质硅是良好的半导体材料 D、硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等3. 下列化学用语正确的是( )A、甲烷的空间填充模型:
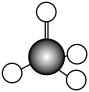 B、
B、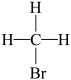 和
和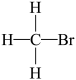 互为同分异构体
C、丙烷的结构式
D、和互为同系物
4. 下列相关实验原理或操作能达到实验目的的是( )
互为同分异构体
C、丙烷的结构式
D、和互为同系物
4. 下列相关实验原理或操作能达到实验目的的是( )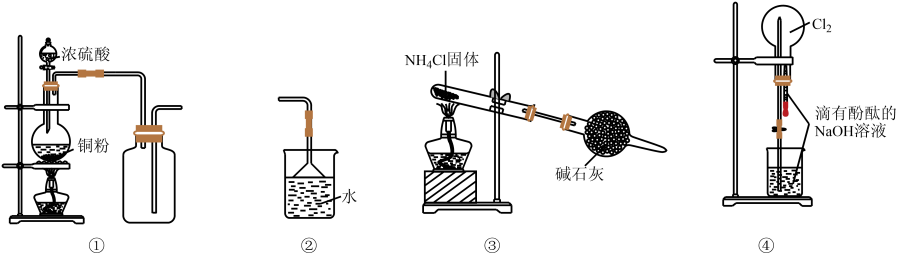 A、装置①可用于制备并收集SO2 B、装置②可作为氨气吸收装置 C、装置③可作为氨气发生装置 D、装置④烧瓶中溶液最终呈红色5. 在带有活塞的密闭容器中发生如下反应:3Fe(s) + 4H2O(g)Fe3O4(s) + 4H2(g)。下列分析正确的是( )A、增加铁片的质量(不考虑表面积的变化),化学反应速率加快 B、保持容器的容积不变,增加水蒸气的通入量,化学反应速率加快 C、保持容器内压强不变,充入一定量的氩气,化学反应速率保持不变 D、保持容器的容积不变,充入一定量的氩气,化学反应速率加快6. 自然界中臭氧形成反应的能量变化如图所示。下列说法中错误的是( )
A、装置①可用于制备并收集SO2 B、装置②可作为氨气吸收装置 C、装置③可作为氨气发生装置 D、装置④烧瓶中溶液最终呈红色5. 在带有活塞的密闭容器中发生如下反应:3Fe(s) + 4H2O(g)Fe3O4(s) + 4H2(g)。下列分析正确的是( )A、增加铁片的质量(不考虑表面积的变化),化学反应速率加快 B、保持容器的容积不变,增加水蒸气的通入量,化学反应速率加快 C、保持容器内压强不变,充入一定量的氩气,化学反应速率保持不变 D、保持容器的容积不变,充入一定量的氩气,化学反应速率加快6. 自然界中臭氧形成反应的能量变化如图所示。下列说法中错误的是( )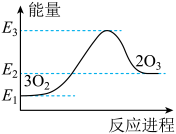 A、为放热反应 B、氧气比臭氧稳定 C、反应物的能量低于生成物 D、中化学键的断裂需要放出能量7. 铅蓄电池构造如图,下列说法不正确的是( )
A、为放热反应 B、氧气比臭氧稳定 C、反应物的能量低于生成物 D、中化学键的断裂需要放出能量7. 铅蓄电池构造如图,下列说法不正确的是( )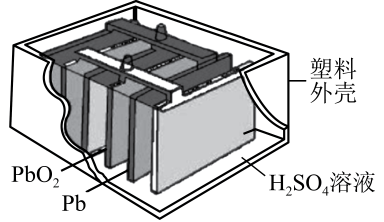 A、电池工作时,电子由Pb板通过导线流向PbO2板 B、电池工作时,Pb电极质量减小 C、电池工作时,正极的电极反应方程式是PbO2+2e-+4H++SO=PbSO4+2H2O D、由反应可知,物质的氧化性:PbO2>Pb2+8. 下列说法正确的是( )A、葡萄糖在酶的催化下可以水解为乙醇 B、糖类、油脂、蛋白质都是人体所需营养物质,都属于天然有机高分子化合物 C、工业上油脂在碱性条件下的水解反应生成高级脂肪酸盐和甘油,进行肥皂生产 D、鸡蛋清溶液中加入醋酸铅溶液,产生白色沉淀,加足量水,白色沉淀溶解9. 70℃时,200mL过氧化氢溶液在pH=13时分解,甲、乙两组实验中分别只改变一个反应条件,过氧化氢的物质的量随时间的变化图像如图(假设反应前后溶液体积不变)。下列有关说法错误的是( )
A、电池工作时,电子由Pb板通过导线流向PbO2板 B、电池工作时,Pb电极质量减小 C、电池工作时,正极的电极反应方程式是PbO2+2e-+4H++SO=PbSO4+2H2O D、由反应可知,物质的氧化性:PbO2>Pb2+8. 下列说法正确的是( )A、葡萄糖在酶的催化下可以水解为乙醇 B、糖类、油脂、蛋白质都是人体所需营养物质,都属于天然有机高分子化合物 C、工业上油脂在碱性条件下的水解反应生成高级脂肪酸盐和甘油,进行肥皂生产 D、鸡蛋清溶液中加入醋酸铅溶液,产生白色沉淀,加足量水,白色沉淀溶解9. 70℃时,200mL过氧化氢溶液在pH=13时分解,甲、乙两组实验中分别只改变一个反应条件,过氧化氢的物质的量随时间的变化图像如图(假设反应前后溶液体积不变)。下列有关说法错误的是( )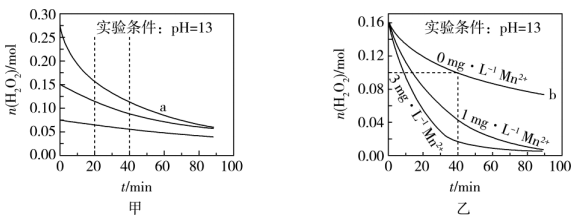 A、实验甲说明过氧化氢溶液浓度越大,分解速率越快 B、实验乙b条件下,0~40min内过氧化氢的分解速率为0.0015mol•L-1•min-1 C、实验乙说明催化剂的浓度越大,对过氧化氢分解速率的影响越大 D、实验甲a条件下,0~20min内过氧化氢分解速率大于0~40min内的分解速率10. 下列装置或操作能达到实验目的的是( )
A、实验甲说明过氧化氢溶液浓度越大,分解速率越快 B、实验乙b条件下,0~40min内过氧化氢的分解速率为0.0015mol•L-1•min-1 C、实验乙说明催化剂的浓度越大,对过氧化氢分解速率的影响越大 D、实验甲a条件下,0~20min内过氧化氢分解速率大于0~40min内的分解速率10. 下列装置或操作能达到实验目的的是( )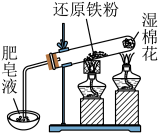
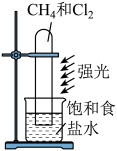
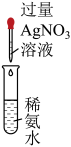
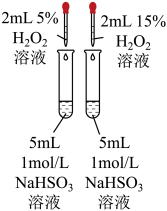
A.探究铁与水蒸气的反应,点燃肥皂泡检验氢气
B.探究与的取代反应
C.配制银氨溶液
D.探究浓度对化学反应速率的影响
A、A B、B C、C D、D11. 历史上被称为“世界八大公害”和“20世纪十大环境公害”之一的洛杉机光化学烟雾事件使人们深刻认识到汽车尾气的危害性。汽车尾气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是( )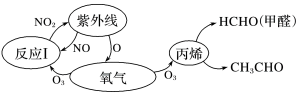 A、丙烯(CH2=CHCH3)中所有原子共平面 B、O2和O3是氧的两种同素异形体 C、反应Ⅰ属于氧化还原反应 D、NO2不是酸性氧化物12. 物质间的转化体现了化学核心素养之——变化观念。下列物质的转化在一定条件下能实现的是( )A、H2SO4(稀)SO2NH4HSO3(NH4)2SO3 B、FeFeCl2Fe(OH)2Fe(OH)3 C、NH3NONO2HNO3 D、CaCl2溶液CaCO3CaO13. 某有机物X的结构简式如图所示,下列有关说法不正确的是( )
A、丙烯(CH2=CHCH3)中所有原子共平面 B、O2和O3是氧的两种同素异形体 C、反应Ⅰ属于氧化还原反应 D、NO2不是酸性氧化物12. 物质间的转化体现了化学核心素养之——变化观念。下列物质的转化在一定条件下能实现的是( )A、H2SO4(稀)SO2NH4HSO3(NH4)2SO3 B、FeFeCl2Fe(OH)2Fe(OH)3 C、NH3NONO2HNO3 D、CaCl2溶液CaCO3CaO13. 某有机物X的结构简式如图所示,下列有关说法不正确的是( )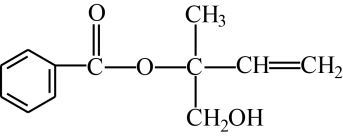 A、X分子中含有三种官能团 B、可用酸性高锰酸钾溶液区别苯和X C、X在一定条件下能发生加成、加聚、取代、氧化等反应 D、在催化剂的作用下,1 mol X最多能与5 mol H2加成14. 如图是一种常用的食品防腐剂的结构简式,下列关于该物质的说法不正确的是( )
A、X分子中含有三种官能团 B、可用酸性高锰酸钾溶液区别苯和X C、X在一定条件下能发生加成、加聚、取代、氧化等反应 D、在催化剂的作用下,1 mol X最多能与5 mol H2加成14. 如图是一种常用的食品防腐剂的结构简式,下列关于该物质的说法不正确的是( )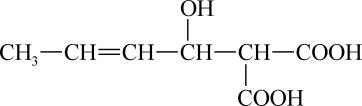 A、该物质的化学式为:C7H10O5 B、该分子中含有两种官能团 C、该物质能发生加聚反应 D、1mol该物质可以和3mol金属钠反应15. 以黄铁矿(主要成分为FeS2 , 其中硫的化合价为-1价)生产硫酸的工艺流程如图,下列说法不正确的是( )
A、该物质的化学式为:C7H10O5 B、该分子中含有两种官能团 C、该物质能发生加聚反应 D、1mol该物质可以和3mol金属钠反应15. 以黄铁矿(主要成分为FeS2 , 其中硫的化合价为-1价)生产硫酸的工艺流程如图,下列说法不正确的是( )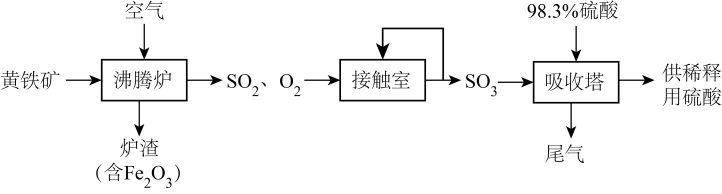 A、将黄铁矿粉碎,可以提高其在沸腾炉中的反应速率 B、沸腾炉中每生成1 mol SO2 , 有11 mol e-发生转移 C、接触室中排放出的SO2、O2循环利用,可提高原料利用率 D、可用浓氨水吸收尾气,并进一步转化为氮肥16. 在一定温度下,在密闭容器中投入X(g)和Y(g),发生反应生成Z(g)。测得各物质浓度与时间关系如图所示(提示:净反应速率等于正、逆反应速率之差)。下列说法错误的是( )
A、将黄铁矿粉碎,可以提高其在沸腾炉中的反应速率 B、沸腾炉中每生成1 mol SO2 , 有11 mol e-发生转移 C、接触室中排放出的SO2、O2循环利用,可提高原料利用率 D、可用浓氨水吸收尾气,并进一步转化为氮肥16. 在一定温度下,在密闭容器中投入X(g)和Y(g),发生反应生成Z(g)。测得各物质浓度与时间关系如图所示(提示:净反应速率等于正、逆反应速率之差)。下列说法错误的是( )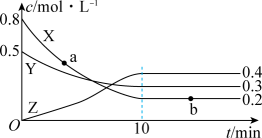 A、a点:正反应速率小于逆反应速率 B、b点:净反应速率等于零 C、上述可逆反应中X、Y、Z的化学计量数之比为3∶1∶2 D、该可逆反应在该反应条件下达到最大限度时,Y的平衡转化率为40%
A、a点:正反应速率小于逆反应速率 B、b点:净反应速率等于零 C、上述可逆反应中X、Y、Z的化学计量数之比为3∶1∶2 D、该可逆反应在该反应条件下达到最大限度时,Y的平衡转化率为40%二、填空题
-
17. 在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价一类”二维图。
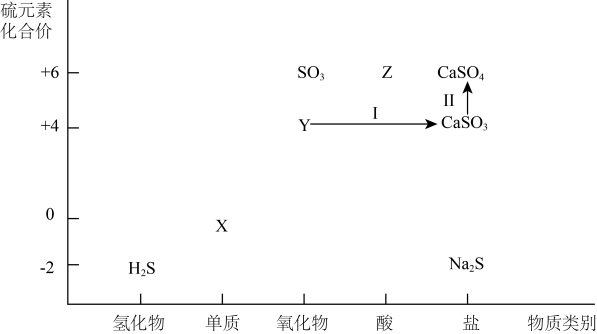
请回答以下问题。
(1)、单斜硫和正交硫两种单质叫作硫元素的。(2)、Y和H2S发生反应的化学方程式为。写出Cu和Z的浓溶液发生反应的化学方程式。(3)、工业上处理废气时,通过步骤Ⅰ和步骤Ⅱ将Y转化为CaSO4再利用。①实现步骤Ⅰ的转化所加试剂的物质类别为(写出一种即可)。
②实现步骤Ⅱ的转化可选择 , 试剂(填序号),选择的依据为。
a.O2b.KI c.H2O2d.Na2S
三、实验题
-
18. 某小组利用溶液与溶液反应,来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定溶液褪色所需时间来判断反应的快慢。实验内容及记录如下:
序号
温度/℃
①
8.00
5.00
3.00
0
20
②
8.00
5.00
3.00
0
30
③
8.00
5.00
1.00
V
20
请回答下列问题:
(1)、mL。(2)、该实验①和②是探究对化学反应速率的影响。(3)、该实验①和③是探究对化学反应速率的影响。(4)、该实验中溶液褪色所用的时间最长的是组实验。(5)、小组同学发现反应速率随时间变化总是如图所示,其中时间内速率变快的主要原因可能是____。 A、反应放热导致温度升高 B、压强增大 C、生成物的催化作用 D、反应物接触面积增大(6)、该小组对实验①测定反应过程中溶液不同时间的温度,结果如表:
A、反应放热导致温度升高 B、压强增大 C、生成物的催化作用 D、反应物接触面积增大(6)、该小组对实验①测定反应过程中溶液不同时间的温度,结果如表:时间/s
0
5
10
15
20
25
35
40
50
温度/℃
25
26
26
26
26
26
26.5
27
27
结合实验目的和表中数据,你得出的结论是:是反应速率明显加快的主要原因。
四、有机推断题
-
19. 乙酸环己酯是一种香料,可用于配制苹果、香蕉等果型香精。一种制备乙酸环己酯的合成路线如图:
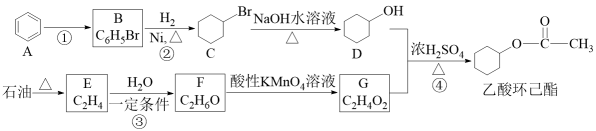
回答下列问题:
(1)、D中所含的官能团名称是 , 由石油获得E的生产工艺称为。(2)、在反应②③④中,属于取代反应的有(填序号),C的分子式为。(3)、写出反应③的化学方程式为;④的化学方程式为。(4)、X是E的同系物,其相对分子质量比E大42,含3个-CH3的X结构简式为。五、原理综合题
-
20. 原电池是化学对人类的一项重大贡献,某学生利用实验探究原电池的工作原理,回答下列问题。(1)、符合某些特征的化学反应理论上都可以设计成原电池。下列化学反应(填字母)不能设计成原电池,原因是。
A. B.
C. D.
(2)、把A、B、C、D四种金属按表中装置进行实验。装置

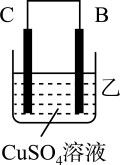

电子从A到B
C电极的质量增加
金属D不断溶解
根据表中信息判断四种金属活动性由大到小的顺序是;
(3)、盐桥式原电池的装置图如下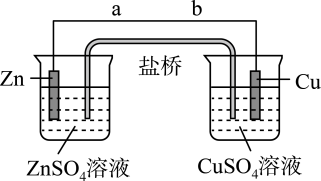
①铜为(填“正”或“负”)极,导线中电子流向为(用a、b表示)
②若装置中铜电极的质量增加3.2g,则导线中转移电子的数目为(用表示阿伏加德罗常数的值)
(4)、③该装置的盐桥中除添加琼脂外,还要添加的饱和溶液,电池工作时,对盐桥中的、的移动方向的表述正确的是( )A、盐桥中的向右侧烧杯移动、向左侧烧杯移动 B、盐桥中的向右侧烧杯移动、向左侧烧杯移动 C、盐桥中的、几回都不移动
-
-
-