广东省肇庆市2022-2023学年高二下学期期末教学质量检测化学试题
试卷更新日期:2023-08-16 类型:期末考试
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11 ~16小题,每小题4分。在每小题给出的四个选项中,只有一项符合题目要求。
-
1. 下列物品不是由合成有机高分子材料制成的是( )
物品




选项
A.宇宙飞船返回舱的涤纶降落伞
B.纯羊毛上衣
C.家用净水器中的聚酰胺超滤膜
D.聚氣乙烯塑胶羽毛球场地板
A、A B、B C、C D、D2. 化学符号是化学学科进行思维的最基本的工具,下列微粒的化学符号表述正确的是( )A、基态Zn原子的价层电子排布图: B、丙酮的球棍模型:
B、丙酮的球棍模型: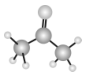 C、乙酸甲酯的结构简式:C3H6O2
D、NH3的电子式:
C、乙酸甲酯的结构简式:C3H6O2
D、NH3的电子式: 3. 下列过程中,共价键被破坏的是( )A、干冰升华 B、食盐溶于水 C、乙烯燃烧 D、钢铁熔化4. 下列有关晶体的说法正确的是( )A、共价晶体的熔点一定高于金属晶体 B、白磷是分子晶体,石英是共价晶体 C、圆柱形容器中结出的冰是圆柱形的,体现了晶体的自范性 D、共价晶体中只含有共价键,离子晶体中只含有离子键5. CH4、NH3、H2O和HF是第二周期常见元素的简单氢化物。下列说法不正确的是( )A、H-F是s-pσ键 B、H2O属于极性分子,CH4属于非极性分子 C、CH4、NH3、H2O和HF的沸点依次升高 D、NH3中H-N-H的键角大于H2O中H-O-H的键角6. 化学与生产、生活密切相关。下列生产生活中的实际应用,涉及的相应化学原理不正确的是( )
3. 下列过程中,共价键被破坏的是( )A、干冰升华 B、食盐溶于水 C、乙烯燃烧 D、钢铁熔化4. 下列有关晶体的说法正确的是( )A、共价晶体的熔点一定高于金属晶体 B、白磷是分子晶体,石英是共价晶体 C、圆柱形容器中结出的冰是圆柱形的,体现了晶体的自范性 D、共价晶体中只含有共价键,离子晶体中只含有离子键5. CH4、NH3、H2O和HF是第二周期常见元素的简单氢化物。下列说法不正确的是( )A、H-F是s-pσ键 B、H2O属于极性分子,CH4属于非极性分子 C、CH4、NH3、H2O和HF的沸点依次升高 D、NH3中H-N-H的键角大于H2O中H-O-H的键角6. 化学与生产、生活密切相关。下列生产生活中的实际应用,涉及的相应化学原理不正确的是( )选项
实际应用
化学原理
A
聚丙烯酰胺可作“尿不湿”吸水材料
聚丙烯酰胺中的氨基具有亲水性
B
用汽油可洗掉衣服上的油漆
物质“相似相溶”
C
CH3CH2Cl可作冷冻镇痛剂
CH3CH2Cl能发生消去反应
D
节日燃放的焰火
电子发生跃迁
A、A B、B C、C D、D7. 冠醚与碱金属离子结合形成超分子,可以用于制备新型的电池材料。部分冠醚的结构简式如图所示。下列说法不正确的是( )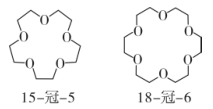 A、1 mol 15-冠-5含有5NA个C-C B、18-冠-6与15-冠-5互为同素异形体 C、冠醚只含有醚键1种官能团 D、冠醚通过不同大小的空穴适配不同的碱金属离子,体现超分子“分子识别”的特征8. 化学为甲流防控提供了强有力的支撑。下列说法正确的是( )A、甲流疫苗中含有的卵清蛋白属于小分子化合物 B、75%的酒精能有效杀灭甲流病毒,主要利用了乙醇的强氧化性 C、医用输液瓶主要原料为聚乙烯,其结构简式为
A、1 mol 15-冠-5含有5NA个C-C B、18-冠-6与15-冠-5互为同素异形体 C、冠醚只含有醚键1种官能团 D、冠醚通过不同大小的空穴适配不同的碱金属离子,体现超分子“分子识别”的特征8. 化学为甲流防控提供了强有力的支撑。下列说法正确的是( )A、甲流疫苗中含有的卵清蛋白属于小分子化合物 B、75%的酒精能有效杀灭甲流病毒,主要利用了乙醇的强氧化性 C、医用输液瓶主要原料为聚乙烯,其结构简式为 D、甲流患者痊愈后可适当摄入淀粉和肉类食物,为身体补充能量
9. 化学是一门以实验为基础的学科,下列实验装置不能达到实验目的的是( )
D、甲流患者痊愈后可适当摄入淀粉和肉类食物,为身体补充能量
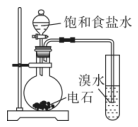
9. 化学是一门以实验为基础的学科,下列实验装置不能达到实验目的的是( )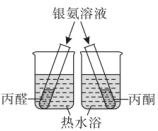

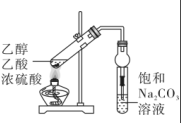
A.鉴别丙醛和丙酮
B.分离NaCl溶液中的蛋白质
C.验证乙炔可使溴水褪色
D.制备乙酸乙酯
A、A B、B C、C D、D10. 布洛芬具有解热镇痛的功效,其分子结构如图所示。下列关于布洛芬的说法正确的是( )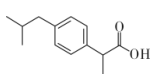 A、与苯互为同系物 B、分子式为C13H16O2 C、分子中共面的碳原子至少有10个 D、苯环上的二氯代物有4种(不含立体异构)11. 类比法是研究物质结构与性质的重要方法。下列说法正确的是( )A、CO2和SiO2的沸点低,常温下都为气体 B、纯液态HCl和熔融NaCl都能够产生自由离子,具有导电性 C、CH3Cl和CH2Cl2分子中碳原子都采用 sp3杂化,为四面体形分子 D、CH3CH2CH2OH与(CH3)2CHOH 分子中都含有羟基,能发生催化氧化反应生成醛12. 元素X、Y、Z、W为短周期主族元素,且原子序数依次增大,X的2p能级中有2个未成对电子,Y是地壳中含量最高的元素 , Z的最高价氧化物对应的水化物为中强碱,W与Y同主族。下列说法正确的是( )A、原子半径:X<Y B、电负性:Y< W C、XY2与WY2的VSEPR模型相同 D、Z的第一电离能大于同周期相邻的元素13. “下列对实验事实的解释不正确的是( )
A、与苯互为同系物 B、分子式为C13H16O2 C、分子中共面的碳原子至少有10个 D、苯环上的二氯代物有4种(不含立体异构)11. 类比法是研究物质结构与性质的重要方法。下列说法正确的是( )A、CO2和SiO2的沸点低,常温下都为气体 B、纯液态HCl和熔融NaCl都能够产生自由离子,具有导电性 C、CH3Cl和CH2Cl2分子中碳原子都采用 sp3杂化,为四面体形分子 D、CH3CH2CH2OH与(CH3)2CHOH 分子中都含有羟基,能发生催化氧化反应生成醛12. 元素X、Y、Z、W为短周期主族元素,且原子序数依次增大,X的2p能级中有2个未成对电子,Y是地壳中含量最高的元素 , Z的最高价氧化物对应的水化物为中强碱,W与Y同主族。下列说法正确的是( )A、原子半径:X<Y B、电负性:Y< W C、XY2与WY2的VSEPR模型相同 D、Z的第一电离能大于同周期相邻的元素13. “下列对实验事实的解释不正确的是( )
选项 实验事实 解释 A 乙酸的酸性弱于甲酸 乙酸中“一CH3” 是推电子基团,羧基中羟基的极性较小,酸性较弱 B HF的稳定性强于HCl H-F的键长比H-Cl短,键能较大,分子更稳定 C 对羟基苯甲酸的沸点高于邻羟基 对羟基苯甲酸分子间存在氢 键 D I2的熔点高于Br2 碘原子的电负性大于溴原子 A、A B、B C、C D、D14. 有机物Z是一种常见的医药中间体,可由有机物X和Y在一定条件下反应制得。下列说法不正确的是( )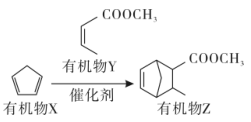 A、有机物X中含有1个手性碳原子 B、该反应的类型为加成反应 C、有机物Y难溶于水 D、有机物Z能发生加成反应、取代反应15. 有机物A是一种常见的黄酮类化合物,具有抗肿瘤、抗病毒的功能,其分子结构如图所示。下列关于有机物A的说法不正确的是( )
A、有机物X中含有1个手性碳原子 B、该反应的类型为加成反应 C、有机物Y难溶于水 D、有机物Z能发生加成反应、取代反应15. 有机物A是一种常见的黄酮类化合物,具有抗肿瘤、抗病毒的功能,其分子结构如图所示。下列关于有机物A的说法不正确的是( ) A、有4种官能团 B、不能发生水解反应 C、能与NaHCO3溶液反应产生CO2 D、1 mol有机物A最多能与5 mol Br2发生反应16. “下列实验操作能达到实验目的的是( )
A、有4种官能团 B、不能发生水解反应 C、能与NaHCO3溶液反应产生CO2 D、1 mol有机物A最多能与5 mol Br2发生反应16. “下列实验操作能达到实验目的的是( )选项
实验操作
实验目的
A
向苯中加入适量酸性高锰酸钾溶液,振荡,观察溶液是否褪色
检验苯分子中是否含碳碳双键
B
向盛有CH3CH2Br的试管中加入适量NaOH溶液,加热并充分反应后,再加入几滴AgNO3溶液
验证CH3CH2Br的水解产物中有NaBr
C
向装有苯和苯酚混合物的分液漏斗中加入足量溴水,充分反应后分液
除去苯中混有的苯酚
D
向盛有少量淀粉溶液的试管中加入几滴稀硫酸,加热一段时间后,加入几滴新制Cu(OH)2悬浊液,继续加热
验证淀粉的水解产物中有葡萄糖
A、A B、B C、C D、D二、非选择题:本题共4小题,全部为必考题,共56分。
-
17. 苯甲酸甲酯(
 )常用作合成树脂和橡胶的溶剂以及聚酯纤维的助染剂。某化学实验小组以苯甲酸(
)常用作合成树脂和橡胶的溶剂以及聚酯纤维的助染剂。某化学实验小组以苯甲酸(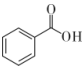 )和甲醇(CH3OH) 为原料,利用如图所示的装置制备苯甲酸甲酯。
)和甲醇(CH3OH) 为原料,利用如图所示的装置制备苯甲酸甲酯。
已知:各物质的沸点以及25℃时在水中的溶解度如下表所示。
物质
苯甲酸
甲醇
苯甲酸甲酯
沸点/℃
249
64.7
199.6
溶解度
微落于水
与水互溶
难溶于水
回答下列问题:
(1)、仪器A的名称为 , 仪器B的作用是 , 冷却水方向为(填“上”或“下”,下同)口进口出。(2)、向仪器A中加入12.2 g苯甲酸和足量甲醇,再小心加入2 mL浓硫酸和几块碎瓷片,点燃酒精灯加热一段时间,得到苯甲酸甲酯粗产品。①写出该反应的化学方程式:。
②浓硫酸的作用有。
(3)、将仪器A中反应后的液体转移到烧杯中,依次使用水洗、饱和Na2CO3溶液洗、水洗,每次洗涤后,将有机层和水层分离的操作是。(4)、洗涤后,利用蒸馏装置将有机层进行蒸馏,收集℃的馏分。(5)、若蒸馏后,最终收集得到10.88 g产品,则本实验中苯甲酸甲酯的产率为。18. 钴素有“工业的牙齿”“工业味精”之称,自我国大力推广锂离子电池等新能源以来,钴的消耗量逐年攀升。一种从废旧锂电池中回收钴资源的工艺流程如图所示。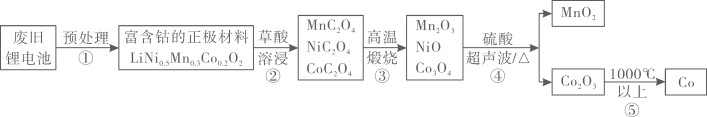
回答下列问题:
(1)、钻在元素周期表的位置为;下列基态或激发态Mn原子价层电子排布图中,能量最高的是(填标号)。A.
 B.
B. C.
C. (2)、已知电解熔融CoCl2也能制备金属钴,则CoCl2的晶体类型是。CoCl2熔点为735 ℃,CoF2熔点为1 200℃,试分析CoCl2的熔点比CoF2的熔点低的原因:。(3)、步骤④中,为了检测固体上是否有Ni2+残留,可将最后一次洗涤液加入氨水和丁二酮肟(镍试剂)的混合物中。若有残留,则会生成一种含镍的整合物沉淀,其结构如图所示。
(2)、已知电解熔融CoCl2也能制备金属钴,则CoCl2的晶体类型是。CoCl2熔点为735 ℃,CoF2熔点为1 200℃,试分析CoCl2的熔点比CoF2的熔点低的原因:。(3)、步骤④中,为了检测固体上是否有Ni2+残留,可将最后一次洗涤液加入氨水和丁二酮肟(镍试剂)的混合物中。若有残留,则会生成一种含镍的整合物沉淀,其结构如图所示。
该螯合物中,碳原子采用的杂化方式有;该物质结构中存在的作用力有极性共价键、非极性共价键、。
(4)、工业上利用CoO生产钴蓝。钴蓝是一种无毒、耐高温的颜料,可用于制作蓝色钴玻璃,其主要成分是Co(AlO2)2 , 阴离子的空间结构为。19. 五水硫酸铜(CuSO4·5H2O),俗名蓝矾、胆矾,具有催吐、解毒、祛腐的作用。回答下列问题:
(1)、基态硫原子的价层电子排布式为。(2)、CuSO4·5H2O可写作[Cu(H2O)4]SO4·5H2O,其中为配位体,配位数为。(3)、铜的某种氧化物是一种新型的半导体光催化剂,晶胞结构如图所示,其化学式为。
①晶胞中O2-周围距离最近且相等的O2-共有个,设A原子坐标为(0,0,0),B原子坐标为(1,1,1),则C原子坐标为。
②已知该晶体密度为ρ g/cm3 , 阿伏加德罗常数用NA表示,则晶胞的棱长为nm(列出计算式即可)。
20. 丁苯酞是我国自主研发的一种治疗缺血性脑梗死的药物,其合成路线如图所示。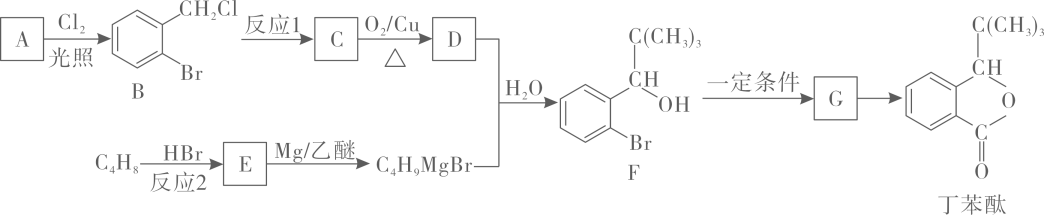
已知:
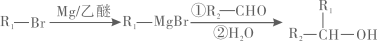
回答下列问题:
(1)、有机物A的名称为;A→B的反应类型为。(2)、反应1的条件是;有机物C的官能团名称为。(3)、写出反应2的化学方程式:。(4)、有机物G通过分子内脱水可得到丁苯酞,写出G的结构简式:。(5)、有机物H与F的组成元素相同,且相对分子质量比F小28,写出符合下列条件的H的其中一种同分异构体:。①能与FeCl3溶液发生显色反应;②核磁共振氢谱有4 组峰,且峰面积之比为6:2:2:1
(6)、参考题中信息和所学知识,写出以CH3CH2Br为原料制备CH3CH2CH(OH)CH3的合成路线(其他无机试剂任选)。