黑龙江省大庆市2023年中考一模化学试题
试卷更新日期:2023-08-16 类型:中考模拟
一、单选题
-
1. 每年的6月5日为世界环境日,2023年的主题是“建设人与自然和谐共生的现代化”。下列做法与这一主题不相符的是( )A、研发高效低毒农药有助于保障粮食安全 B、生活污水集中处理达标后排放 C、开发新能源,减少使用化石燃料 D、多使用一次性餐具,可以更好的节约材料2. 大庆有的地方土壤碱性较强,同学们取土壤测其酸碱性。在测定土壤酸碱性的实验中、下列操作规范的是( )A、装入土样粉末
 B、滴加蒸缩水
B、滴加蒸缩水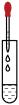 C、振荡土壤液
C、振荡土壤液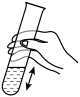 D、测定酸碱性
D、测定酸碱性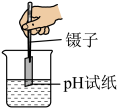 3. 下列描述中,前者是利用物质的化学性质,后者发生的是化学变化的是( )A、稀有气体作电光源、 湿衣晾干 B、汽油用作燃料、 铁锅生锈 C、液氮制造低温环境 、小麦磨粉 D、生石灰用于食品加热、 滴水成冰4. 分析推理及归纳总结是化学学科核心素养的重要组成部分。以下说法正确的是( )A、堆放杂物的纸箱着火可用水浇灭,则所有物质着火都可用水浇灭 B、根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水 C、点燃甲烷前需要检验纯度,所以点燃可燃性气体前要检验纯度 D、酸雨的pH<7,所以pH<7的雨水都是酸雨5. 下列有关叙述对应的化学方程式,所属基本反应类型都正确的是( )A、铁与稀硫酸反应:置换反应 B、铝在空气中与氧气反应生成一层致密薄膜:氧化反应 C、硫酸厂污水可用熟石灰中和处理:复分解反应 D、氧化汞持续加热:分解反应6. 化学实验的设计能力是学习化学的重要能力之一,下列实验设计方案可行的是( )
3. 下列描述中,前者是利用物质的化学性质,后者发生的是化学变化的是( )A、稀有气体作电光源、 湿衣晾干 B、汽油用作燃料、 铁锅生锈 C、液氮制造低温环境 、小麦磨粉 D、生石灰用于食品加热、 滴水成冰4. 分析推理及归纳总结是化学学科核心素养的重要组成部分。以下说法正确的是( )A、堆放杂物的纸箱着火可用水浇灭,则所有物质着火都可用水浇灭 B、根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水 C、点燃甲烷前需要检验纯度,所以点燃可燃性气体前要检验纯度 D、酸雨的pH<7,所以pH<7的雨水都是酸雨5. 下列有关叙述对应的化学方程式,所属基本反应类型都正确的是( )A、铁与稀硫酸反应:置换反应 B、铝在空气中与氧气反应生成一层致密薄膜:氧化反应 C、硫酸厂污水可用熟石灰中和处理:复分解反应 D、氧化汞持续加热:分解反应6. 化学实验的设计能力是学习化学的重要能力之一,下列实验设计方案可行的是( )选项
实验目的
实验方案
A
鉴别氯化钠、氢氧化钠两种固体
样品中加入等量蒸馏水,搅拌,测量溶解前后液体温度
B
比较铁、铝金属活动性

C
由氧化铜制取氢氧化铜
向氧化铜中加入氢氧化钠溶液
D
除去氢氧化钠溶液中的氢氧化钡
加入过量稀硫酸,过滤
A、A B、B C、C D、D7. 以下四个图像与对应操作描述不相符的是( ) A、向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸 B、加热分解高锰酸钾 C、向一定质量稀盐酸中,逐渐加入固体至过量 D、向等质量、等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉8. 下列说法正确的有( )
A、向等质量的氧化镁、氢氧化镁中,分别加入质量分数相同的稀盐酸 B、加热分解高锰酸钾 C、向一定质量稀盐酸中,逐渐加入固体至过量 D、向等质量、等质量分数的稀硫酸中,分别加入足量的铁粉和锌粉8. 下列说法正确的有( )
①张青莲主持测定了铟等元素相对原子质量的新值。
②在低温条件下加压,使空气转变为液态,然后升温,可分离液态空气制取氧气。
③废旧金属的回收利用,不仅可以节约金属资源,而且可以减少对环境的污染。
④加碘盐是在食盐中加入一定量的碘酸钾 , 其中碘元素在周期表中的信息及碘原子的结构示意图如图所示,图中n的值为5。
⑤为确定混合溶液的成分,某学习小组同学进行了以下实验:Ⅰ经测定,溶液;Ⅱ取部分未知溶液加入过量溶液,有白色沉淀产生;Ⅲ取Ⅱ中部分溶液加入溶液,无明显现象。由此可知混合溶液中一定含有 , 一定不含有
A、2个 B、3个 C、4个 D、5个9. 某兴趣小组用硝酸钾进行了图甲所示的实验,硝酸钾溶解度与温度的关系如图乙,硝酸钾和氯化钠的溶解度曲线如图丙。下列分析中正确的是( ) A、①中所得硝酸钾溶液为140克 B、②中硝酸钾溶液为饱和溶液 C、②中溶液的溶质质量分数为50% D、时,若将含少量的固体药品溶于水中,得到的饱和溶液,将该溶液经蒸发结晶、过滤、洗涤、烘干等操作后,可得到纯净的晶体10. 海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请分析粗盐“制碱”的流程图(如下图)。下列说法正确的是( )
A、①中所得硝酸钾溶液为140克 B、②中硝酸钾溶液为饱和溶液 C、②中溶液的溶质质量分数为50% D、时,若将含少量的固体药品溶于水中,得到的饱和溶液,将该溶液经蒸发结晶、过滤、洗涤、烘干等操作后,可得到纯净的晶体10. 海洋是人类宝贵的自然资源,海水“晒盐”和海水“制碱”体现了人类利用和改造自然的智慧,请分析粗盐“制碱”的流程图(如下图)。下列说法正确的是( ) A、步骤Ⅰ除杂中,可用溶液浸洗粗盐,溶解除去其中的可溶性杂质,为了减少损失,浸洗溶液应选用的不饱和溶液,这种方法是物理方法 B、步骤Ⅲ先向饱和食盐水中通入二氧化碳,再通入氨气,这样做的目的是有利于吸收二氧化碳或吸收尽可能多的二氧化碳 C、步骤Ⅳ发生的反应属于化合反应 D、我国化学家侯德榜创立的联合制碱法将制碱与制氨结合起来,大大提高了原料的利用率,节约了成本
A、步骤Ⅰ除杂中,可用溶液浸洗粗盐,溶解除去其中的可溶性杂质,为了减少损失,浸洗溶液应选用的不饱和溶液,这种方法是物理方法 B、步骤Ⅲ先向饱和食盐水中通入二氧化碳,再通入氨气,这样做的目的是有利于吸收二氧化碳或吸收尽可能多的二氧化碳 C、步骤Ⅳ发生的反应属于化合反应 D、我国化学家侯德榜创立的联合制碱法将制碱与制氨结合起来,大大提高了原料的利用率,节约了成本二、填空题
-
11. 用合适的化学用语填空:(1)、两个氦分子。(2)、硝酸银溶液中的金属阳离子。(3)、和中都含有的阴离子。(4)、标出亚硝酸钠(化学式)中氮元素的化合价。12. 请回答下列问题。(1)、节能减排中“减排”的一个重要手段是合理利用二氧化碳,科学家在一定条件下将二氧化碳转化为甲烷,其反应的微观过程如图所示。

甲、乙、丙、丁四种物质中属于有机物的是(填化学式);该反应的化学方程式是。
(2)、古代用墨书写的典籍保存至今而不变色,体现了碳在常温下的化学性质 , 如今可将信息存储在芯片上,芯片中含有的某元素在元素周期表中的部分信息如图,该元素的名称是。 (3)、绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,则A的化学式为 , 反应⑨的化学方程式为。
(3)、绘制知识网络是化学学习的一种有效方法,元素单质及其化合物的“价态—类别”二维图就是其中的网络图之一。如图是铁及其化合物的“价态—类别”二维图,则A的化学式为 , 反应⑨的化学方程式为。
三、综合应用题
-
13. 请回答下列问题。
Ⅰ.“共享单车”的使用符合“低碳生活,绿色出行”的理念,颇受人们的喜爱。
 (1)、如图所示,“共享单车”的部件中,属于有机合成材料的是(填字母)。(2)、“共享单车”采用实体轮胎可有效防止爆胎,而普通自行车夏天容易爆胎。请用分子的观点解释,普通自行车“夏天易爆胎”的原因。(3)、扫描二维码可租用“共享单车”。“共享单车”上二维码标牌的制作材料一般用PVC[化学式],PVC中碳元素和氢元素的质量比为。(4)、Ⅱ.实验室制取气体的部分装置如图所示,请回答下列问题。
(1)、如图所示,“共享单车”的部件中,属于有机合成材料的是(填字母)。(2)、“共享单车”采用实体轮胎可有效防止爆胎,而普通自行车夏天容易爆胎。请用分子的观点解释,普通自行车“夏天易爆胎”的原因。(3)、扫描二维码可租用“共享单车”。“共享单车”上二维码标牌的制作材料一般用PVC[化学式],PVC中碳元素和氢元素的质量比为。(4)、Ⅱ.实验室制取气体的部分装置如图所示,请回答下列问题。
装置B中仪器a的名称是。
(5)、实验室用装置A制取氧气,其反应的化学方程式为。(6)、利用F装置可以完成的实验有(填序号)。①瓶内装有澄清石灰水,气体从b端通入,检验氧气中是否混有。
②气体从b端通入,收集氢气。
③在c端接量筒,瓶内装满水,氧气从b端通入,测量气体的体积。
④若瓶中装满氧气,需要瓶中氧气时,可用水将装置中的氧气排出,水应从导管c口通入。
(7)、通常状况下,硫化氢()是一种密度比空气大且能溶于水的气体,实验室常用块状硫化亚铁()和稀硫酸在常温下反应制取硫化氢气体,则制取硫化氢气体可选用的装置组合是(填字母)。四、推断题
-
14. A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系。请回答下列问题。
 (1)、写出反应化学方程式:过程①的反应化学方程式是。过程③中生成A的反应化学方程式是。(2)、E的化学式是 , 产生无色气体E的原因是。(3)、图中的反应没有涉及的基本反应类型是。(4)、金属C在的条件下容易生锈。
(1)、写出反应化学方程式:过程①的反应化学方程式是。过程③中生成A的反应化学方程式是。(2)、E的化学式是 , 产生无色气体E的原因是。(3)、图中的反应没有涉及的基本反应类型是。(4)、金属C在的条件下容易生锈。五、流程题
-
15. 利用工业废液(主要含NaHS以及少量Na2S和Mg、Ca、Fe的化合物)制备重要化工原料硫酸钠的流程图如下。

已知:Ⅰ、粗品硫酸钠含少量H2SO4、MgSO4、CaSO4、FeSO4等杂质。
Ⅱ、在溶液里,微溶物发生复分解反应可转化为不溶物。
Ⅲ、部分物质的溶解性见表。
部分物质的溶解性表(室温)
阴离子
阳离子
Na+
溶
溶
Ca2+
微溶
不溶
Mg2+
溶
微溶
Fe2+
溶
不溶
(1)、操作①名称是。(2)、“反应器1、2”内均需要进行的操作是。(3)、泥渣的成分有MgCO3、等。(4)、流程中可循环使用的物质是和。(5)、“反应器1”中NaHS发生复分解反应生成H2S气体的化学方程式是。六、科学探究题
-
16. 运用化学知识,开展科学探究。(1)、【探究一】海洋封存是实现“碳中和”的途径之一,其原理是利用在水等溶剂中的溶解性来吸收 , 某小组开展如下探究。
活动一:在水和食盐水(模拟海水)中的溶解情况

相同条件下,该小组分别用排水法、排食盐水法收集(如图1),待收集后,移出导管,每隔一段时间观察并记录量筒内体积。重复实验,所测数据平均值如下表:
时间/h
0
0.5
6
12
24
48
排水法时体积/
100
98.5
85.5
77
66
59
排食盐水时体积/
100
99
93
90.5
89
88
①图1发生装置中反应的化学方程式为。
②由上表数据分析:
a.能用排水法收集的理由是。
b.相同条件下,等体积水和食盐水吸收更多的是(填“水”或“食盐水”)。
(2)、活动二:探究植物油隔离对在水中溶解情况的影响
设计并完成以下对照实验:用两个量筒分别收集倒置于水槽中,向其中一个量筒内注入少量植物油,使与水被植物油隔开(与植物油不反应),测得量筒内体积随时间变化曲线如图2。分析该图可得出的结论是。
(3)、活动三:深度探究“活动二”中的溶解情况
①用图3表示无植物油隔离时,量筒内气体中存在的分子的微观示意图。请参照图3的表示方式,在图4方框中画出有植物油隔离时,量筒内植物油和水中存在的分子的微观示意图(植物油分子用
 表示)。
表示)。②为检验有植物油隔离时是否会进入水中,请设计实验方案:。
(4)、【探究二】化学兴趣小组的同学们在进行“碱与酸碱指示剂反应”的实验时,将酚酞溶液滴入溶液中,溶液变成了红色,但过一会儿红色却消失了。于是,兴趣小组的同学们对这一异常现象进行了探究。【提出问题】滴有酚酞的溶液由红色褪为无色的原因是什么?
【猜想与假设】甲同学:酚酞与发生了反应;乙同学:溶液与空气中的发生了反应;丙同学:与溶液浓度大小有关。
【设计与实验】甲、乙、丙三位同学为了验证各自的猜想,设计并进行了如下实验,请你与他们一起探究。
③甲同学设计并完成如下实验:
实验步骤
实验目的
实验现象
实验结论
Ⅰ取少量实验中的溶液于试管中,加热煮沸
溶液变红,过一会儿红色消失
甲同学的猜想(填“正确”或“不正确”)
Ⅱ将Ⅰ中的溶液冷却后滴入酚酞溶液,并滴一些植物油在其上方
隔绝氧气
④乙同学设计图所示的装置进行实验,一段时间后,试管中溶液的红色褪去,他认为自己的猜想正确,试管中反应的化学方程式为。丁同学认为乙同学的猜想不正确,理由是。丁同学为了进一步探究试管中溶液红色褪去的原因,用试纸测试管中的溶液,结果 , 说明溶液显酸性,造成试管中溶液红色褪去的原因可能是。

⑤丙同学为了验证自己的猜想,使用色度传感器测量溶液颜色的变化(说明:溶液无色时,色度传感器测得的数值为100%)。他在三个专用容器中分别加入等量的5%、10%、20%的溶液,然后各滴加2滴酚酞溶液,同时放入色度传感器进行测量.测出溶液颜色的变化曲线如图所示,由此判断自己的猜想正确。你能从变化曲线中总结出的规律有(写一条)。

【实验结论】滴有酚酞的溶液由红色褪为无色与溶液的浓度有关。
17. 松花蛋也叫皮蛋,将新鲜鸭蛋经过一番的加工制成的松花蛋,是人们喜爱的食品。兴趣小组同学在网上看到用皮蛋粉制作皮蛋时产生了浓厚的兴趣,于是以“皮蛋制作”为主题开展项目式学习:探究与实践——制作松花蛋。
Ⅰ.配制皮蛋粉
在老师的指导下,同学们将“石灰”、纯碱和食盐按照一定比例混合,制成皮蛋粉。
【提出问题】配料中所用“石灰”是生石灰还是熟石灰?
【查阅资料】相同条件下,生石灰、熟石灰与水混合后均能放出热量,但放出的热量不同。
【实验探究】常温下,将“石灰”、生石灰和熟石灰分别加入水中,测量固体加入前后温度的变化情况。
(1)、实验过程中需要保持不变的量是。(写一点)(2)、【数据分析】根据温度的数据比对,可知配料中的“石灰”为生石灰。Ⅱ.浸鲜蛋
向配制的皮蛋粉中加入一定量的水,充分反应后过滤,所得滤液称为浸出液,将新鲜鸭蛋放入其中浸泡即可。
老师强调,制作过程中一定要戴上胶皮手套。
浸出液中还含有哪些溶质?
向皮蛋粉中加水时,发生反应的化学方程式为。
(3)、分析上述过程,可知浸出液中一定含有会腐蚀皮肤的物质是。(填化学式)(4)、同学们进行了如下探究,请完成如表(不考虑生石灰中杂质的影响)。预测假设
实验方案
实验现象
实验结论
浸出液中含碳酸钠
浸出液中不含碳酸钠
浸出液中含氢氧化钙
浸出液中含有氢氧化钙
(5)、综合分析,确定皮蛋浸出液中的溶质有(写化学式)。(6)、Ⅲ.品皮蛋制作过程中,碱液会渗入皮蛋使之略带涩味。老师说食用时可以蘸少量食醋去除涩味,该化学反应的微观实质是。
七、计算题
-
18. 为测定某实验废液中硫酸铜和硫酸的质量分数,分别在三只烧杯中倒入50g废液,并在烧杯中依次加入一定量的铁粉。实验结束后,测得的数据见如表:
第一组
第二组
第三组
反应前加入铁粉质量/g
5.6
8.4
11.2
反应后剩余固体的质量/g
3.2
3.2
6.0
反应后质量(H2)损失/g
0.1
0.2
0.2
请回答:
(1)、对比第一、二组数据,第一组实验结束后,废液中的(填化学式)已全部参加反应;(2)、通过分析第二、三组数据,50g废液与铁粉反应生成氢气质量最多为;(3)、经计算,50g废液中所含硫酸的质量为 , 硫酸铜的质量分数为。
-
-
-