“高效课堂”1.3.2 硫酸的性质(基础版)--2023-2024学年浙教版科学九年级上册
试卷更新日期:2023-08-16 类型:同步测试
一、单选题
-
1. 下列物质敞口露置在空气中,质量会增加的是( )A、浓盐酸 B、浓硫酸 C、食盐水 D、硫酸铜溶液2. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、稀释浓硫酸
 B、测稀硫酸的pH
B、测稀硫酸的pH  C、倾倒稀硫酸
C、倾倒稀硫酸  D、滴加稀硫酸
D、滴加稀硫酸  3. 下列常用来改良酸性土壤的物质是( )A、熟石灰 B、硫酸 C、纯碱 D、食盐4. 实验室内一些危险的物品应贴有相应的警告标志。如表是盛放浓硫酸试剂瓶上的标签,该试剂瓶上还需贴上印有( )
3. 下列常用来改良酸性土壤的物质是( )A、熟石灰 B、硫酸 C、纯碱 D、食盐4. 实验室内一些危险的物品应贴有相应的警告标志。如表是盛放浓硫酸试剂瓶上的标签,该试剂瓶上还需贴上印有( )中文名称
浓硫酸
密度
1.84克/厘米3
质量分数
98%
颜色状态
无色粘稠、油状液体
特性
强腐蚀性、酸性等
A、 B、
B、  C、
C、 D、
D、  5. 铅蓄电池中含有硫酸,如果不慎将硫酸漏到大理石地面上,会发出嘶嘶声,并有气体产生。这种气体是( )A、二氧化硫 B、氧气 C、氢气 D、二氧化碳6. 小科在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液,如图所示,在该实验过程的操作中,下列有关操作与目的分析均正确的是( )
5. 铅蓄电池中含有硫酸,如果不慎将硫酸漏到大理石地面上,会发出嘶嘶声,并有气体产生。这种气体是( )A、二氧化硫 B、氧气 C、氢气 D、二氧化碳6. 小科在碳酸钠溶液中滴加氯化钙溶液,产生白色沉淀,然后再滴入适量经过稀释的硫酸溶液,如图所示,在该实验过程的操作中,下列有关操作与目的分析均正确的是( ) A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 D、戊中将水缓缓倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅7. 对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越強。下列叙述中,正确的是( )A、常温下,10%的稀硫酸的pH比2%的稀硫酸大 B、加入中性的盐溶液可以降低稀硫酸的pH C、加入少量锌和镁等金属可以升高稀硫酸的pH D、加入少量碳酸钠可以降低稀硫酸的pH8. 为了研究稀硫酸的性质,教材中设计了如图所示实验。分别将过量的稀硫酸滴入盛有锌粒、氧化铁粉末、氧化铜粉末、氢氧化铜和氯化钡溶液的5支试管中。关于本实验下列说法正确的是( )
A、甲中试剂瓶标签正对手心,是为了防止手被腐蚀 B、乙中将滴管伸入试管内,是为了防止试剂滴落到试管外 C、丁中试剂瓶盖倒放在桌面上,主要是为了避免瓶中试剂受污染 D、戊中将水缓缓倒入浓硫酸并搅拌,是为了防止局部过热引起酸液飞溅7. 对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越強。下列叙述中,正确的是( )A、常温下,10%的稀硫酸的pH比2%的稀硫酸大 B、加入中性的盐溶液可以降低稀硫酸的pH C、加入少量锌和镁等金属可以升高稀硫酸的pH D、加入少量碳酸钠可以降低稀硫酸的pH8. 为了研究稀硫酸的性质,教材中设计了如图所示实验。分别将过量的稀硫酸滴入盛有锌粒、氧化铁粉末、氧化铜粉末、氢氧化铜和氯化钡溶液的5支试管中。关于本实验下列说法正确的是( ) A、所有的反应均体现了酸的通性 B、把稀硫酸改成稀盐酸现象都相同 C、氧化铁与硫酸反应生成硫酸亚铁 D、反应后的溶液全部倒进废液缸不再有新的反应9. 通过化学反应制取盐的途径很多。为了制得硫酸铁,下列方案可行的是( )
A、所有的反应均体现了酸的通性 B、把稀硫酸改成稀盐酸现象都相同 C、氧化铁与硫酸反应生成硫酸亚铁 D、反应后的溶液全部倒进废液缸不再有新的反应9. 通过化学反应制取盐的途径很多。为了制得硫酸铁,下列方案可行的是( )①铁与稀硫酸反应; ②氧化铁与稀硫酸反应; ③氯化铁与硫酸钠反应.
A、①②③ B、②③ C、①③ D、②10. 在研究稀硫酸性质时,分别将一定量的稀硫酸滴入盛有锌粒、氧化铜粉末、氢氧化铜粉末和氯化钡溶液的4支试管中。有关实验的说法错误的是( ) A、反应①中有气泡产生 B、反应②中铜的化合价升高 C、反应③中将生成蓝色溶液 D、反应④属于复分解反应
A、反应①中有气泡产生 B、反应②中铜的化合价升高 C、反应③中将生成蓝色溶液 D、反应④属于复分解反应二、填空题
-
11. 在①干冰②硫酸铜③氧气④空气,等物质中,常用于人工降雨的是;属于混合物的是; 属于单质的是; 由离子构成的是;12. 实验室化学试剂常需要密封保存.比如长期敞口放置浓硫酸,会因为其具有 而导致浓度减小,而浓盐酸会因为具有 也导致浓度减小。13. 常见的较为复杂的离子(带电原子团)
离子名称
离子符号
离子所带电荷
硫酸根离子
碳酸根离子
-2
碳酸氢根离子
硝酸根离子
-1
氢氧根离子
OH-
-1
铵根离子
+1
磷酸根离子
-3
说明:原子团右上角的数字表示的是整个原子团所带的电荷,而不是某个原子所带的电荷。
14.某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
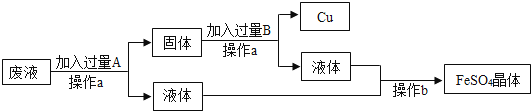
(1)操作a的名称是 , 该操作中用到的玻璃仪器有 . 操作b的名称是 .
(2)写出流程中有关反应的化学方程式: .
三、实验探究题
-
15. 证据是科学探究中获得结论的最重要的依据,让我们一起经历一次寻找证据的旅程吧。
[实验目的]制取纯净的硫酸钡
[反应原理] Na2SO4+ Ba(NO3)2 =BaSO4↓+2NaNO3
[实验步骤]取适量的硫酸钠和硝酸钡溶液反应,过滤、洗涤、干燥得到纯净的硫酸钡。
(1)、实验中,能直接观察到说明硫酸钠和硝酸钡溶液发生化学反应的证据是:。(2)、判断任一反应物是否完全反应的证据可按如下方法获取:猜想
方案
证据
结论
氯化钡可能已
完全反应
取少量滤液,加入稀硫酸溶液,观察现象
无白色沉淀生成
氯化钡已完全反应
硫酸钠可能已
完全反应
。
。
硫酸钠未完全反应
(3)、如果实验证明硝酸钡已经反应完全,要寻找硫酸钡已纯净的证据,我们可以从证明实验制得的碗酸钡中没有(填化学式)来设计实验方案。16. 某化学兴趣小组通过如下实验由废铁屑制备硫酸亚铁晶体(FeSO4·7H2O):①在洗涤过的废铁屑中加入适量稀硫酸,反应结束后过滤.
②将滤液转入到密闭容器中,静置、冷却析出硫酸亚铁晶体.
③待结晶完毕后,滤出晶体,用少量低温的水洗涤晶体3次.
请回答下列问题:
(1)、在步骤①过滤时,所需用到的玻璃仪器中,除漏斗、烧杯外,还需 .(2)、写出步骤①中发生反应的化学方程式: .(3)、步骤③中洗涤晶体用的水必须少量且低温,其原因是 .(4)、为了判断步骤③中晶体表面吸附的硫酸是否洗净,有人向第3次洗涤液中滴加硝酸钡溶液和稀硝酸,得到白色沉淀,以此证明该晶体并未洗净.该结论是否可靠?为什么? .四、解答题
-
17. 同学用一定溶质质量分数的稀硫酸做“氧化铜+硫酸→硫酸铜+水”的实验,其五次实验结果如下表所示:
实验次数
氧化铜/g
硫酸溶液/g
硫酸铜/g
1
2.0
120
4.0
2
4.0
120
8.0
3
6.0
120
9.6
4
8.0
200
16.0
5
10.0
200
x
根据实验结果填写下列空格:
(1)、哪几次反应氧化铜有剩余?。(2)、表中 x 的值是。(3)、求硫酸溶液的溶质质量分数。